第一作者联系方式: E-mail:lcyswu@163.com
EIN2是植物体内乙烯信号转导的中心元件, 负责将乙烯信号由内质网传递到细胞核中。本文通过检索桑树基因组数据, 获得一个
EIN2 is a central component of ethylene signaling pathway, transferring the ethylene signal from endoplasmic reticulum to nucleus. A putative
乙烯是一种重要的植物激素, 广泛参与植物生长发育和衰老的整个生长周期, 包括种子萌发、实生苗生长、叶片伸展、花蕾开放和衰老脱落以及果实后熟等[ 1]。乙烯同时还是一种信号分子, 参与植物对逆境的应答[ 2]。乙烯在植物中的生物学效应主要通过其生物合成和信号转导两方面来实现。对拟南芥的研究表明, 乙烯信号的转导主要是通过ETR、EIN2、EIN3/EIL和ERF四级元件。乙烯信号进入细胞后, 位于内质网上乙烯受体(ETR1、ETR2、ERS1、ERS2和EIN4)能够与乙烯结合, 使CTR1失活, 并将信号传递给EIN2, 再传递到位于细胞核的EIN3/ EIL和ERF, 最终调控乙烯相关蛋白的表达[ 3, 4]。
EIN2元件被认为是将乙烯信号由内质网传递到细胞核的中间“桥梁”。在缺乏乙烯信号时, 负调控元件CTR1磷酸化修饰EIN2, 阻止EIN2传递信号; 当ETR接收到乙烯信号后, CTR1的失活会导致EIN2去磷酸化, 其C末端(CNED)被切割下来进入细胞核, 实现信号的传递[ 5, 6]。此外, 当EIN2功能缺失时, 植物体对乙烯不敏感[ 7]。因此, EIN2被认为是乙烯信号转导的中心元件, 不仅如此, 也被认为可能参与不同激素信号途径, 以及响应生物或非生物胁迫[ 7, 8, 9]。
桑树( Morus albaL.)既是家蚕的主要饲料, 还有生态学功能、药用、食用等多种用途的非绢丝开发价值。长期以来由于桑树在分子生物学方面的研究相对滞后, 有关桑树乙烯信号转导方面的研究还未见报道。本研究利用最新公布的桑树基因库(http:// morus.swu.edu.cn/morusdb/)数据, 获得了一个 EIN2同源基因, 并对初步研究该基因的功能, 以期为深入探讨桑树的乙烯信号转导提供了参考依据。
从NCBI数据库搜索已登录的 EIN2基因序列, 与桑树基因组数据库中的序列比对分析, 获得候选基因, 经过BlastN和Smart (http://smart.embl-heidelberg.de/)预测, 得到一个 EIN2同源基因, 在桑树基因组数据库中的编号为Morus024376。利用Genetyx-Ver. 7、MEGA 4.1、ProtParam等不同的生物软件对获得的序列进行生物信息学分析。
选用桑树品种桂优62, 种子经ddH2O浸泡24 h后, 均匀地铺在消毒湿润滤纸上, 在24℃下培养5 d。用不同浓度的乙烯利、ABA和NaCl溶液处理预培养的种子, 每处理50粒, 设3次重复, 对照用ddH2O处理。乙烯利组处理5 d, ABA组处理3 d, NaCl组处理4 d。其后分别测量种苗的根、茎长度, 并求平均值。随即用解剖刀将种苗的根、茎剖开, 分别收集于离心管中, 经液氮速冻后存于-80℃冰箱备用。
按照TaKaRa公司RNA抽提试剂盒说明书提取总RNA。分别取适量体积RNA用1%的琼脂糖凝胶电泳检测, 并用紫外分光光度计检测总RNA的浓度。总RNA经DNA酶消化后, 参照反转录酶M-MLV (TaKaRa)说明书, 以随机引物为引物, 合成cDNA第1链, 存于-20℃备用。
使用南京金斯瑞公司网站在线软件设计 MaEIN2基因的qRT-PCR引物 MaEIN2-qF: 5'-TGAT TCCATGGGCAACTAA-3'和 MaEIN2-qR: 5'-AATTC CTTTGCGGTGGTATC-3'。使用定量PCR试剂SYBR Premix Ex Taq II (TaKaRa), 反应体系为Premix Ex Taq II (2×) 10 μL, 10 μmol L-1上下游引物各0.8 μL, 50×ROX Reference Dye (50×) 0.4 μL, cDNA 2 μL和无菌双蒸水6 μL。qRT-PCR程序为95℃预变性30 s; 94℃变性5 s, 60℃退火30 s, 72℃延伸10 min, 扩增40个循环, 并以 MaACT2基因(引物为 MaACT2-qF: 5'-GCATGAAGATCAAGGTGGTG-3'和 MaACT2-qR: 5'-CATCTGCTGGAAGGTGCTAA-3')为内参。利用2-ΔΔCT法计算基因的相对表达量。
选取桑树新品种长江1号(重庆市审定)健壮植株的根、表皮、韧皮部、托叶、叶柄、叶片和不同发育时期的果实(果实分别取于盛花期后10、20、29、36和40 d)等组织材料, 9:00至10:00采样, 立即放入装有液氮的冰盒, 经速冻后存于-80℃冰箱中备用。分别提取其总RNA, 经DNA酶消化后, 以反转录得到的cDNA第1链为模板, 进行定量PCR分析。
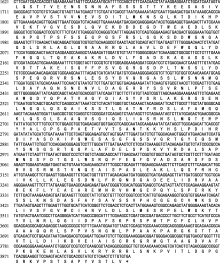
通过与桑树基因组数据比对, 获得了一个 EIN2同源基因, 该基因的DNA全长5614 bp, mRNA编码序列为3921 bp, 含7个外显子和6个内含子(图1), 该基因编码1036个氨基酸(图2)。ProtParam在线预测 MaEIN2基因编码蛋白质的相对分子量为142.61 kD, 理论等电点为5.72, 其化学式推测为C6366H9976N1702O1912S52。EIN2的N末端位于内质网膜上, 当接收上游元件传递的乙烯信号后, 其CNED区被切割下来, 在NLS的作用下进入细胞核, 并将信号传递给下游元件[ 10, 11, 12]。经过Smart在线软件分析, 编码序列中第13~第457位氨基酸含有13个跨膜结构, 其中第38~第391个氨基酸区域为类Nramp蛋白结构域(图1), 表明MaEIN2蛋白可能分布在内质网膜上参与乙烯信号的传递。将 MaEIN2氨基酸序列与拟南芥( Arabidopsis thaliana)和蒺藜状苜蓿( Medicago tru n catula)的EIN2氨基酸序列进行比对, MaEIN2的蛋白序列相对较为保守。经过序列比对分析, 预测S645和F646之间为信号切割点, S645以后的序列为CNED区; L1271~L1278的序列被预测为核定位信号(NLS), MaEIN2蛋白的第1275位的氨基酸为亮氨酸(L), 不同于拟南芥和苜蓿中的赖氨酸(K)(图1)。
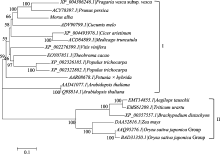
从NCBI数据库搜索拟南芥( Arabidopsis th - ali - ana)、草莓( Fragaria ananassa)、葡萄( Vitis vini f era)、蒺藜状苜蓿( Medicago truncatula)等15个物种的18个 EIN2基因, 氨基酸序列同源性分析表明, MaEIN2与蔷薇目(Rosales)植物草莓(XP_004306246.1)、桃树( Prunus persica, ACY78397.1)的EIN2蛋白同源性分别为64%和71%, 与豆科(Leguminosae)植物蒺藜状苜蓿(ACD84889.1)、鹰嘴豆( Cicer arietinum, XP_ 004493976.1)的同源性分别为59%和61%, 与十字花目(Brassicales)植物拟南芥(AAD41077.1、NP_ 195948.1)、金虎尾目(Malpighiales)植物杨树( Populus trichocarpa, XP_002322882.1、XP_002326185.1)的同源性为56%、56%、65%和65%, 与茄目(Solanales)植物矮牵牛( Petunia hybrida, AAR08678.1)、葡萄目(Vitales)植物葡萄( Vitis vinifera, XP_002276399.1)、葫芦目(Cucurbitales)植物甜瓜( Cucumis melo, ADV 90799.1)、锦葵目(Malvales)植物可可树( Theobroma cacao, EOY07851.1)的同源性为56%、68%、63%和66%, 与禾本目(Poales)植物节节麦( Aegilops tauschii, EMT14855.1)、乌拉尔图小麦( Triticum urartu, EMS6 1209.1)、二穗短柄草( Brachypodium distachyon, XP_003575571.1)、玉米( Zea mays, DAA52816.1)、水稻( Oryza sativa, AAQ95276.1、BAD31350.1)的同源性为38%、39%、41%、44%、44%和42%。结果显示, MaEIN2基因编码氨基酸序列与双子叶植物的同源性普遍较高, 均在50%以上, 而与禾本科植物的同源性较低, 均在40%以下。
分析 MaEIN 2与拟南芥、草莓、水稻等植物的 MaEIN2基因编码氨基酸序列发现, MaEIN2与草莓、桃树、杨树等物种进化距离较近, 而与水稻、玉米等物种进化距离较远。以MaEIN2与其他物种的 EIN2基因编码氨基酸序列比对为基础, 构建NJ进化树, 以分析它们的进化关系。参照进化树的构型, 可将整个进化树划为2个亚群(图3)。其中I类包含草莓、牡丹、葡萄、桑树、拟南芥等植物; II类包括玉米、水稻等植物。表明双子叶植物和单子叶植物的乙烯信号转导在进化上可能存在一定差异。
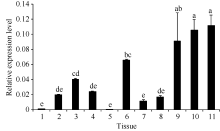
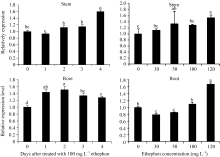
使用定量PCR技术检测 MaEIN2基因表达量显示, 其在根和幼叶中的表达量微弱, 在其他组织中都有一定的表达(图4)。 MaEIN2基因在成熟叶片中的表达量显著高于在幼叶中, 同时 MaEIN2基因随果实的发育呈上升趋势, 果实发育后期的表达量明显高于发育初期, 表明乙烯信号转导对于植物器官的成熟衰老具有重要的作用。
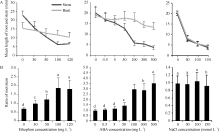
使用乙烯处理植物幼苗可诱发乙烯信号的传递, 使幼苗表现出“三重反应”的特征, 乙烯信号元件也能够响应ABA和NaCl的处理。以乙烯利、ABA和NaCl处理后, 幼苗的生长势受到抑制(图5)。根和茎的长度随试剂浓度的增加呈逐渐下降的趋势(图6)。在乙烯利和ABA处理组中, 根对茎的比值随着处理浓度的增加逐渐升高, 表明根和茎对乙烯利和ABA的响应有一定的差异。NaCl处理组中, 根茎比接近1, 不同浓度处理种苗并没有引起根茎比显著变化, 表明种苗对盐胁迫的响应与对乙烯利和ABA的响应有所不同。
将经乙烯利处理后的幼苗根和茎分离, 分别提取RNA并合成cDNA用于检测 MaEIN2基因的相对表达量。用100 mg L-1乙烯利处理幼苗后, 结果显示乙烯利提高了 MaEIN2基因的表达量, 随着处理时间的延长, MaEIN2基因在茎中的表达呈上升趋势, 而在根中的表达呈先增后降的趋势。随着乙烯利处理浓度的上升, MaEIN2基因在根和茎中的表达量都呈逐渐上升的趋势(图7)。
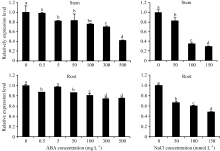
经ABA和NaCl处理种苗后, MaEIN2基因在不同组织中的表达模式与乙烯利处理结果存在明显差异。ABA和NaCl处理组种苗中 MaEIN2的表达都受到抑制, 并随处理浓度的升高而逐渐降低(图8)。
ETR、CTR1和EIN2都位于内质网膜上, 内质网是响应和传递乙烯信号最关键的细胞器, 而EIN2是内质网和细胞核之间乙烯信号交流的“节拍器”[ 5]。 EIN2基因的表达对于植物营养生长、成熟衰老和胁迫响应也有重要意义[ 7, 13]。我们利用最新发布的桑树基因组序列, 获得了一个 EIN2候选基因, 并对 EIN2进行了生物信息学分析。该基因的DNA全长5614 bp, mRNA编码序列为3921 bp, 编码1036个氨基酸残基, 与草莓、桃树等双子叶植物的同源性较高, 与单子叶植物的EIN2蛋白同源性较低。通过对其蛋白质的结构和活性位点的预测, 我们认为该候选基因为 EIN2基因, 命名为 MaEIN2。
乙烯被认为是植物器官的成熟和衰老的关键因子之一[ 14]。对 MaEIN2的组织表达分析结果显示, MaEIN2在老叶中的表达量显著高于在幼叶中; 在成熟果实中的表达显著高于在幼果中, 且随果实发育呈逐渐上升的趋势。表明乙烯信号转导可能随着组织的生长发育及成熟而活跃, 并调控营养器官的成熟衰老。鉴于EIN2作为乙烯信号转导过程中关键元件, 抑制番茄 LeEIN2基因的表达能够下调番茄成熟相关基因的表达并延缓果实的后熟软化[ 15], 这为基因工程改造植物并延缓其衰老提供了新思路。目前有关延缓营养器官(如果实)衰老的基因改造, 主要是通过抑制乙烯合成基因表达的方法实现的[ 16, 17], 但仅为部分抑制, 转基因植株也会合成一定量的乙烯, 且环境中的外源乙烯也会对植株产生影响。而乙烯信号转导途径被认为是乙烯调控植物体生长发育的主要途径, 该途径中一些基因的突变有可能彻底阻断植株对乙烯的反应。因此, 对 EIN2的功能研究, 可为今后从基因水平上改造农作物提供参考。
乙烯对于种子萌芽和幼苗发育有很重要的调控作用, 施用外源乙烯刺激植物会表现出“三重反应”的特征, 即抑制茎的伸长生长、促进茎或根的增粗和使茎横向生长[ 18, 19]。本试验中, 添加乙烯利处理预培养5 d的种子, 幼苗的生长势受到了显著的抑制, 根和茎的长度随着所加试剂浓度的增加, 都呈现逐渐下降的趋势, 且根/茎比随着处理浓度的增加而逐渐升高。该结果与模式植物拟南芥的研究结果相似。进一步检测乙烯利处理幼苗对 MaEIN2基因表达量的影响, 结果显示乙烯利提高了 MaEIN2基因的表达量, 随着处理时间的延长, MaEIN2基因在茎中的表达呈上升趋势, 而在根中的表达却呈先增后降的趋势。随着乙烯利浓度的上升, MaEIN2基因在根和茎中的表达量都呈逐渐上升的趋势。以上结果暗示 MaEIN2基因能够响应乙烯利的调控。
当植物受到干旱和盐胁迫的作用时, 其发育会受到抑制, 并导致细胞的活性氧(ROS)浓度上升, 同时ABA也会参与植物体对胁迫的响应[ 20, 21]。 E IN2基因的表达量在盐胁迫作用下会被下调, ein2拟南芥突变体在盐胁迫作用下生长受到的抑制要比野生型更显著, 表明 EIN2参与了植物的胁迫响应途径, 其表达量的降低可能是植物适应胁迫的表现[ 21, 22]。此外, 拟南芥幼苗经ABA处理后, EIN2基因的表达量被下调, 同时 EIN2基因的突变会改变ABA响应基因 RD29B(植物响应胁迫的标志基因)的表达, 因此EIN2蛋白可能依赖于ABA响应途径调控植物对胁迫的响应[ 21]。本试验中, 使用不同浓度的NaCl和ABA处理桑树幼苗后, 幼苗的生长受到明显的抑制, MaEIN2基因的表达量随着NaCl和ABA浓度的升高都呈现逐渐降低的趋势, 也印证了此前的报道[ 20, 21, 22]。Lei等[ 22]研究证实 EIN2可能与一个含MA3结构域的蛋白ECIP1互作调控对盐胁迫反应, 但 EIN2是如何调控植物对盐胁迫的响应还有待进一步研究。
从桑树中获得 MaEIN2基因, 基因组序列全长5614 bp, 由7个外显子和6个内含子组成, 包含3921 bp CDS, 编码1036个氨基酸, 与双子叶植物 EIN2基因的同源性高于单子叶植物。 MaEIN2在老叶和成熟果实中的表达量分别高于在幼叶和幼果中, 可能与器官的成熟衰老有关。乙烯利能够促进 MaEIN2的表达, 而ABA和NaCl抑制 MaEIN2的表达。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|