第一作者联系方式: E-mail:787600117@qq.com
甘油-3-磷酸酰基转移酶(sn-glycerol-3-phosphate acyltransferase, GPAT)是三酰甘油生物合成的关键酶, 催化三酰甘油合成的起始步骤, 在植物中参与调节生长发育、脂质的合成和逆境应答等过程。本试验通过RT-PCR从甘蓝型油菜品种湘油15中克隆得到
A key enzyme
GPAT是三酰甘油(triacylglycerol, TAG)生物合成的限速酶[ 1], 催化TAG生物合成的起始步骤。目前拟南芥中已经发现10个 GPAT基因家族成员[ 2], 分别命名为 ATS1、AtGPAT1、AtGPAT2、AtGPAT3、AtGPAT4、AtGPAT5、AtGPAT6、AtGPAT7、AtGPAT8和 AtGPAT9。根据亚细胞定位可分为3类, 分别为质体 GPAT (ATS1)[ 3]、线粒体 GPAT (AtGPAT1/2/3)[ 4]和内质网 GPAT (AtGPAT4/5/6/ 7/8/9)[ 2, 5]。GPAT主要将酰基从acyl-ACP或acyl-CoA (定位于质体的GPAT酶以acyl-ACP为酰基供体, 定位于内质网和线粒体的GPAT以acyl-CoA为酰基供体)[ 6]转移到G-3-P的 sn-1位置上形成溶血磷脂酸(lysophosphatidic acid, LPA)[ 6, 7, 8]。陆生植物特异性GPAT(EC2.3.1.198)具有 sn-2酰基转移酶活性, 他们能将酰基转移到甘油-3-磷酸的 sn-2位上, 形成 sn-2单酰甘油( sn-2-monoacylglycerol, sn-2 MAG)[ 4, 9]。溶血磷脂酸和acyl-CoA在溶血磷脂酸酰基转移酶的作用下形成磷脂酸(phosphatidic acid, PA)[ 10]。在磷脂酸磷酸酶的作用下, PA脱去磷酸基团形成二酰甘油(diacylglycerol, DAG), 经二酰甘油酰基转移酶(diacylglycerol acyltransferase, DGAT)的催化作用产生TAG[ 11]。
TAG是植物种子储存脂的主要成分, 提高种子TAG含量很大程度上就意味着种子含油量的提高。Jain等[ 12]将红花质体 GPAT基因( CtpGPAT)转入拟南芥中超表达, 使其种子含油量提高了15%。此外, Gidda等[ 5]对拟南芥 AtGPAT9编码的氨基酸序列进行生物信息学分析, 推测其与拟南芥种子含油量有关。
软木脂和几丁质是植物体中2种重要的聚酯, 它们构成植物阻止病原体入侵的防护栏, 并控制水分和溶质的运输。Li等[ 13]发现, 拟南芥 gpat5突变体的幼根中软木脂的含量下降50%, 种皮中软木脂含量成倍减少, 导致渗透性增强, 种子萌发和幼苗成活率显著降低。几丁质合成相关的 GPAT基因在拟南芥( AtGPAT4, AtGPAT6, AtGAPT8)[ 4, 5, 9, 14, 15]、甘蓝型油菜( BnGPAT4)[ 16]和蓝蓟( Echium vulgare)(EpGPAT1, EpGPAT2)[ 17]等植物中被克隆。拟南芥 atgpat4/8双突变体的茎和叶中表现出明显的几丁质缺陷[ 13], atgpat6突变体的花瓣表现出几丁质缺陷, 并且花的各组成结构相互融合, 花无法开放[ 18]。甘蓝型油菜 BnGPAT4干扰系叶片角质层有明显几丁质缺陷, 气孔不能正常关闭, 使植株长期处于高蒸腾作用状态, 容易失水[ 16]。
研究表明低温敏感型植物的质体GPAT酶具有棕榈酰-ACP(C16:1-ACP)底物偏好性, 而耐低温植物质体GPAT酶的底物以油酰-ACP为主[ 19, 20, 21, 22]。磷脂是生物膜的主要成分, 根据主链结构分为磷酸甘油脂(phospho- glycerides, PG)和鞘磷脂(sphingomyelin, SM)。PG饱和度的改变影响类囊体膜脂和膜蛋白接界面的动力学活性[ 23], 而质体GPAT酶的底物选择性能改变类囊体膜PG的饱和度。抗低温能力强的植物如拟南芥[ 3]、菠菜( Spinacia oleracea)[ 19, 24]、豌豆( Pisum sativum)[ 24, 25]等质体GPAT酶对顺9-十八碳烯酸(油酸)的亲和力比较强[ 26]。抗低温能力弱的植物如南瓜( Cucurbita moschata)质体GPAT酶偏好于饱和脂肪酸[ 19]。Yan等[ 27]将甜椒的 GPAT基因转入烟草中超表达, 转基因烟草在高温下, 其类囊体膜上单半乳糖基二脂酰甘油(monogalactosyl-diacylglycerol, MGDG)、硫代异鼠李糖甘油二酯(sulfoquinovosyl-diacylglycerol, SQDG)、二半乳糖基甘油二酯(digalactosyl-diacylglycerol, DGDG)和PG的饱和程度普遍增加, 对高温压力的抗性增强。
油菜在我国具有悠久的栽培历史。目前我国面临对食用油需求的日益增加和全球气候变化而带来的干旱、盐碱地面积扩大等问题, 如何提高油菜的抗逆性对提高我国油菜单产具有重要意义。研究表明甘油-3-磷酸酰基转移酶家族与作物的育性[ 14, 28]、种子含油量[ 12]和抗逆性[ 13, 16, 21, 23, 27]相关。其中拟南芥 AtGPAT6与结实率有关。在花药发育阶段, 拟南芥 AtGPAT6在绒毡层和小孢子中大量表达, atgpat6突变体绒毡层的内质网数量减少, 花粉壁发育缺陷, 花粉萌发和花粉管的伸长受阻, 导致结实率降低[ 14]。本文通过RT-PCR法从甘蓝型油菜湘油15中克隆油菜的 GPAT6基因 BnGPAT6-1和 BnGPAT6-2, 并利用逆境胁迫和半定量RT-PCR研究 BnGPAT6基因的表达, 为揭示油菜 BnGPAT6基因的功能和利用抗逆境候选基因进行油菜的分子育种提供基础。
湘油15由国家油料改良中心湖南分中心提供, TransGen生物技术有限公司TRIzol RNA提取试剂盒与EasyScript First-Strand cDNA Synthesis SuperMix试剂盒、Trans Taq DNA Polymerase High Fidelity DNA聚合酶套装以及10 mmol L-1 dNTPs, Solarbio科技有限公司的DNaseI、PEG4000、ABA、6-BA和NaCl, TaKaRa生物有限公司的pMD18-T载体。
用TransGen TRIzol RNA提取试剂盒参照其说明书提取油菜组织的总RNA。
RNA经DNaseI处理后, 用EasyScript First-Strand cDNA Synthesis SuperMix试剂盒参照其说明书合成第一链cDNA。
挑取饱满的种子播种于1/2MS培养基中, 在22℃的组织培养室中萌发。当油菜长出2片真叶时, 提取叶片总RNA, 经DNase酶消化后, 反转录合成第一链cDNA。
用拟南芥 AtGPAT6基因在甘蓝型油菜EST数据库中找到6条EST序列(ES913056.1、ES913056.1、CX190605.1、CX190597.1、CD833550.1和CX191564.1), 其中ES913056.1、ES913056.1、与拟南芥 AtGPAT6基因的5°-端序列相似性很高, CX190605.1、CX190597.1、CD833550.1、CX191564.1与其3°-端序列匹配值很高。因此, 根据这6条EST序列设计出2条上游引物F1: 5°-TCTTCTTGTCTGATGGGGGCTC-3°、F2: 5°-CTCGAGGATGGGGTCTCAGGAG-3°和4条下游引物R1: 5°-TCATAGAAGACAAAAGAAACAAAC-3°、R2: 5°-GCCAAAAGAGAAATATTCAAAAGG-3°、R3: 5°-TTGA AAATATCACGAAAAAACTTGC-3°和R4: 5°-AGCCAAAA GAAAAATATTCAAATG-3°。以第一链cDNA为模板, 2条上游引物分别与4条下游引物配对进行PCR扩增。PCR体系10 μL含 5 U μL-1 DNA聚合酶0.2 μL、10 mmol L-1 dNTPs 0.2 μL、10×PCR缓冲液1 μL、50 ng μL-1模板1 μL、2 μmol L-1正反引物各1 μL、ddH2O 5.6 μL。PCR程序为 95℃预变性5 min, 94℃变性30 s, 54℃复性30 s, 共35个循环; 72℃延伸90 s, 72 ℃保温8 min, 16℃恒温。PCR产物经1.0%琼脂糖凝胶电泳, 用凝胶成像系统(Bio-Rad)检测和记录结果。将PCR产物回收后与pMD18-T载体连接, 转化大肠杆菌感受态细胞, 筛选阳性克隆送华大基因测序。用MEGA5.0对白菜、甘蓝和甘蓝型油菜 GPAT6基因的全长CDS序列进行序列比对和聚类分析。
用ANHERO对 BnGPAT6-1和 BnGPAT6-2基因编码氨基酸序列的物理性质和蛋白质跨膜区结构进行分析; 用SoftBerry的ProtComp 9.0、pSORT和Predotar进行亚细胞定位分析; 应用SignalP (http://www.cbs.dtu.dk/services/ SignalP/)进行信号肽分析; 通过美国国立生物技术信息中心网站(NCBI)对 BnGPAT6-1和 BnGPAT6-2基因编码的蛋白质进行保守性功能域预测; 应用BlastP (http://blast.ncbi.nlm. nih.gov/)和Phytozome (http://www.phytozome.net/)进行蛋白质序列比对; 用MEGA5.0作蛋白质序列相似性比较和进化树分析。
分别提取种植于田间的湘油15开花期植株的根、茎、叶、花以及开花后1周、2周、3周的胚和果荚的总RNA, 进行半定量RT-PCR分析。以甘蓝型油菜 ACTIN2.1 (FJ529167.1)基因为内参, 上游引物为ACTINFW: 5°-CG AGCAGGAGATGGAGACT-3°, 下游引物为ACTINRV: 5°-GCTGAGGGAAGCAAGAATG-3°; 根据 BnGPAT6-1和 BnGPAT6-2基因以及白菜( Bra005137、Bra017137)和甘蓝(Bol017760、Bol025280) GPAT6基因CDS的相同序列设计RT-PCR引物, 上游引物为G6-GYFW: 5°-TGCCACGTA CAAAATGCGAA-3°下游引物为G6-GYRV: 5°-ACCCT ACCGTCAGTGCCAGC-3°进行半定量PCR, 检测甘蓝型油菜 GPAT6-1和 BnGPAT6-2基因组织表达总量的特征。PCR体系10 μL含5 U μL-1DNA聚合酶0.2 μL、10 mmol L-1 dNTPs 0.2 μL、10×PCR缓冲液1 μL、50 ng μL-1模板 1 μL、2 μmol L-1上下游引物各1 μL、ddH2O 5.6 μL。PCR程序为 95℃预变性5 min, 94℃变性30 s, 58℃复性30 s, 共28个循环(内参25个循环); 72℃延伸40 s, 72℃保温 8 min, 16℃恒温。PCR产物经2%琼脂糖凝胶电泳。
将油菜种于育苗盆中, 待长出4~5片真叶时用于处理。分别提取经处理0、3、6、12 和24 h后油菜叶的RNA进行半定量RT-PCR分析。PCR引物、体系和程序及电泳同1.6。参照文献[ 29, 30, 31, 32] 处理方法, 略有改变。水渍处理是将育苗钵浸泡至清水中, 水面淹没油菜根部; 干旱胁迫是用20% PEG-4000溶液喷洒油菜叶面浇灌根部; 盐胁迫是以300 mmol L-1NaCl溶液喷洒叶面和浇灌根部; 植物生长调节剂处理是分别以0.1 mg L-1 6-BA和3 mg L-1ABA溶液喷洒叶面和浇灌根部。每株叶面喷洒量为2 mL, 根部浇灌量即将育苗钵中土壤浇透, 约每钵50 mL。
用1%琼脂糖凝胶电泳检测RT-PCR扩增产物显示, 引物对BnGPAT6FW1/BnGPAT6RV1与BnGPAT6FW2/ BnGPATRV3扩增出目的条带(图1)。将PCR产物回收后与T-vector连接, 转化大肠杆菌感受态细胞, 筛选阳性克隆进行测序。序列分析结果表明, 克隆到2个含1506 bp的 BnGPAT6基因全长CDS序列 BnGPAT6-1和 BnGPAT6-2, 其核苷酸序列与拟南芥 AtGPAT6 (NM_129367.3)基因的相似度分别为84.7%和85.3%, BnGPAT6-1与 BnGPAT6-2之间的相似度达到89.1%。
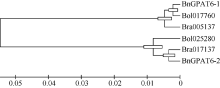
用MEGA5.0对白菜( Bra005137、Bra017137)、甘蓝( Bol017760、Bol025280)和甘蓝型油菜的 GPAT6基因全长CDS序列进行聚类分析(图2), 发现这6个序列分为2组。 BnGPAT6-1、Bra005137和 Bol017760归为一组(X组), BnGPAT6-2、Bra017137和 Bol025280归为一组(Y组)。序列比对结果表明, 2组序列之间存在不同的单体型, 共包含124个SNP, X组的单体型为: 5°-CGTTCTCTCCTTAA CTCAGTTATTGGCATACCTGATATGCATTAGTCGCCTCTGAAGATGATCTATTACCTATCGGTAAATTCACTCATG CTGGTCCAGCCCTTCCCATTACTGGAGATCTAAA-3°, Y组的单体型为: 5°-GCACTGTCTGCCGCTCTGACCGCA ATTCAGTGCATGGGTTGAAGACGTTACTCAGTACATGATCGCCGTGCCCAAACCCCCCTCGCAGGATCTTCTAC CTTTCGTTGGCCGGGATGACCTCGGG-3°。
BnGPAT6基因编码501个氨基酸, 其中BnGPAT6-1相对分子质量为56.04 kD, 等电点为9.865, BnGPAT6-4蛋白的相对分子质量为55.86, 等电点为9.855。用ANTHEPROT预测发现, BnGPAT6-1和BnGPAT6-2蛋白均有3个跨膜结构, 推测BnGPAT6-1与BnGPAT6-2为跨膜类蛋白。亚细胞定位预测结果显示, BnGPAT6-1和BnGPAT6-2最有可能定位于原生质体膜。SignalP预测结果显示, BnGPAT6-1和BnGPAT6-2都没有信号肽。保守结构域预测发现, BnGPAT6-1与 BnGPAT6-2基因均编码一个双功能酶, 其N端含有一个类卤酸脱卤酶(haloacid dehalogenase-like hydrolase, HAD-like)活性结构域, C端含有一个溶血磷脂酰基转移酶结构域(lysophospholipid acyltransferase, LPLAT)(图3)。
在NCBI中对 BnGPAT6基因编码的蛋白全序列进行BlastP分析, 发现除了2条分别来自拟南芥和琴叶拟南芥的序列外, 还有多个物种的GPAT6蛋白与BnGPAT6-1和BnGPAT6-2有较高的相似性。BnGPAT6-1和BnGPAT6-2与拟南芥和琴叶拟南芥GPAT6序列的相似度均达到92%, 与可可树( Theobroma cacao)、葡萄( Vitis vinifera)、大豆( Glycine max)的相似度达到80%, 与黄瓜( Cucumis sativus)、番茄( Solanum lycopersicum)、鹰嘴豆( Cicer arietinum)、草莓( Fragaria vesca)的相似度达到75%, 说明GPAT6蛋白在进化中具有保守性。为了进一步研究 GPAT6基因在不同物种中的进化关系, 用MEGA5.0及非加权平均法, 对不同物种的 GPAT6基因编码的蛋白序列及拟南芥 GPAT基因家族成员编码的蛋白序列构建系统进化树(图4)。结果表明, BnGPAT6-1和BnGPAT6-2与白菜和甘蓝的GPAT6关系最近, 其次与拟南芥AtGPAT6的关系最近, 并且与各物种的GPAT6蛋白序列的关系比拟南芥GPAT家族其他成员的关系紧密。
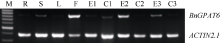
以湘油15开花期的根、茎、叶、花以及开花后1周、2周、3周的胚和角果的RNA反转录的cDNA为模板, 以 ACTIN2.1为内参基因, 通过半定量RT-PCR进行 BnGPAT6基因的组织特异性表达分析。电泳检测结果(图5)表明, BnGPAT6在根、茎、叶和果荚中表达较弱, 在花中大量表达, 在未成熟胚中其表达量呈先上升后下降的趋势。
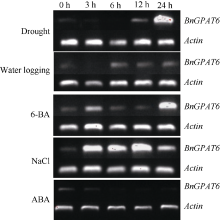
以未处理的同龄幼苗作对照, 进行半定量RT-PCR。电泳检测结果(图6)表明, BnGPAT6基因的转录水平在干旱胁迫12 h表达转录水平开始上升, 24 h后成倍增加; 6-BA处理的表达状况与干旱处理基本一致。盐胁迫下转录水平在短时间内急剧上升, 12~24 h内呈下降趋势。水渍胁迫下 BnGPAT6基因的表达量基本不受影响。在经ABA处理的油菜幼苗中, BnGPAT6基因表达量有所下降。逆境处理对照组的表达水平都比较弱, 与组织特异性表达结果(图5)相符。
甘油-3-磷酸酰基转移酶作为TAG生物合成的关键酶, 不仅是Kennedy途径中的重要酶之一, 而且参与植物膜脂、几丁质和软木脂的生物合成, 因此, 对植物种子含油量和逆境抗性有着不可忽视的影响。虽然在多种植物中发现了GPAT酶, 但在油菜中, 只对 BnGPAT4基因进行了比较深入的研究[ 16], 目前对油菜 BnGPAT6基因的相关研究尚为空白。
通过序列比对和聚类分析(图2)发现, BnGPAT6-1和 BnGPAT6-2基因与白菜和甘蓝 GPAT6核苷酸序列的相似度超过88%。 BnGPAT6-1与白菜4号染色体和甘蓝4号染色体上的 GPAT6序列相似度超过99%, BnGPAT6-2与白菜5号染色体及甘蓝2号染色体上的 GPAT6基因的核苷酸序列一致性超过98%, BnGPAT6-1与 BnGPAT6-2CDS序列的相似度为89.6%, 2组序列中存在2个非常保守的单体型。结合序列比对和聚类分析结果, 推测白菜和甘蓝中的2个 GPAT6同源基因均非常保守, 它们将 GPAT6基因遗传给甘蓝型油菜, 并在油菜的进化过程中非常保守。
Yang等[ 4, 9]发现拟南芥 AtGPAT4、AtGPAT6和 AtGPAT8基因编码的酶具有HAD-like结构域并证明其具有磷酸酶活性。通过对 BnGPAT6基因编码的蛋白进行预测发现, BnGPAT6-1和 BnGPAT6-2基因均编码一个双功能酶, N端含有一个HAD-like活性结构域, C端含有一个LPLAT功能域, 这与拟南芥AtGPAT4、AtGPAT6和AtGPAT8蛋白的结构相符。从蛋白序列系统进化树分析(图4)可以看出, BnGPAT6-1和BnGPAT6-2与白菜、甘蓝和拟南芥的GPAT6 非常紧密, 与其他物种GPAT6蛋白的进化距离比与拟南芥GPAT家族其他成员的近, 这表明GPAT6蛋白在进化中具有较高的保守性, 同时也证明我们克隆得到的基因为 GPAT6基因, 而非 GPAT基因家族中的其他成员。
有研究表明拟南芥 AtGPAT6在花中大量表达[ 14, 28], 在花瓣和萼片几丁质的生物合成中起决定性作用[ 18], 并与 AtGPAT1共同影响拟南芥的结实率[ 14]。半定量RT-PCR分析表明(图5), 甘蓝型油菜 BnGPAT6基因在花中的表达远远高于其他组织, 与拟南芥 AtGPAT6基因表达一致; 在未成熟的种子中表达量呈倒“V”形。据此推测油菜 GPAT6基因负责花中的几丁质合成, 并影响油菜的结实率, 对油菜种子含油量的影响比较小。
在不同的非生物逆境处理中, 油菜叶片中 BnGPAT6基因表达模式不同(图6)。在干旱胁迫下, 12 h内 BnGPAT6基因的表达量基本没有发生变化, 24 h后大量增加。这表明油菜在缺水条件下, 通过提高 BnGPAT6的表达量来应对干旱。经6-BA处理24 h后, 油菜 BnGPAT6基因的表达量大量增加, 以应对细胞分裂加速。盐胁迫下, 油菜 BnGPAT6基因表达量在短时间内迅速提高, 12~24 h之间开始降低, 表明随着胁迫时间的延长, 油菜逐渐适应高盐环境。经水渍处理的油菜 BnGPAT6基因的表达量基本没有变化, 这表明湘油15对水渍有一定的抗性, 或者 BnGPAT6与植物抗涝害无关。在ABA胁迫下, BnGPAT6基因的表达量降低, 表明ABA对 BnGPAT6基因的表达有一定程度的抑制作用。有研究表明[ 4, 5, 9, 14, 15], 拟南芥 AtGPAT4、AtGPAT6和 AtGPAT8基因均参与几丁质的合成。 AtGPAT4和 AtGPAT8在茎和叶中大量表达, 负责茎和叶中的几丁质合成[ 12]; AtGPAT6在花中大量表达, 在茎和叶中表达量很低[ 14, 28]。油菜经6-BA处理后表达量大增, 经ABA处理后表达量下降。因此, 推测油菜 GPAT6基因可能参与茎和叶中的几丁质合成。在正常情况下 BnGPAT6基因进行本底水平表达, 当油菜细胞分裂突然加速表达急剧上升以弥补 GPAT4和 GPAT8的不足, 当生长受到抑制时, 表达水平下降。
从油菜 GPAT6基因在上述逆境胁迫中的表达变化, 可以间接推测油菜叶中几丁质生物合成的变化, 对研究油菜抗逆性有着重要的意义。可以根据油菜对胁迫的反应, 进一步探索抗逆的生理代谢指标, 以此来选择合适的抗性品种以及适合的栽培条件, 为油菜的育种和生产服务。此外, 油菜是异源四倍体, 其基因组中究竟有多少个 GPAT6拷贝, 各拷贝的表达是否有差异, 油菜 GPAT6基因是否参与营养组织中几丁质的合成还有待进一步的研究。 BnGPAT6基因的克隆与表达分析不仅丰富了 GPAT基因家族的信息, 同时为进一步研究油菜GPAT6酶的功能与耐逆境胁迫及产量之间的关系奠定了基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|