采用盆栽试验, 以抗旱性较好的品种跃进豆、260205和敏感品种奶花芸豆为试材, 设置干旱和正常供水2种处理, 测定产量、产量构成因素及相关生理生化指标, 分析干旱胁迫下参试品种各性状及生理指标的变化及对干旱胁迫的生理响应。结果表明, 干旱处理36 d, 跃进豆和260205的根干重为总生物量的20.2%和20.6%, 荚干重为总生物量的30.0%和28.9%, 而奶花芸豆的根干重和荚干重仅为总生物量的10.6%和17.1%, 光合产物向根系和籽粒的有效分配与普通菜豆抗旱性关系密切; 跃进豆在干旱胁迫后期的水分利用效率较对照增加230.5%, 而奶花芸豆的增幅仅为84.3%, 较高的水分利用效率有利于CO2的有效扩散和高效固定; 其他生理特性分析表明, 抗氧化酶与光呼吸共同作用有效降低了膜脂过氧化程度, 减少了叶片的损伤; 脯氨酸和可溶性糖是普通菜豆主要的渗透调节物质, 能够较好地保持自身叶片的水分平衡。普通菜豆抗旱性是多种生理调节机制协同作用的结果, 主要包括形态调节、气孔调节、渗透调节以及抗氧化能力的调节等。
Three common bean cultivars, Yuejindou (drought-resistant), 260205 (drought-resistant), and Naihuayundou (drought- susceptible) were evaluated with two treatments (drought stress and normal water supply) in pot experiments. We determined physiological and biochemical parameters during growth stage and yield and traits related to yield after harvest, analyzed the changes of all parameters and indicators under drought stress. The result showed that the root dry weight of Yuejindou and 260205 was 20.2% and 20.6% of the total biomass and the pod dry weight was 30.0% and 28.9% of the total biomass especially at 36 days of drought treatment, while, the root dry weight and pod dry weight only 10.6% and 17.1% of the total biomass in Naihuayundou, indicating that effective photosynthate distribution is significantly correlated with drought resistance in common bean. The water use efficiency in the drought-resistant cultivar (Yuejindou) increased by 230.5% compared with control, much higher than the 60% increase in drought-susceptible cultivar (Naihuayundou). The drought-resistant cultivars had an efficient CO2 diffusion and fixation in leaf tissues, and an effective water-use. In drought-resistant cultivars, antioxidant enzyme and photorespiration played a significant role in reactive oxygen scavenging; proline and soluble sugar contributed to the maintenance of relative water content in leaves under low water potential. All together, our results indicated that the competence of drought-resistant cultivars to maintain seed production under drought stress relies on effective adjustments in morphology, stomatal conductance, osmosis and antioxidant capacity.
普通菜豆( Phaseolus vulgarisL.)是人类主要的食用豆类之一, 其籽粒含有丰富的蛋白质、膳食纤维、碳水化合物以及多种人体必需的维生素和矿物质(铜、钙、铁、镁、锰和锌), 是许多国家和地区的主要营养来源[ 1]。普通菜豆广泛种植于非洲东部、美洲、亚洲和欧洲西部等地, 2012年全球普通菜豆播种面积约2.89×107 hm2, 总产量超过2.31×107 t, 我国普通菜豆播种面积约9.71×105 hm2, 总产量约1.46×106 t[ 2], 主要分布于云南、贵州、陕西、山西、湖北、黑龙江和内蒙古等省区; 因此, 其生长环境复杂多样, 生产受多种生物和非生物因素限制, 其中干旱影响尤为严重。全球每年大约有60%的普通菜豆因水分亏缺而损失, 一些地区在遭遇突然干旱时, 损失高达80%[ 3, 4]。随着全球气候的变化, 普通菜豆产区的干旱情况仍将日益加剧[ 5]。因此, 普通菜豆抗旱性研究备受国内外学者的关注, 成为育种工作的重要目标之一[ 6, 7]。
在干旱条件下, 植物对逆境的应答是一个复杂的生理现象, 植物组织水势的下降导致不同生育期的诸多变化, 如ABA和渗透调节物质的积累、气孔调节、活性氧清除物质的形成以及蛋白质积累水平的变化等[ 8, 9]。很多研究表明, 干旱胁迫下普通菜豆的气孔导度、渗透调节物质含量、水分利用效率以及抗氧化酶活性等多项指标在不同抗旱性品种间存在较大差异[ 10, 11, 12, 13]。然而这些研究多侧重于同一时期下的某一种生理响应, 缺乏整体性, 因此, 研究不同干旱胁迫程度下各生理特性变化之间的相互关系十分重要, 也是揭示普通菜豆抗旱生理基础的必然选择。目前评价普通菜豆抗旱性的方法还是以调查干旱胁迫条件下的产量相关性状, 如粒重、单株荚数、单荚粒数等为主, 但这一传统方法的不足是较为苛刻的干旱胁迫条件控制以及耗时耗力, 一定程度上制约了普通菜豆的抗旱评价和抗旱育种的效率, 因此, 寻找与抗旱性相关的可替代性状尤为迫切。
本文系统分析不同干旱胁迫时期的形态特性、光合参数、渗透调节物含量、抗氧化酶活性等多项指标, 旨在深化对普通菜豆抗旱生理机制的认识, 为今后抗旱基因挖掘及抗旱品种改良提供生理依据。
在本课题组普通菜豆抗旱性鉴定的基础上, 选取抗旱性较强的跃进豆、260250和干旱敏感品种奶花芸豆为试材, 种子由中国农业科学院作物科学研究所种质资源库提供。
2012—2013年在中国农业科学院作物科学研究所昌平试验站温室中进行盆栽试验, 温室气温(25± 4)℃, 相对湿度70%±20%, 自然光昼夜循环。种子在光照培养箱中发芽, 待出芽整齐后播于花盆中, 每盆播5粒, 盆土由蛭石、珍珠岩和育苗土混合而成, 质量比为4∶3∶3。播种后1周出苗, 幼苗长至三叶期匀苗, 每盆留苗3株。
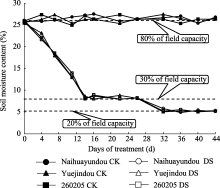
试验为随机区组设计, 以称重法保持土壤含水量, 播种30 d后, 对每份供试材料设置正常供水(对照)和干旱两种处理。正常供水土壤含水量为田间持水量的80%±5%; 干旱处理前期土壤含水量为田间持水量的30%±5%, 干旱处理后期土壤含水量降至田间持水量的20%±5%, 3次重复(图1)。
1.2.1 产量及其构成因素 成熟后从各品种处理随机选取6盆, 参照《普通菜豆种质资源描述规范和数据标准》[ 14], 分别对单株荚数、单荚粒数、单株粒数、单株产量等6个性状进行考种, 以6次重复平均数作为各处理考察性状值。
1.2.2 形态指标 植株干旱处理16 d、36 d取样, 从各处理随机选取3盆, 将完整植株冲洗后于105℃杀青30 min, 80℃烘48 h, 至恒重时测定干物质重[ 15]。
1.2.3 光合参数 测定时间为干旱处理16 d、24 d、36 d和44 d的当天9:00—11:00, 采用Li-6400光合测定仪(LI-COR, 美国)随机测3盆植株(3个重复), 测量部位为第3片完全展开叶的中间叶片, 叶片至少在1000 mmol m-2 s-1的光强下活化20 min。设定光合测定仪的光强为1000 mmol m-2 s-1, CO2浓度为 400 mmol L-1, 温度为25℃。测定净光合速率( Pn)、蒸腾速率( Tr)以及气孔导度( Gs), 水分利用效率(WUE)为净光合速率与蒸腾速率的比值( Pn/ Tr)[ 16]。
1.2.4 其他生理指标 采用称重法测定叶片相对含水量(RWC)[ 17], 酸性茚三酮比色法测定游离脯氨酸(Pro)含量, 考马斯亮蓝比色法测定可溶性蛋白含量, 蒽酮比色法测定可溶性糖含量, 愈创木酚比色法测定叶片POD活性, 抑止NBT光还原比色法测定SOD活性, 硫代巴比妥酸(TBA)法测定丙二醛含量[ 18], 李合生方法测定乙醇酸氧化酶活性[ 19]。
1.2.5 数据处理 采用Microsoft Excel 2013处理数据和绘图, SPSS 19.0软件进行方差分析和相关分析。
2.1.1 产量及其构成因素 由表1可知, 干旱胁迫对不同品种的产量及其构成因素均有显著影响。与对照相比, 干旱胁迫下跃进豆、260205和奶花芸豆的单株产量分别降低63.1%和63.7%和88.9%, 干 旱敏感品种的降幅明显高于抗旱品种; 3个品种单荚粒数分别下降59.5%、33.4%和31.8%, 奶花芸豆的单荚粒数下降幅度比跃进豆、260205分别高27.7%和26.1%。
表2表明, 3个品种的荚长与单株产量均无显著相关; 单株荚数与单株产量在跃进豆和260205中极显著相关, 而在敏感品种奶花芸豆中相关性不显著; 单株粒数、单株荚重、单荚粒数与单株产量的相关性在3个品种中均为显著或极显著, 说明这3种产量构成因素对单株产量的影响程度较大且稳定。
2.1.2 不同时期干物质积累及分配 由表3可知, 干旱胁迫对普通菜豆各组织器官的生长发育有着显著的影响, 总生物量较对照大幅降低。干旱胁迫16 d, 不同品种的根茎叶的生长均受到不同程度的抑制, 从茎叶干重变化看, 奶花芸豆比对照下降55.9%, 而跃进豆和260205分别下降62.7%和56.3%, 下降幅度略高于敏感品种; 从根干重变化看, 敏感品种奶花芸豆下降67.4%, 而跃进豆和260205分别仅下降37.7%和37.0%, 下降幅度显著低于奶花芸豆; 奶
| 表1 干旱胁迫下不同品种产量及其构成因素 Table 1 Yield and its components in different common bean cultivars under drought treatments |
| 表2 干旱胁迫下产量构成因素与单株产量的相关性 Table 2 Correlation coefficients between yield component and yield per plant under drought stress |
| 表3 干旱胁迫下不同抗旱性品种各器官干重 Table 3 Morphological characteristics of different common bean cultivars under drought treatments |
花芸豆的根冠比较对照下降26.0%, 相反, 跃进豆和260205的根冠比分别较对照增加64.9%和48.1%。干旱胁迫36 d, 各品种均生长至结荚期, 奶花芸豆的根茎叶干重的下降比例与干旱胁迫16 d相比无显著变化, 但荚干重减少量高达93.4%; 跃进豆和260205根茎叶干重均显著下降, 而荚干重减少量显著低于奶花芸豆, 分别为66.2%和47.3%。干旱处理16 d, 跃进豆和260205的根干重为总生物量的26.1%和35.8%, 而奶花芸豆仅为13.9% (图2-A); 干旱胁迫36 d, 跃进豆和260205的荚干重所占比值分别高达32.0%和28.9%, 而奶花芸豆的荚干重仅占生物量的17.1% (图2-B)。由此可见, 干旱胁迫下各品种的干物质积累总量均大幅下降, 而随着干旱胁迫的持续加剧, 各器官干重在生物量中所占的比重发生了不同的变化。
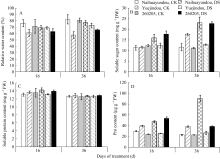
干旱胁迫下3个品种的 Pn、 Tr和 Gs均显著下降。干旱处理36 d (结荚期), 品种间 Pn差异显著, 奶花芸豆的 Pn下降87.4%。与之相比, 跃进豆和260205 的 Pn分别下降75.9%和65.1% (图3-A), 因此, 抗旱品种在干旱胁迫下 Pn下降幅度明显小于敏感品种, 表现出较高的生产力。干旱胁迫处理前期, 不同抗旱性品种间的 Gs差异不显著, 随着干旱胁迫的持续加
 | 图2 干旱胁迫下不同品种干物质分配A: 干旱胁迫16 d; B: 干旱胁迫36 d。 A: 16 days of drought treatment; B: 36 days of drought treatment.Fig. 2 Dry matter partitioning of different common bean cultivars under drought treatments |
剧, 2个抗旱品种的 Gs减少量逐渐小于敏感品种, 尤其在干旱处理36 d后, 差异最为明显, 跃进豆和260250的 Gs减少量分别为68.7%和85.5%, 而奶花芸豆则高达94.3% (图3-B)。 Tr的变化趋势与 Gs相似, 在干旱胁迫下, 各品种均大幅降低(图3-C)。尽管水分亏缺对各种光合特性产生了负效应, 但与对照相比, 3个品种均提高了自身的WUE, 抗旱品种升高幅度高于敏感品种, 尤其是在干旱处理36 d后(灌浆期), 跃进豆的WUE增幅高达230.5%, 而奶花芸豆仅为84.3% (图3-D)。
与对照相比, 3个品种在干旱胁迫下的叶片RWC都呈现不同程度的下降趋势, 且随干旱胁迫的持续加剧, 叶片RWC变化幅度增高。干旱处理16 d, 奶花芸豆叶片RWC下降19.4%, 而抗旱品种下降幅度较小, 其中跃进豆的处理和对照之间无显著性差异; 干旱处理36 d, 奶花芸豆的叶片RWC下降29.8%, 而跃进豆和260205仅下降5.3%和9.5% (图4-A)。
渗透调节物质含量的增加, 可以降低植物自身的水势, 从而提高植物的吸水能力, 与叶片RWC密切相关。干旱胁迫16 d, 跃进豆和260205叶片中脯氨酸含量较对照明显增加, 增幅分别为95.9%和109.0%; 奶花芸豆叶片中脯氨酸含量较对照增加32.2%, 3个品种的可溶性糖与可溶性蛋白含量均无明显变化; 干旱胁迫36 d, 渗透调节物质含量变化更为明显, 跃进豆叶片中脯氨酸含量约为对照的3倍, 增幅比奶花芸豆高223.0%; 奶花芸豆、跃进豆和260250的可溶性糖含量分别增加了51.3%、107.0%和76.7%, 而可溶性蛋白含量仍无显著变化。
干旱胁迫16 d跃进豆和260205的丙二醛(MDA)含量与对照相比无显著差异, 而奶花芸豆的MDA含量快速增高, 比对照增加28.5%; 干旱胁迫36 d, 各品种的MDA含量均有一定程度的升高, 与对照相比, 奶花芸豆升高67.5%, 而跃进豆和260205仅升高36.5%和37.3% (图5-A)。因此, 在整个干旱胁迫过程中, 抗旱品种的MDA含量变化较为平缓, 与对照相比增加幅度较小。
 | 图5 干旱胁迫对不同品种保护酶活性及MDA含量的影响CK: 对照; DS: 干旱处理。CK: control; DS: drought stress.Fig. 5 Effects of drought stress on protective enzyme activities and MDA content in different common bean cultivars |
在整个干旱胁迫时期, 3个品种的超氧化物歧化酶(SOD)和过氧化物酶(POD)活性均表现上升趋势(图5-B, C)。干旱胁迫16 d, 奶花芸豆的SOD、POD活性分别比对照增加101.0%、240.0%, 显著高于跃进豆(8.6%、93.2%)和260205 (33.6%、62.5%)。随着干旱胁迫的持续, 不同抗旱性品种的抗氧化酶活性不同程度升高, 干旱胁迫36 d, 跃进豆的SOD、POD活性比对照分别增加63.4%、225.0%, 增幅显著高于奶花芸豆(30.1%、81.3%)。
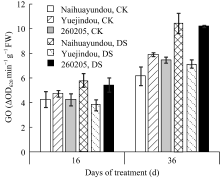
与对照相比, 干旱胁迫16 d各品种光呼吸关键酶-乙醇酸氧化酶(GO)的活性均有显著上升, 奶花芸豆上升11.2%, 跃进豆和260205分别上升37.1%和42.3%, 增幅高于敏感品种(图6), 因此, 干旱胁迫下抗旱品种的光呼吸反应更为灵敏。干旱胁迫36 d, 奶花芸豆的GO活性升高27.8%, 跃进豆和260205的GO活性分别升高39.9%和42.6%。由此可见, 干旱胁迫36 d与干旱胁迫16 d相比, 奶花芸豆的GO活性增加16.6%, 而抗旱品种无显著变化。
普通菜豆以收获籽粒为主要目的, 不同品种在干旱胁迫下有较大的产量差异, 这与多种因素相关, 利用产量及其构成因素综合评价普通菜豆的抗旱性较为可靠[ 20]。本研究相关分析发现, 单株粒数、单株荚重以及单荚粒数与单株产量显著或极显著相关, 可以作为普通菜豆全生育期抗旱性评价的综合指标, 此结果与Ramirez-Vallejo等[ 21]研究结果一致。然而, 利用产量性状评价普通菜豆抗旱性较为耗时, 限制了科学研究和育种工作的效率, 因此评价及筛选其他抗旱相关生理指标具有重要意义。Amed等[ 22]认为, 可溶性糖含量增高能够降低叶片水势, 提高叶片RWC; 而Rosales等[ 11]则认为, 干旱胁迫下敏感品种的可溶性糖含量与抗旱品种差异不显著; 本研究数据表明, 可溶性糖含量只有在高度干旱胁迫下, 差异才较为明显, 且水分利用效率、脯氨酸含量、叶片相对含水量、丙二醛含量以及乙醇酸氧化酶活性在不同抗旱性品种间差异显著, 稳定性较高, 因此, 后五者能够有效区分不同品种的抗旱性, 是评价抗旱性的关键指标, 可应用于普通菜豆抗旱育种、栽培相关研究中。
普通菜豆生长环境复杂多样, 在长期的进化过程中形成了复杂的抗逆生理机制, 其中形态适应性尤为重要。Acosta-Gallegos等[ 23]认为, 抗旱普通菜豆在干旱环境下的高产与叶干重的损失有关。Cuéllar-Ortiz等[ 24]通过碳同位素示踪的方法研究抗旱品种Pinto Villa, 发现其抗旱性主要取决于叶片碳水化合物向荚或籽粒的高效转移, 这也是抗旱性品种茎叶减少的主要原因。本研究发现, 光合产物的有效转移体现于普通菜豆全生育期, 苗期干旱胁迫下, 抗旱性较好的品种能够将光合产物有效运输到根部, 限制地上部的生长, 表现为较大的根冠比, 不仅保证了水分的有效吸收, 而且减少了茎叶部的蒸腾, 为后期生殖发育打下了坚实的形态基础; 结荚期遭遇干旱胁迫, 抗旱性品种限制自身的营养生长, 将光合产物更多地用于生殖生长, 保证较高的结荚率和籽粒的填充, 从而获得较高的产量。
光合作用是植物体生长发育的物质基础, 干旱胁迫下普通菜豆的 Gs和 Tr是受环境影响的主要指标; 水分亏缺时 Gs减小, 导致可利用的CO2减少, 影响光合原料的供应[ 25]。本研究中, 3个供试品种在不同干旱程度下的 Pn、 Gs和 Tr均下降; 其中, 抗旱品种的 Gs下降幅度较小, 有利于CO2的吸收, 从而保证生长后期荚的形成和籽粒填充所需要的原料供给。此外, 本研究结果显示, 抗旱性与WUE密切相关, 抗旱性较好的品种即使在干旱胁迫后期依然能够保持较高的WUE, 这可能是通过CO2的有效扩散和高效固定等措施实现的[ 25, 26]。
干旱环境下, 植物通过气孔关闭防止过多的水分流失, 叶中的二氧化碳浓度随之降低, 导致碳反应停滞, 不能及时消耗多余的ATP, 使得活性氧出现机率增大, 从而引发或加剧膜脂过氧化作用, 造成细胞膜系统的损伤, MDA是最重要的膜脂过氧化产物之一[ 27, 28]。本研究中, 抗旱品种在干旱环境下的MDA含量始终低于敏感品种, 表明其细胞损伤程度较低, 具有较高的自我保护能力。Turkan等[ 29]研究指出, 抗氧化酶类可以消耗不良环境下产生的过氧化物, 减少细胞损伤, 是普通菜豆逆境下的重要保护机制; 本研究发现, 短期干旱胁迫下, 抗旱品种的SOD、POD活性均低于敏感品种, 而长期胁迫下, 抗旱品种的SOD、POD活性超过敏感品种, 由此可见, 抗旱品种的抗氧化酶应答相对缓慢, 在干旱胁迫后期才表现出一定的优势, 这与MDA的测定结果存在分歧, 因此, 普通菜豆中可能存在其他保护途径与抗氧化酶共同作用, 降低水分亏缺对细胞的伤害。
光呼吸可以消耗多余能量, 减少有害物质的生成, 是植物体存在的另一种保护机制[ 30]。Rosales等[ 11]研究表明, 在干旱环境下, 普通菜豆旱敏感品种的光呼吸关键酶GO活性降低, 而抗旱品种升高, 光呼吸有利于普通菜豆的抗旱性。本研究中, 在干旱胁迫前期, 抗旱品种的GO活性显著高于敏感品种, 在干旱胁迫后期, 不同抗旱性品种的GO活性均保持较高水平。由此可见, 抗旱品种的光呼吸对逆境的应答更为灵敏, 干旱胁迫前期抗旱品种通过较强的光呼吸减少了有害物质的生成, 有效防止了膜脂的过氧化, 有利于细胞膜的完整性; 由于这些有害物质是抗氧化酶的催化底物, 因此也使得抗氧化酶的活性受到抑制, 这可能是干旱胁迫前期敏感品种抗氧化酶活性高于抗旱品种的主要原因; 随着干旱胁迫的持续, 气孔大量关闭, 光呼吸无法满足抗旱品种的自身保护, 产生了一定的有害物质, 从而激发抗氧化酶活性大幅升高。由此认为, 在整个干旱胁迫时期, 通过光呼吸和抗氧化酶的相互配合有效降低活性氧等有害物质的水平, 减缓叶片细胞的损伤, 是抗旱品种适应性调节的重要体现。
叶片的持水性与产量和生物量之间呈显著正相关, 在干旱条件下, 植物通过渗透调节物质的增加, 降低细胞质水势, 从而提高叶片RWC, 在维持水分平衡方面起到了重要的作用[ 31]。本研究表明, 干旱条件下, 抗旱品种叶片RWC下降幅度小于敏感品种, 能够较好地保持自身叶片的水分平衡; 游离脯氨酸是对干旱反应最为灵敏的渗透调节物质, 品种间可溶性糖含量的差异仅在干旱胁迫后期才有明确表现, 而可溶性蛋白含量可能与抗旱性关系不紧密。Rosales等[ 11]研究指出, 气孔调节是普通菜豆保持体内水分平衡的主要机制, 本研究3个品种的气孔导度在干旱胁迫下均显著减小, 水分散失速率降低, 也可能是一种有效的干旱应答方式, 但是敏感品种的下降幅度大于抗旱品种, 所以气孔导度在普通菜豆抗旱性中所发挥的作用仍需深入探讨。
普通菜豆抗旱性是多种生理调节机制协同作用的结果, 包括光合产物的有效分配, 良好的气孔调节及较高的WUE, 抗氧化酶与光呼吸对有害物质的清除和抑制, 脯氨酸及可溶性糖的渗透调节等。利用单株产量、单株粒数、单株荚重和单荚粒数可以综合评价普通菜豆全生育期抗旱性, 提高抗旱种质筛选的准确性; WUE、脯氨酸含量、叶片RWC、MDA含量以及GO活性在不同的普通菜豆品种间具有稳定的差异, 也可以作为抗旱性评价指标运用于科学研究和育种工作。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|