植物MAPKs (mitogen-activated protein kinases)在多种生物和非生物胁迫中起重要作用。课题组前期克隆了甘蓝型油菜
Plant MAPKs (mitogen-activated protein kinases) play an important role in defense to biotic and abiotic stresses. In our previous studies,
促分裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)级联反应是真核生物信号传递网络中的重要途径之一。在植物中, MAPK除与许多生命活动有关外, 在应对冷、热、氧化、紫外线、干旱、病原菌侵害等多种非生物和生物胁迫方面也起着重要作用[ 1]。近年来对植物MAPK功能的研究已逐步深入, 越来越多的研究表明, MAPKs在植物抗病防卫中起重要作用, 在多种植物中发现了大量MAPK家族成员, 并不同程度地研究了其功能, 研究最深入的是拟南芥的 MAPK1。近年来对其他植物的 MAPK1也有相关研究, 许多研究均表明 MAPK1有助于提高植株的抗逆性[ 2]。如Mizoguchui等[ 3]研究表明拟南芥 AtMAPK1的表达水平在盐胁迫处理后会增强。谷令坤[ 4]研究发现玉米 ZmOSMAPK1能够被干旱、高盐、机械损伤诱导表达。而至今还未见对油菜 MAPK1的研究报道。
油菜( Brassica napus)作为一种重要的油料作物, 在我国乃至世界均占有重要的地位。但每年菌核病的危害, 严重降低了油菜的产量和品质[ 5]。菌核病是影响我国油菜生产的主要因子之一, 在我国各油菜产区, 特别是长江中下游产区, 表现得尤为突出。尽管也采取了一些化学防治措施但未能从根本上解决问题, 近年来, 培育高抗油菜品种和寻找有效抗性材料已成为研究者们的主要目标, 但在油菜菌核病抗源筛选上仍未找到理想的免疫材料。目前, 发掘油菜中与菌核病抗性相关的基因并通过转基因方法提高该病害的抗性也已为研究热点。
本研究组前期以甘蓝型油菜中油821DH系为试材, 克隆了 BnMAPK1, 并研究了 BnMAPK1基因的表达特性及其在逆境因子诱导下的转录表达特征。同时还构建了以CaMV 35S为启动子, 超量表达 BnMAPK1的载体, 转化甘蓝型油菜获得转基因株系, 并对超量表达转基因株系进行分子鉴定和表型鉴定。本研究在此基础上, 以甘蓝型油菜中油821DH系(对照)和转基因 BnMAPK1超量表达植株为材料, 调查接种核盘菌后转基因植株和对照之间的抗病性差异, 染病叶片草酸含量差异以及草酸氧化酶(OXO)、超氧化物歧化酶(Cu/Zn-SOD)、β-1,3-葡聚糖酶(PR2)和几丁质酶(PR3)编码基因的相对表达差异。探讨 BnMAPK1基因在油菜抗菌核病方面的作用及机制, 以期从油菜中挖掘更多提高抗病性的相关基因, 为油菜的分子育种和分子设计提供理论依据, 也为其他植物的 MAPK1研究提供参考资料。
试验于2012年在重庆市油菜工程技术研究中心进行。甘蓝型油菜中油821DH系(对照)和转基因821DH植株的2个株系(ov1, ov2)均由重庆市油菜工程技术研究中心提供。于温室种植并按常规栽培管理材料。核盘菌由重庆市油菜工程技术研究中心分离、保存。参照万华方等[ 6]的方法培养、活化以及接种核盘菌。
供试材料长至12片真叶时, 取倒数第3片叶放入保鲜盒迅速带回实验室, 参照Mei等[ 7]的方法, 将菌丝块菌面贴于叶面主叶脉两侧, 保持接种环境内温度23℃, 相对湿度90%。接种36 h后, 测量病斑的长径和短径。根据公式 S = π × a × b/4计算病斑面积, 其中a、b分别为病斑长径(cm)和短径(cm)。每个处理设置3次重复。
接种0、6和12 h后分别用无菌打孔器(内径1.1 cm)沿菌丝块周围在叶片打孔取样, 接种24 h和36 h后的叶片去掉病斑后, 再用无菌打孔器沿病斑周围在叶片打孔。称量后放入研钵加入0.5 mol L-1的盐酸3 mL, 研磨至匀浆, 转入试管, 超声波处理15 min, 加入3 mL去离子水静置过夜, 14 000 × g离心20 min, 将上清液转入离心管。采用高效液相色谱法(HPLC)[ 8]测定草酸含量, 重复3次。
在VenusilASBC18 (4.6 mm × 250.0 mm, 5 µm)上, 选用0.04 mol L-1的KH2PO4-H3PO4缓冲液(pH 2.4)采用Waters2998二极管数组紫外检测器于214 nm检测, 不连续梯度洗脱, 柱温35℃, 进样量20 µL, 检测时间20 min。
接种核盘菌0、6、12、24和36 h后去除病斑, 取其周围约100 mg叶片, 于液氮中迅速研磨成粉末, 并用试剂盒RNAprep pure Plant Kit (天根生化科技(北京)有限公司)提取总RNA, 用RNase-free DNase I (Fermentas公司)去除DNA杂质。用Thermo NanoDrop 2000c微量紫外分光光度计测定RNA浓度, 1.2%的琼脂糖凝胶电泳检测总RNA的完整性。
用cDNA反转录试剂盒(iScript cDNA Synthesis Kit, Bio-Rad), 按照说明书合成总cDNA第1链。以20 μL反应体系[5×iScript Reaction Mix 4 μL、iScript Reverse Transcriptase 1 μL、RNA模板(1 μg总RNA) 11 μL、Nuclease-free water 4 μL]进行反转录, 反应程序为25℃ 5 min, 42℃ 30 min, 85℃ 5 min, 4℃ 10 min。将获得的cDNA稀释50倍, -20℃保存用于qRT-PCR分析。
参照NCBI数据库中相关基因的编码序列, 用软件Geneious 4.85设计引物。所用的引物及内参基因 Actin7和 UBC21的序列见表1。用qRT-PCR试剂盒(SsoAdvantanced SYBRT Green Supermix kit, Bio-Rad)于Bio-Rad CFX96 Real-time System上进行实时荧光定量PCR分析, 10 μL反应体系(SsoAdvantanced SYBRT Green Supermix 5 μL、RNase/DNase-free water 2 μL、上下游引物各0.25 μL, cDNA 2.5 μL)。扩增反应程序为95℃ 30 s, 95℃ 5 s, 61℃ 30 s, 65℃ 5 s, 40个循环(根据不同引物调整退火温度)。每个取样点设3次技术重复, 采用2-ΔΔCT法分析确定基因的相对表达量。
采用Microsoft Excel 2003作图, SPSS13.0软件进行方差分析。
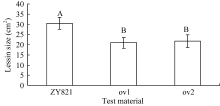
采用叶片离体接种进行菌核病抗性鉴定, 接种36 h后, 转基因植株和对照都有可见菌斑, 其大小明显不同, 对照的菌斑为深褐色且有穿透叶片的迹象, 而转基因植株的菌斑为白色且没有穿透叶片的迹象(图1)。统计病斑大小由(图2)可见, 转基因油菜离体叶片病斑显著小于对照。叶片菌核病抗性鉴定方差分析结果表明, 转基因植株和对照对菌核病的抗性存在极显著差异( P<0.01)。说明转基因油菜的抗菌核病能力显著提高, BnMAPK1在提高油菜抗菌核病性中起作用。
| 表1 qRT-PCR所用引物 Table 1 Primers for qRT-PCR |
 | 图1 离体叶片接种36 h后呈现的病斑大小Fig. 1 Difference of lesion on the detached leaves after inoculation with S. sclerotiorum for 36 hours |
由图3可见, 转基因植株病斑周围叶片组织的草酸含量在接种前显著低于对照植株, 接种6 h后两者均出现升高现象, 但是, 转基因植株草酸含量升高的幅度显著低于对照植株。24 h转基因植株叶片的草酸含量已恢复到正常水平, 而对照植株叶片草酸含量在36 h才恢复至本底水平。说明转基因植株能更快地降低染病叶片内草酸的积累量, 暗示 BnMAPK1可能通过抑制油菜罹病组织内草酸的积累量, 减少草酸对植株的伤害, 进而提高油菜的抗病性。
2.3 BnMAPK1超量表达对油菜抗病关键酶编码基因表达的影响
2.3.1 OXO的相对表达量动态变化 如图4-a、表2所示, 草酸氧化酶编码基因 OXO的相对表达量在转基因植株和对照间及其与接种时间的互作效应均达到极显著水平( P< 0.01)。接种前(0 h), 转基因植株中 OXO的相对表
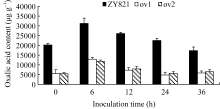 | 图3 离体叶片接种核盘菌后病斑周围叶片草酸含量的比较Fig. 3 Comparison of oxalic acid content around the lesion on the detached leaves inoculated by S. sclerotiorum |
达量略低于对照植株。接种后, 转基因植株和对照中的 OXO的相对表达量均逐渐降低, 但转基因植株降低的幅度小于对照植株, 且显著高于对照的表达量。到接种 36 h后, 该基因的相对表达量在转基因植株中又显著上调, 而对照中仍表现为下降趋势。此时转基因植株 OXO表达量是对照植株的30倍 。表明, 核盘菌可能对 OXO的转录有抑制作用, 而 BnMAPK1可降低或部分解除其抑制作用。说明 BnMAPK1基因可能通过介导抗病基因 OXO的表达来改进油菜的抗病性。
2.3.2 Cu/Zn-SOD的相对表达量动态变化 对超氧化物歧化酶编码基因( Cu/Zn-SOD)相对表达量动态变化及方差分析(表2)显示, 转基因植株和对照间及其与接种时间的互作效应均达极显著水平( P< 0.01)。如图4-b所示, 接种前, 转基因植株中 Cu/Zn-SOD的相对表达量略高于对照。接种6 h, 转基因植株和对照的 Cu/Zn-SOD相对表达量均下降, 接种12 h后, 又表现上升趋势且转基因植株上升速度较快, 到接种36 h后转基因植株该基因表达量已高于对照6倍。表明 BnMAPK1基因可诱导抗病相关基因 Cu/Zn- SOD的上调表达, 从而提高油菜的抗病性。
2.3.3 PR3相对表达量动态变化 如图4-c所示, 接种前, 转基因植株和对照中的几丁质酶编码基因 PR3的相对表达水平都很低。随接种时间的延长, 转基因植株和对照中 PR3的相对表达水平逐渐上升, 接种36 h后达最高值, 此时转基因植株的表达量极显著高于对照( P<0.01) (表2)。可见, 核盘菌可诱导 PR3表达, 且在转基因植株中表现更突出, 表明 BnMAPK1基因介导了抗病相关基因 PR3的诱导表达。
2.3.4 PR2相对表达量动态变化 如图4-d所示, 接种核盘菌前(0 h), 转基因植株和对照植株中β-1,3-葡聚糖酶编码基因 PR2的相对表达量甚微。接种后均有不同程度的小幅增加, 36 h后转基因植株中 PR2的相对表达量急剧上升, 且远远大于对照植株中该基因的表达量。方差分析结果表明, 转基因植株和对照间 PR2的相对表达差异达到极显著水平, 转基因植株和对照与接种时间的互作效应也达到极显著水平( P<0.01) (表2)。说明 BnMAPK1可介导抗真菌蛋白β-1,3-葡聚糖编码的基因 PR2的上调表达。
综上所述, 在核盘菌胁迫下 BnMAPK1基因介导抗病相关基因 Cu/Zn-SOD、PR2和 PR3的表达水平显著上调, 同时, 可能可以解除抑制或诱导 OXO的转录表达, 从而提高了油菜的抗病性。
| 表2 酶编码基因相对表达量动态变化方差分析 Table 2 Dynamics analysis of relative expression of the genes encoding four enzymes in the leaf inoculated by S. sclerotiorum |
**表示在 P < 0.01水平差异极显著。**Significant difference at P < 0.01.
植物 MAPK基因分为A、B、C、D 4个亚族, 目前关于植物C和D亚族 MAPK的研究较少, 功能分析相对欠缺, 且对植物C亚族 MAPK1的研究更少, 即使是在拟南芥中也不明确。已有研究表明, 草酸是菌核病主要的致病因子[ 9]。草酸作为一种菌核病的毒素参与致病性已有大量研究, Andreas等[ 10]的研究表明草酸可以加快核盘菌致病的过程, Rai和Dhawan[ 11]证实了油菜菌核病中草酸毒素的存在, 刘胜毅等[ 12]研究表明油菜对菌核病的抗性和对草酸的抗性是高度一致的。吴纯仁等[ 13]通过对草酸毒素在罹病组织内积累和分布的初步研究发现, 组织内草酸的积累与病害的严重程度相一致。不同感病程度的罹病植物体内毒素的积累量及分布均有显著性差异, 易感品种(系)内积累了较多的草酸且能扩散至病斑相邻的健康区域。赵丹丹等[ 14]的研究表明, 受菌核病诱导后, 随着病斑的不断扩大, 罹病组织内的草酸含量开始上升, 且相同时间内低抗品种的草酸积累量要显著高于对应的高抗品种。许多学者通过试验已证明, 油菜对草酸的抗性与对病原菌抗性显著一致, 所以草酸可以用来鉴定油菜对菌核病抗性。本研究发现转基因植株在受核盘菌诱导后, 染病叶片内草酸的积累量极显著少于对照, 说明 BnMAPK1可抑制油菜叶片中草酸积累, 从而提高油菜抗病性。本研究中抗菌核病性的鉴定结果也证实了该点。
草酸氧化酶是生物界最重要的草酸降解酶之一, 它氧化草酸生成的H2O2能抵制致病菌的入侵使植物获得系统抗性[ 15, 16]。草酸氧化酶催化草酸转化为H2O2和CO2来降解草酸的毒性, 延缓病原真菌的侵染, 在植物发育、胁迫及抗病防御中起着重要作用。目前在油菜[ 17, 18]、荷包豆[ 19]、大豆[ 20]、花生[ 21]等多种植物中已有利用草酸氧化酶(OXO)改良菌核病抗性的报道。核盘菌分泌的草酸在植物体内的积累、分解和运输以及调控涉及很多复杂的过程和机制。本研究发现 BnMAPK1可以解除核盘菌侵染对 OXO转录表达的抑制作用, 从而使罹病组织草酸的清除能力维持在一定水平, 减轻病害对油菜的伤害。
Cu/Zn超氧化物歧化酶在真核生物的SOD中含量最高, 是清除植物体中活性氧(ROS)的主要抗氧化酶之一, 对减轻植物逆境胁迫下活性氧伤害有重要作用, 是植物的重要防御酶[ 22, 23]。SOD在抗病中的作用已有许多研究, 其中包括小麦斑点病[ 24]、黄瓜霜霉病[ 25]、小麦白粉病[ 26]等, 研究发现感染病害的植株体内SOD活性都有所增强。杨鸯鸯等[ 27]发现甘蓝型油菜中 Cu/Zn-SOD基因在接种菌核病后, 抗病材料中的表达量要显著高于感病材料。本研究发现转基因植株在接种菌核病前后 Cu/Zn-SOD基因的表达量均显著高于对照, 且 BnMAPK1基因介导病害胁迫下 Cu/Zn- SOD基因的诱导表达, 进而提高油菜的抗病性。
当植物受到病原菌及其他逆境胁迫时, 会产生大量的病程相关蛋白(PRs), 这些蛋白是由各种病原体和相关逆境胁迫因子诱导产生的, 它们与植物的防卫反应密切相关。虽然许多PR蛋白的具体生物功能还未知, 但多数表现出抗菌防御反应[ 28]。几丁质酶和β-1,3-葡聚糖酶, 分别属于PR2和PR3类, 这两类蛋白是目前研究报道最多的与抗真菌有关的蛋白[ 29]。β-1,3-葡聚糖与几丁质为大多数真菌细胞壁的主要成分, 他们可被β-1,3-葡聚糖酶与几丁质酶水解[ 30]。本研究发现, 核盘菌可显著诱导转基因植株中 PR2和 PR3的上调表达, 表明 BnMAPK1基因参与油菜抗菌核病响应, 并介导抗病防御蛋白的表达, 增强油菜的抗病能力。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|