**同等贡献(Contributed equally to this work)
阐明BT型杂交粳稻组合间育性差异的遗传基础有助于三系法杂交粳稻组合的选育。根据TR2604与豫粳6号A(B)、9201A(B)后代的花粉育性及小穗育性, 明确了豫粳6号A(B)/TR2604 F1不育由双亲间特异性不亲和造成。遗传分析表明豫粳6号A(B)与TR2604 F1花粉不育受单基因
Understanding genetic basis of spikelet fertility of BT-type hybrid rice may facilitate three-line
在杂交粳稻育种研究中, 三系法粳稻杂种优势利用主要以应用BT (Chinsura boro II)型不育细胞质来实现, 其粳稻恢复系的恢复基因是通过“籼粳架桥”技术从籼稻中获得的[ 1, 2, 3]。育种经验表明, 不同恢复系与不育系组合间的育性存在差异, 特别是同质恢复系与不同不育系配制组合间更易出现差异, 并认为这是由恢复系恢复力及不育系可恢复性之间的差异造成。近年来, 随着本课题组粳稻三系育种材料的积累, 从中筛选到一些亲本, 利用它们配制的一些组合能够在组合间表现明显的育性差异。在不育系方面, 利用河南品种豫粳6号新转育的豫粳6号A配制的许多组合育性较低, 甚至不育[ 4]。在恢复系方面, 本课题组自选TR2604与BT型粳稻不育系9201A测交后代能正常恢复结实, 但对许多BT型不育系不能正常恢复, 与豫粳6号A的测交后代基本不育, 组合间育性表现极端的差异, 相关现象尚未见报道。
关于豫粳6号A/TR2604 F1不育的原因, 本课题组通过分析恢复系TR2604选育系谱进行了探讨。TR2604是武运粳8号A/SWR19 F1经自交多代选育而成的同质恢复系, 其中亲本SWR19为自选广亲和广谱型粳稻恢复系, 由02428/IR64组合自交多代选育而成, 经多次测交其对BT型不育系具有正常恢复力, 说明TR2604带有BT型的育性恢复基因, 据此初步推测豫粳6号A/TR2604 F1不育可能由双亲间特异性不亲和造成。本研究中利用豫粳6号A、9201A及相应保持系与恢复系TR2604配制组合, 根据不同组合的育性, 系统分析豫粳6号A/TR2604 F1不育的原因, 在此基础上利用分离群体对控制杂种不育的基因进行遗传分析及定位, 相关研究结果有助于阐明不同BT型杂交粳稻组合育性存在差异的原因, 为三系杂交粳稻的选育提供借鉴。
BT型不育系豫粳6号A、9201A及其保持系豫粳6号B、9201B, 恢复系TR2604。
2010—2013年, 在江苏扬州、海南两地分别配制豫粳6号A/TR2604、豫粳6号B/TR2604、9201A/TR2604、9201B/TR2604等F1组合、豫粳6号A//豫粳6号B/TR2604三交F1群体、豫粳6号A/TR2604//TR2604与豫粳6号B/TR2604//TR2604回交群体及豫粳6号A/TR2604//TR2604 BC1F2群体; 2011—2013年, 在江苏扬州种植上述各组合、群体及相关亲本。
调查亲本及F1各10株、分离群体内每个单株的花粉育性及小穗育性。每日早晨7:00至9:00, 在田间从每个始花植株上选取一个已抽出约1/3的主穗或较大分蘖穗。在每个穗子的中上部枝梗中选取3朵当天要开放的颖花, 用1% I2-KI液染色、压片, 在低倍显微镜下观察花粉育性。根据花粉粒的形状和对I2-KI液的染色反应, 将花粉划分为典败、圆败、染败和正常4种类型。观察时, 选择分布均匀、花粉数目超过100粒的视野, 分别记录4类花粉的数目, 计算4类花粉的百分率。
在抽穗期间, 每日7:00至9:00, 选取尚未开花的小穗套袋, 每袋2穗, 20 d后, 剔除折断或自交袋破损的穗, 调查群体内单株的套袋小穗育性与自然小穗育性。
采用CTAB法提取水稻基因组DNA[ 5]。PCR体系含模板DNA 1.0 μL, 10×PCR缓冲液2.0 μL、 25 mmol L-1MgCl2 2.0 μL、2 mmol L-1dNTP 2.0 μL、0.3 μmol L-1引物2.0 μL、 Taq DNA聚合酶0.5 U, 加ddH2O补足20 μL。PCR扩增条件为95℃预变性 5 min; 94℃变性50 s, 55℃退火40 s (温度因引物不同而异), 72℃延伸30 s (不同长度的预期产物按 1 kb min-1调整延伸时间), 扩增32个循环; 72℃延伸 10 min, 18℃保温。PCR产物经3%琼脂糖凝胶电泳及溴化乙锭染色后在UVP Bio-Imaging Systems凝胶成像仪上成像。如果在3%琼脂糖凝胶电泳中没有多态, 则在6%垂直平板聚丙烯酰胺凝胶上电泳, 经0.1%硝酸银染色后观测。
SSR引物信息来自Gramene网站(http://www. gramene.org/)。DNA聚合酶、普通PCR试剂购自生工生物工程(上海)有限公司, 由生工生物工程上海有限公司和上海英骏生物技术有限公司合成引物。
2011—2013年, 在江苏扬州分别调查6个亲本与4个F1组合的花粉育性和小穗育性(表1)。
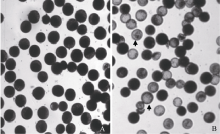
由表1可以看出, 2012年9201A/TR2604 F1与相应保持系杂种的育性无显著差异, 表明TR2604带有BT型恢复基因。2011—2013年, 豫粳6号A/TR2604和豫粳6号B/TR2604杂种均出现超过20%的圆败花粉(图1), 且豫粳6号B/TR2604小穗育性显著低于9201B/TR2604小穗育性(2012), 表明豫粳6号B与TR2604之间不亲和。
| 表1 亲本及其F1的花粉育性与小穗育性 Table 1 Pollen and spikelet fertility of the parents and the corresponding F1 hybrids |
已有研究表明, BT型不育系的育性恢复由1对显性恢复基因 Rf1控制[ 8, 9]。2011年在江苏扬州利用与BT型恢复基因 Rf1紧密连锁的标记STS10-27和STS10-16[ 10]对豫粳6号A/TR2604//TR2604群体内单株进行基因型检测, 在带有杂合带型的植株中, 选择21株自然小穗育性>80%的植株收获种子, 2012年每个株系种植20株, 构建了包含417株植株的 BC1F2群体。BT型不育系为配子体不育, 如果豫粳6号A的育性恢复由 Rf1控制且TR2604中带有 Rf1, 那么BC1F2群体内所有单株均应可育, 连锁标记带型仅表现为TR2604带型(基因型为 Rf1Rf1)和双亲杂合带型(基因型为 Rf1rf1), 两者比例为1∶1。2012年田间目测表明, 该BC1F2群体中未发现不育株, 标记检测结果显示, 在该群体中带有TR2604带型(基因型为 Rf1Rf1)的单株为194株, 带有双亲杂合带型(基因型为 Rf1rf1)的单株为223株, 两种基因型植株符合1∶1分离比(χ2= 1.88 < χ20.05= 3.84), 表明TR2604中带有恢复基因 Rf1。结合标记检测结果, 随机选择基因型为 Rf1rf1与 R f1Rf1的单株各20株考察自然小穗育性, 不同基因型植株间育性无显著差异(均超过75%), 说明 Rf1基因表现为显性且能使豫粳6号A育性恢复正常, 由此确定豫粳6号A/ TR2604 F1不育由双亲间不亲和造成。
2012年, 调查豫粳6号A//豫粳6号B/TR2604三交群体中103株、豫粳6号A/TR2604//TR2604回交群体中225株单株的花粉育性、套袋小穗结实率和自然小穗结实率。由于在这2个群体中单株均带有BT型不育胞质, 植株的花粉中存在染败花粉, 染败花粉与正常花粉较难区分, 因而3种指标的育性之间相关性不显著(数据未列出)。在所调查的群体内, 植株分为两类: 一类如亲本, 花粉中几乎不出现圆败花粉, 另一类如豫粳6号A(B)/TR2604杂种, 会出现一定比例(10%~70%)的圆败花粉, 据此以圆败花粉率≥10%作为杂种不育标准分析上述群体中植株育性的分离(表2)。
| 表2 三交及回交群体中育性分离 Table 2 Fertility segregation of the plants in three-way-cross and backcross populations |
由表2可以看出, 豫粳6号A//豫粳6号B/ TR2604三交群体及豫粳6号A/TR2604//TR2604回交群体中的杂种不育株与可育株比值均符合1对基因控制的分离比(χ2< χ20.05= 3.84), 表明亲本豫粳6号B与TR2604具有1对杂种不育基因, 结合已有的报道[ 11, 12], 将该杂种不育基因暂命名为 S38(t)。
2011—2013年, 豫粳6号A(B)/TR2604 F1植株花粉育性调查表明, S38(t)导致雄配子的败育(部分花粉为圆败), 同时在豫粳6号B/TR2604//豫粳6号B、豫粳6号A/TR2604//TR2604回交群体配制过程中, 父本分别为豫粳6号B、TR2604, 二者花粉均为正常花粉, 豫粳6号A(B)/TR2604 F1植株小穗上经人工剪颖及连续5 d的两父本花粉饱和授粉, 豫粳6号A(B)/TR2604 F1植株各小穗结实率均超过80%, 说明 S38(t)对豫粳6号A(B)/TR2604 F1植株雌配子育性无影响。由于豫粳6号A/TR2604 F1植株表现低育, 因此在豫粳6号A//豫粳6号B/TR2604三交群体中如出现高育植株, 其必然带有恢复基因且在 S38(t)位点上为豫粳6号B纯合基因型。2012年, 在豫粳6号A//豫粳6号B/TR2604三交群体103株植株中出现29株正常育性(无圆败花粉且自然小穗育性超过50%)的单株, 说明在豫粳6号B/TR2604 F1植株的花粉中, S38(t)位点上带有TR2604基因型的花粉败育。
2012年, 选用均匀分布于12条染色体上在9311与日本晴均具有多态的180对SSR、STS标记对双亲进行多态性分析表明, 这180对引物都具有扩增产物, 其中17对引物在双亲间表现出多态, 这些多态标记在各染色体上分布不均匀, 其中第1染色体2对, 第2染色体上1对, 第3染色体上3对, 第5染色体上2对, 第7染色体上6对, 第10染色体上3对, 多态标记比较集中分布于第7染色体上。以豫粳6号A//豫粳6号B/TR2604三交群体中29株可育株计作为 S38(t)的初步定位群体, 利用17对多态性标记对这些单株检测表明, 在标记RM3555处28株单株表现出豫粳6号B纯合带型, 1株单株表现为双亲杂合带型, 说明标记RM3555与 S38(t)连锁, 初步将 S38(t)定位于第7染色体长臂上。
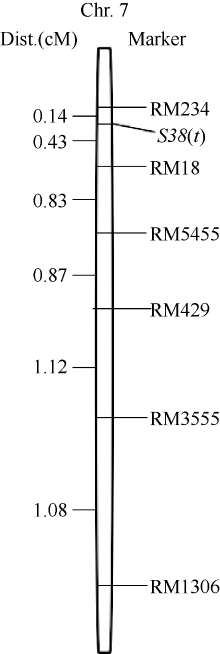
为明确 S38(t)在第7染色体上的具体区段, 在标记RM3555所在染色体区段内选择22对SSR标记在双亲间进行多态性分析, 结果表明RM1306、RM429、RM5455、RM18和RM234等5对标记具有多态。2012—2013年, 于豫粳6号A/TR2604// TR2604群体中选择110株低育株(圆败花粉率>50%且自然小穗育性<30%), 于豫粳6号B/TR2604//豫粳6号B群体中选择125株低育株(圆败花粉率> 50%且自然小穗育性<30%)、117株正常株(无圆败花粉且自然小穗育性超过75%)共计352株单株作为基因精细定位群体。利用标记RM1306、RM3555、RM429、RM5455、RM18和RM234对选择单株进行检测, 这些标记检测到交换株个数分别为31、23、15、9、3和1株, 根据交换株信息将 S38(t)定位于RM18和RM234之间, 与两标记遗传距离分别为0.43 cM和0.14 cM (图2), 两标记之间的物理距离改为180 kb。
在三系法粳稻杂种优势利用过程中, 一般选用一些主栽粳稻品种作为保持系转育BT型粳稻不育系, 恢复系的恢复基因需通过“籼粳架桥”技术从籼稻中获得[ 2, 3]。由于恢复系一般为籼粳交后代, 这就可能造成恢复系与不育系(保持系)间不亲和。育种家在三系杂交粳稻恢复系育种过程中, 通常根据不育系与恢复系测交F1的小穗育性来选留恢复系中间材料, 当选育非同质恢复系中间材料(不带有不育胞质)时, 低世代材料就进行测交, 无论是由亲和性还是质核互作育性恢复造成测配组合育性偏低的中间材料在低世代中即遭淘汰; 反之, 当选育同质恢复系(带有不育胞质)时, 低世代材料一般不进行测交, 育种材料未经筛选, 因此当同质恢复系材料稳定后进行测交时, 更易发现不同测交组合间育性存在差异。由于未用相应保持系与恢复系测交种作为对照, 育种家普遍将不同组合间育性差异归因于不育系可恢复性及恢复系恢复力之间差异, 因此目前有关杂交粳稻不育系与恢复系特异不亲和性研究还少有报道。本研究中, 自选恢复系TR2604与豫粳6号A(B)、9201A(B)配组后代的花粉育性及小穗育性之间存在显著差异, 在验证TR2604对不育系豫粳6号A的育性恢复由 Rf1控制的基础上, 明确了豫粳6号A(B)与TR2604间存在杂种不育现象。国内外学者普遍认为杂种不育主要由基因控制, 经不同分离群体遗传分析表明豫粳6号A(B)与TR2604间存在1个杂种不育基因位点 S38(t), 并明确了 S38(t)为1个杂种花粉不育基因。张桂权等发现, 籼粳杂种F1花粉不育至少受 Sa-Sf等6个基因座位控制[ 13, 14, 15], 大部分种间/亚种间雄性不育均符合单座位孢子体-配子体互作模式[ 16]。本研究中, 通过豫粳6号A//豫粳6号B/TR2604三交群体中植株的育性表现, 推断植株在 S38( t)位点处于杂合状态时, 其携带TR2604基因型的雄配子败育, 符合单座位孢子体一配子体互作模式。
水稻品种间杂种不育性是一个复杂的现象, 其表型易受环境影响。本研究中, 三交群体、回交群体均为初级群体, 群体内植株育性表现呈连续分布, 遗传分析时需根据亲本、F1及分离群体内植株育性的实际情况人为划定不育株与可育株。从基因定位结果的可靠性考虑, 定位时应选择分离群体中具有极端表型的单株, 因此在基因定位时, 结合亲本及F1的育性表现, 以圆败花粉率>50%且自然小穗育性<30%为低育株标准, 无圆败花粉且自然小穗育性超过75%为育性正常株标准在分离群体内选择352株单株作为定位群体。目前, 水稻中共定位了40多个雄配子不育基因, 分布于12条染色体上, 已成功克隆了 Sa[ 16]、 S27[ 17]、 S28[ 18]、 DPL1和 DPL2[ 19]5个雄配子不育基因。本研究中, 以352个单株作为定位群体, 将杂种花粉不育基因 S38(t)定位于第7染色体长臂上的标记RM18和RM234之间。在已有的杂种花粉不育基因定位报道中, 在第7染色体上共定位了4个位点, 分别是 S20[ 20]、 S21 ( S21-ruf)[ 20, 21]、 ga-11[ 22]、 S-23(t)[ 23]。比较发现, 其中 S21位于标记RM6063与RM5455之间, 与本研究中 S38(t)的定位区段相邻, 在 S38(t)定位区段未见有其他杂种花粉不育基因定位的报道, 由此推测 S38(t)为新的杂种花粉不育基因。为进一步精细定位与克隆 S38(t), 目前有关 S38(t)近等基因系材料正在构建中。
根据TR2604与豫粳6号A(B)、9201A(B)配组后代群体的花粉育性及小穗育性, 明确了TR2604与豫粳6号A(B)间存在特异性不亲和。豫粳6号A(B)与TR2604 F1花粉不育受单基因 S38(t)控制, 该基因被定位于第7染色体上标记RM18和RM234之间180 kb物理距离内。恢复系与不育系之间亲和性不同是造成杂交粳稻组合间育性差异的原因之一。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|