为了探明水稻侧根发育的过程和影响因素, 以日本晴(粳稻)、扬稻6号(籼稻)的不定根和种子根为材料, 观察了侧根发育过程中的形态和细胞结构的变化, 研究了生长调节物质、光照等因子对侧根发育的影响。结果显示, 水稻侧根的发生起始于中柱鞘。相邻的内皮层细胞参与了侧根原基的发生和生长。侧根原基通过顶端生长点的分裂、分化和基部细胞伸长向外生长, 侧根在露出过程中改变了母根皮层和表皮结构。外源生长素可促进侧根的发生, 但浓度过高则抑制侧根原基的露出; 稻苗切除芽后侧根发生减少, 主根生长量下降; 切除根尖打破了主根顶端优势, 促进侧根发生和生长。单侧照光能诱导向光侧的侧根发生。脱落酸在低浓度下对侧根发生有促进作用; Ca2+促进侧根发生和主根生长, 而EDTA抑制侧根发生和主根生长。种子根和不定根的生长对试验因子的响应趋势基本一致。
The adventitious roots and primary roots of Nipponbare and Yangdao 6 were used to measure lateral root number and the growth increment by Image J software with scanning photograph. Morphological and structural changes of lateral root primodia were observed by applying Spurr resin embedding and semi-thin sectioning, and light microscopy. Impacts of the lateral root emergence on the parent root structure was observed by fluorescence microscopy and scanning electron microscopy. Treatments with plant hormones, metal ions, illumination, and cutting off shoots or root tips were set up to analyse their influence on lateral root development. Results showed that rice lateral root initiation occurred from the pericycle. The endodermis also participated in the lateral root primodia formation and played protective as well as assistant roles in the process. The outward growth of lateral root primordia was realized by cell divisions of apical meristem and cell elongation at the base area. The cortex and epidermis structures of parent roots were also altered during the process of lateral root emergence. Exogenous IAA promoted the occurrence of lateral roots, but its high concentrations inhibited lateral root emergence. The number of lateral roots and growth of primary roots were significantly decreased when shoots were cut off. The apical dominance of root was lost when root tips were cut off, so that the growth of lateral roots and secondary lateral roots was accelerated. Unilateral illumination induced the increase of lateral roots in the light side. Abscisic acid at low concentrations promoted the formation of lateral roots. The formation of lateral roots and growth of primary root were promoted by Ca2+, while mostly inhibited by EDTA. The growth tendency of both adventitious roots and primary roots responsive to the treatments was basically consistent.
侧根是水稻根系的组成部分, 具有吸收和运输养分和水分以及稳固稻株的功能。由于水稻根在结构和进化上有特殊性, 可以作为模式作物来开展单子叶植物侧根发育的研究。因此, 研究稻根形态结构和发育规律具有重要的意义。侧根的发育属于胚后发育, 其结构和种子根十分相似。在同一种植物中, 侧根在母根组织中发生的位置是有规律的。在大部分双子叶植物中, 侧根起始位置是靠近原生木质部的中柱鞘, 能够启动侧根形成的中柱鞘细胞被称为中柱鞘建成细胞(pericycle founder cells, PFCs)[ 1]; 在单子叶植物中, 侧根起始位置是靠近韧皮部的中柱鞘, 在玉米中还发现内皮层(endodermis)不同程度地参与侧根的发生[ 2]。
由于拟南芥的根系解剖结构较为简单, 而且容易获得大量突变体, 因此, 在此之前对侧根发生机制的认识大多是从对拟南芥的研究中获得的[ 1, 3, 4]。虽然对水稻侧根发育的分子生物学研究目前也已深入开展[ 5, 6, 7, 8, 9], 但关于水稻侧根的发生和发育过程还缺乏系统的图片, 尤其对侧根形态建成的认识还未形成一致的看法。针对这一问题, 本试验采用外观形态测量和细胞结构观察相结合的方法, 研究了水稻侧根发生和生长的过程, 并探讨了某些生长调节物质、金属离子、光照等理化因子对侧根发生和根系生长的影响, 旨在明确水稻侧根发育的规律和影响因素, 为水稻优质高产栽培中控制根系的良好发育提供理论和方法。
水稻( Oryza sativaL .)品种粳稻日本晴(Nipponbare)、籼稻扬稻6号, 种植于扬州大学试验田中, 在旺盛生长的7、8月份, 选取健壮的稻株, 洗净根泥并剪去根系, 将茎基部插入水中遮光培养, 使其新生不定根后试验。另外, 在30℃的恒温暗室中水培以上2个品种的种子根备用。不定根简写为AR (adventitious roots), 种子根简写为PR (primary roots)。
1.2.1 稻根的形态和解剖结构观察 使用荧光显微镜、体视显微镜及摄影装置观察与记录侧根的形态结构和组织染色情况。稻根树脂半薄切片[ 10], 经1%番红染色后在光镜下观察与拍摄其显微结构。固定后的样品经丙酮脱水, 乙酸异戊酯过渡, CO2临界点干燥, 离子溅射镀金制样后在Philips XL-30型扫描电子显微镜下观察侧根的表面和断面结构。用1%的氯化硝基四氮唑蓝(NBT)对稻根剖面染色, 根据染色深浅分析超氧阴离子(
1.2.2 理化因素对侧根发生影响的观测 选取根长势一致的稻株, 对根分别进行下列处理后, 观察对侧根发育的影响。(1)去除芽和根的处理, 在种子萌发长出1 cm左右的芽和根时切除芽或根尖; (2)单侧照光处理, 采用直射式白色光源从右侧照光, 光强度为100 μmol m-2; (3)生长素(IAA)、生长素抑制剂(TIBA)、脱落酸(abscisic acid, ABA)、Ca2+离子和Ca2+螯合剂EDTA等处理, 处理浓度梯度见表1。
| 表1 各处理浓度的试剂 Table 1 Reagent concentrations in different treatments |
1.2.3 侧根数量和主根生长量的测定 将稻株置于水中使侧根分散, 用数码相机拍摄高分辨率照片, 然后利用Image J软件测量主根长度并计算生长量, 并对每条主根上露出表皮的可见侧根计数。每组试验均重复3次, 用Microsoft Excel 2007处理数据, 进行差异显著性分析, 所得结果以平均值±标准误差表示。使用Graph pad Prism 8.0作图。
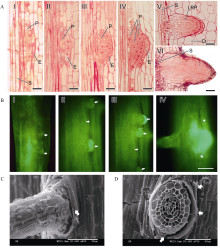
2.1.1 侧根原基的建成 图1-A是扬稻6号种子根的纵切面图, 展示了侧根形态建成的过程。I, 中柱鞘细胞的细胞质变浓, 染色性增强, 液泡化程度减小, 细胞分裂能力恢复。随着细胞体积增大, 先进行垂周分裂, 形成上下排列的2个细胞, 即PFCs; 与之相邻的内皮层细胞也发生区别于其他部位内皮层细胞的变化, 细胞核体积增大, 细胞质变浓, 染色性增强。II, 中柱鞘细胞发生平周和垂周分裂, 形成两层细胞; 内皮层细胞也发生垂周分裂, 形成覆盖在中柱鞘细胞外的一层细胞。III, 形成3层细胞的侧根原基后, 由中柱鞘细胞形成的组织经平周分裂而向外侧生长膨大, 相邻的内皮层细胞随之向外凸出。IV, 侧根原基向各个方向分裂, 细胞数目明显增多, 且细胞核染色较深, 占细胞体积增大, 原基向外凸起成锥形; 内皮层细胞不再分裂, 锥形顶端的细胞核消失。值得注意的是, 由中柱鞘起源的原基和内皮层之间的界限较明显, 细胞壁结构染色较深。而且中柱鞘原基的细胞连结紧密, 内皮层细胞仍保持单层, 未进行平周分裂。V, 形成细胞带状紧密排列的侧根原基, 开始出现径向上由顶端到基部的细胞分化, 各部位的细胞结构发生不同的变化。顶端的少数细胞体积较小, 连接紧密, 在最顶端部位形成类似主根的静止中心的结构, 向外分裂形成冠状细胞层, 向内分裂增加细胞层数。基部细胞体积膨胀, 通过细胞的径向增粗而不断向外层推进; 内含物消失或减少, 连结变得疏松, 与母根的中柱连结。此时, 原基顶端的内皮层细胞内含物减少, 与其他的内皮层细胞分离, 边缘细胞收缩变形并紧贴在原基外侧呈冠状, 使整个原基的尖端变成易于突破外围组织的流线型形态。VI, 侧根原基露出母体的表皮, 形成真正意义上的侧根, 具有与初生根结构类似的根冠和静止中心, 内皮层形成的外部结构消失; 侧根基部与母根维管束相连, 最外层细胞体积明显较大。
2.1.2 侧根原基突破表皮 侧根原基由内向外生长, 突破皮层、外皮层和表皮, 形成新的侧根, 这一过程会改变母根的结构。图1-B显示在荧光显微镜下观察到的侧根突破表皮前后的形态。当侧根原基接近表皮, 使表皮向外隆起, 但表皮仍完整(图1-B-I)。原基向外的机械挤压和推力最先使表皮出现一条竖直的裂隙, 且随着侧根长出, 撑开的空隙增大(图1-B-II, III), 在侧根的上下方形成三角形的空隙(图1-B-IV)。扫描电镜观察显示, 侧根长出表皮后, 表皮被侧根沿裂隙向四周撑开, 裂隙边缘的母根表皮变薄, 卷曲翘离, 附着在侧根的周围, 其他部位的表皮完好, 结构紧密。除表皮外, 母根外皮层和皮层也被侧根向周围冲开, 与侧根的表皮间形成间隙, 破损部位组织整层翻出(图1-C, D)。
2.2.1 切除芽或根尖对侧根发育的影响 当切除
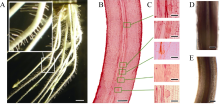
芽后48 h, 平均根长小于对照组, 生长量比对照组小2 cm; 初生根上长出的可见一级侧根数比对照组平均少50.66条, 一级侧根上发出的二级侧根数目也小于对照组。当切除根尖后48 h, 原有切口上方仍可生出新根, 但主根失去顶端优势, 侧根生长被促进, 一级侧根的长度远大于对照组, 且二级侧根的发生被促进, 数目是对照组的4倍左右(图2)。
2.2.2 单侧光照对侧根发生的影响 单侧光照处理使稻根发生负向光性生长, 与此同时, 在负向光性弯曲部位的向光侧, 侧根发生被促进(图3-A)。从弯曲部位的半薄切片观察, 可见向光侧的细胞长度大于背光侧, 而且皮层细胞局部萎缩, 空隙也多于背光侧。图3-B和C显示向光侧的纵切面上侧根原基数有5个, 而背光侧无侧根原基。因此认为光照对侧根的发生具有诱导作用。
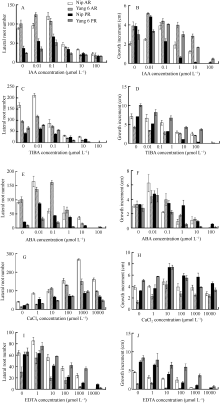
NBT染色结果显示, 未经光照处理的水稻根尖中柱鞘两侧的较多(图3-E)。2.2.3 生长调节物质对稻根发育的影响 IAA处理下的侧根数随IAA浓度升高呈单峰曲线变化, 其中扬稻6号AR的侧根数在0.01 µmol L-1时达到最大, 其他3种根在0.1 µmol L-1时达到最大, 之后均呈下降趋势, 当浓度超过1 µmol L-1后, 露出表皮的可见侧根数减少。根生长量随IAA浓度升高的变化趋势与侧根数的变化类同, 其中扬稻6号AR和日本晴PR的根生长量在0.01 µmol L-1时最大, 日本晴 AR和扬稻6号PR在0.1 µmol L-1时生长量最大, 之后均逐渐下降。浓度为100 µmol L-1的IAA几乎完全抑制了根的生长, 根趋于死亡, 侧根数极少。然而, 观察100 µmol L-1生长素处理后的水稻不定根结构, 呈均等分布(图3-D), 且主要分布在分生区、伸长区近中柱鞘的皮层细胞处; 单侧照光后向光侧染色较深, 说明该部位的
2.2.4 Ca2+和EDTA对侧根发育的影响 Ca2+和EDTA浓度梯度处理下4种根的变化趋势较一致。Ca2+对侧根发生具有促进作用, 促进效果在浓度为 1 mmol L-1时最大。1 µmol L-1的EDTA对侧根发生有促进作用, 高浓度的EDTA则抑制侧根发生。Ca2+浓度梯度影响下根的生长量变化呈单峰曲线, 浓度为10 µmol L-1时生长量最大(图4-G, H)。EDTA对根的生长起抑制作用, 与对照相比均呈下降趋势, 且扬稻6号不定根的反应最为敏感, 10 µmol L-1时即完全抑制了生长(图4-I, J)。
侧根发生的起始位置受到精密调控, 目前研究较为深入的是以生长素为基础的调节机制, 即高浓度的生长素刺激特定的中柱鞘细胞, 使之成为PFCs, 并驱使细胞极化, 使两个相邻PFCs不均等分裂, 最终发育成侧根[ 11]。Casero等[ 12]认为, PFCs中的高浓度生长素使其与周围细胞之间形成一个新的浓度梯度, 并且一直持续到侧根原基发育之后的其他所有阶段, 对维持成功的发育模式和新侧根突破表皮和继续生长起着关键作用。PFCs具有典型的分生组织细胞特性, 其浓稠的细胞质中可能含有很多高电子密度的核糖体[ 13]。
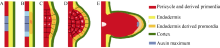
我们研究认为: (1)在PFCs中具有生长素峰值(图5-A), 受高浓度生长素的刺激, 正对着PFCs的相邻内皮层细胞中细胞内含物增加, 细胞质变得浓稠, 细胞核体积明显增大(图5-B)。(2) PFCs和内皮层细胞各自分裂(图5-C, D), 形成由中柱鞘发育而来的侧根原基和由内皮层细胞分裂而来的外层原基凸起。其中内皮层细胞形成的外层凸起为PFCs的分裂提供了可塑性空间和保护。(3)随着中柱鞘原基的细胞多次垂周和平周分裂, 侧根原基体积增大, 内皮层原基与其他内皮层细胞分离, 呈冠状附着在原基顶端, 并最终由于侧根原基向外生长时与外层组织的相互作用而磨损、分解消失; 在中柱鞘原基的基部形成与中柱相连结的输导组织, 在顶端形成生长点(图5-E), 形成完整的侧根原基。
侧根发生是“内起源”模式, 侧根原基需要突破多重外围组织, 才能露出母根表皮成为真正意义上的侧根, 其机制受到了广泛关注[ 11, 14]。拟南芥根结构简单, 中柱鞘外只有内皮层、皮层和表皮共3层细胞包裹。与之相比, 水稻根具有多层皮层细胞, 表层还有独特的厚壁组织, 中柱鞘外围有多达15层左右的细胞, 因而侧根的露出过程更加复杂。
水稻侧根原基向外生长是通过顶端生长点的分裂分化和基部细胞伸长共同完成的。侧根突破表皮是一个与其母根组织相互协调作用的过程。首先, 侧根原基顶端呈锥形, 切面边缘呈流线型, 这种形态减小了侧根原基向外突出的阻力, 同时增大了对外围组织的压强。其次, 母根组织的细胞在纵向上成条状排列, 且条与条之间的细胞在径向的各层间缺少胞间连丝等联络, 而且侧根长出的位置处于母根成熟区, 这里的细胞大部分内含物减少, 胞外连结疏松, 易于被侧根原基突破。再次, 侧根原基细胞合成与细胞壁改造相关的酶类分解邻近的外围细胞, 进而形成了突出的通道[ 11]。另外, 由于水稻根系在大部分生长期都处在淹水环境下, 因而进化出强大的通气组织, 使得母根成熟区皮层细胞大量衰亡, 出现较大的间隙或空腔, 这是利于侧根露出表皮的独特优势。
水稻根系的发达和健壮程度对植株的正常发育和产量形成至关重要, 反之地上部也直接影响着根系的发育, 因此侧根的发育也同地上部密切相关。由于侧根只有露出表皮后才能自身合成生长素, 所以在侧根露出表皮的过程中起作用的生长素是来源于地上部的茎和芽[ 14, 15]。芽是合成生长素的重要源, 去芽后侧根数大量减少, 说明生长素是促进侧根发生的重要因素, 有报道指出, 生长素在侧根发生的建成细胞选择、侧根原基的发育和侧根分生组织的激活等阶段中都起关键作用[ 15, 16, 17, 18]。外施一定浓度的生长素能刺激中柱鞘细胞的分裂, 侧根原基大量发生; 但生长素浓度过高则抑制侧根的发生, 推测是中柱鞘和表皮之间的由高到低的正常浓度梯度被削弱, 侧根突破表皮的调控信号被打乱, 从而干扰了侧根的露出。切除根尖试验证明, 水稻的初生根和不定根具有明显的顶端优势。Aloni等[ 19]认为除生长素外, 细胞分裂素(cytokinin, CK)也参与了根尖顶端优势的形成; 同时, 多数研究结果证明CK负调控侧根的发生[ 7, 19, 20, 21]。ABA既可以通过抑制部分侧根起始基因的表达和侧根分生组织的活化等负调控侧根发生[ 22], 又可以缓解干旱胁迫对拟南芥侧根发育的抑制, 因此被认为具有在胁迫和非胁迫条件下分别作为生长抑制剂和生长促进剂的双重功能[ 23]。然而我们试验指出低浓度ABA (0.01 µmol L-1)既能促进侧根的发生, 又能促进根的伸长生长, 其原因和机制还有待进一步研究阐明。此外, 油菜素内酯(BR)和乙烯(ethylene)也对侧根形成起到一定的调控作用[ 24, 25, 26, 27]。
作为第二信使, Ca2+几乎参与所有植物细胞对激素及光、温度、机械刺激等环境因素的响应过程[ 28]。Ca2+促进侧根的发生, 浓度大于1 mmol L-1时促进效果开始下降; 10 µmol L-1时对根伸长生长的促进最为明显。可能是外界相对较高浓度的Ca2+有利于生长素诱导侧根形成的信号转导过程, 而浓度过低时与细胞内的浓度相似, 促进效应不明显。浓度持续升高后促进效果下降, 可能因其产生了毒害作用。Ca2+螯合剂EDTA对侧根的发生和根的伸长生长起抑制作用, 则应该是抑制了钙信号传导的缘故。
随着水稻根负向光性的发现[ 29, 30], 以及抛秧立苗技术的研究和推广[ 31, 32, 33], 光照对稻根发育的影响逐渐受到重视。近年来的研究表明, 质膜产生的活性氧(reactive oxygen species, ROS)对植物生长发育和信号转导, 尤其是细胞的生长具有重要作用[ 34, 35, 36], 正在生长的植物组织, 特别是在生长活跃区, 如玉米幼苗胚芽鞘或根尖生长区都有ROS产生[ 37, 38]。单侧照光后向光侧
水稻侧根的发生起始于中柱鞘, 邻近PFCs的内皮层细胞参与侧根原基的形成和侧根露出过程。侧根通过原基顶端生长点的分裂分化和基部细胞伸长向外生长, 锥形原基向外的机械挤压和细胞生长推力是侧根露出表皮的原动力。水稻母根组织纵向上条状排列以及成熟区发达的通气组织等结构特点使侧根容易露出。侧根露出使母根皮层和表皮撕裂并向外展开, 对母根结构产生不可逆的改变。外源生长素可促进侧根的发生, 但浓度过高则会抑制侧根原基的露出; 侧根发生和露出所需的生长素来源于茎芽, 切除茎芽使侧根数减少, 生长量下降。切除根尖打破了主根的顶端优势, 侧根加快伸长生长, 解除了对二级侧根发生的抑制。照光诱导向光侧的侧根发生增多; 脱落酸在低浓度下对侧根发生有促进作用, 整体趋势呈单峰曲线; Ca2+促进侧根发生和根的生长, EDTA主要起抑制作用。水稻种子根和不定根的侧根发生对试验处理的响应趋势基本一致。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|