为了探讨ATP合酶α亚基和腺嘌呤磷酸核糖基转移酶(APRT)与温敏雄性不育系BNS育性的联系, 利用荧光实时定量PCR方法, 在花药发育的4个重要时期(四分体期、单核期、二核期和三核期), 定量检测ATP合酶α亚基和
BNS male sterile line is a temperature-sensitive type in wheat. This study aimed at disclosing the role of ATPase α submit and the adenine phosphoribosyl transferase (APRT) in BNS male sterility. At four key stages of pollen development, the differential expressions of ATPase α submit gene and
高等植物雄性不育性在农作物杂种优势利用上具有广阔的应用前景, 其中光温敏雄性不育两系法已成为小麦杂种优势利用的重要途径之一。近年来我国发现的ES、C49S、BS、YS和最新发现的BNS等优良光温敏雄性不育系中有些组合已应用到生产, 加强对温光敏雄性不育系的研究, 对小麦杂种优势的利用具有重要的意义。BNS不育系是由一个对温度敏感的自然突变体BNY-S改良而成的新型生态不育系[ 1, 2], 在我国湖南、河北、陕西以及黄淮麦区表现不育性好、遗传稳定、育性转换容易等特点, 且该不育系抗低温能力强, 早熟, 丰产性好, 应用潜力很大[ 3, 4, 5]。
光温敏雄性不育是一种遗传上比较特殊的不育类型, 其不育基因的表达依赖于一定的光照或(和)温度条件, 同一基因型种子通过播期调节, 可发育成不育和可育2种类型, 使其成为研究育性相关基因的理想材料。Xing等[ 1]通过克隆BNY-S温敏雄性不育系的cDNA, 得到与其育性相关的 TaAPT2基因。Guo等[ 6]利用BSA法和SSR标记技术分析不育系337S/华麦8构建的F2群体, 获得2个主效基因 wptms1/5B和 wptms2/2B。周琳璘等[ 7]研究认为, YS型雄性不育系A3017是由 MADS-box转录因子控制, 表达量高时表现不育, 表达量低时表现可育。对小麦雄性不育系育性相关基因的研究, 不仅会对其杂种优势利用产生促进作用, 而且还对揭示植物发育和生殖调控机制具有重要意义。
三磷酸腺苷(ATP)是能量储存、运输和供应的主要载体。ATP合酶是ATP合成的重要组织者, 是高等植物体内最大的酶系之一。腺嘌呤磷酸核糖基转移酶(APRT)是ATP嘌呤补救途径中催化底物腺嘌呤碱基和磷酸核糖焦磷酸(PRPP)转化为一磷酸腺苷酸(AMP)的关键酶。研究发现, 植物雄性不育与能量代谢失衡有一定相关。姚雅琴等[ 8]利用电镜细胞化学标记技术分析K型小麦雄性不育系和其保持系花药组织中的ATP酶活性, 发现不育系在二核期花粉粒质膜上的ATP酶活性增加不明显。韩艳芬等[ 9]采用克隆测序与PCR产物直接测序方法, 发现黏类小麦细胞质雄性不育与线粒体 atp6基因转录本保守区的编辑有一定的相关性。Xing等[ 1]通过分析温敏不育小麦BNY-S中 APRT的变化, 发现BNY-S育性转换与 APRT基因相关。李友勇等[ 10]研究发现, ATP合酶α和β亚基相关蛋白质在BNS中表达异常, 并推测其可能是BNS不育的源头蛋白, 为了进一步验证和探讨这种联系, 本研究以ATP合酶α亚基与ATP嘌呤补救合成途径中的腺嘌呤磷酸核糖基转移酶(APRT)相关基因为目的基因, 利用荧光实时定量PCR技术, 检测该基因在BNS不育和可育条件下花粉发育的关键时期mRNA表达特性, 在基因表达水平上探讨ATP合成与小麦雄性不育发生的关系。
2012年秋将BNS不育系(由河南科技学院提供)播种于西北农林科技大学北校区实验田, 根据BNS的育性转换规律[ 2, 3, 4, 5], 分10月1日和11月1日两期播种, 在花粉发育的四分体至三核期, 分别取BNS的花药样品用于基因表达分析。10月1日播种的BNS表现完全不育, 植株花粉败育率在99%以上, 自交结实率为0; 11月1日播种的BNS表现可育, 可育花粉达50%以上, 套袋自交结实率达30%~70%。
于取样日8:00左右, 根据植株外部形态选取花粉处于不同发育时期的幼穗[ 11], 3次重复。材料经镜检确认小孢子发育时期准确一致后, 采用I2-KI染色法判断所取花药的花粉活力。在15℃以下环境, 于冰块上剥取样穗中上部小穗第1和第2小花的6枚花药, 液氮冷冻1 min, -80℃冰箱保存备用。
利用MiniBEST Universal RNA Extraction Kit试剂盒(TaKaRa)提取总RNA, 在1.5%琼脂糖凝胶上电泳检测其完整性, 同时用紫外分光光度仪测定吸光值, 分析其纯度。采用PrimeScript RT reagent Kit (TaKaRa)反转录试剂盒, 按操作说明利用随机引物反转录合成cDNA链, -40℃保存备用。
根据NCBI数据库(http://www.ncbi.nlm.nih.gov/)所公布的ATP合酶α亚基(AT2G07698)序列信息设计特异引物(表1), 按张建奎等[ 12]报道的引物序列, 扩增 APRT1(U22442)和 APRT2(AY255503)基因, 以 β-Actin为内参基因。所有引物均由生工生物工程(上海)有限公司合成。
| 表1 本研究设计的特异引物序列及其退火温度( Tm) Table 1 Sequences and annealing temperature ( Tm) of specific primers designed in this study |
扩增体系25 μL, 包括正、反向特异引物各1 μL, cDNA模板2.5 μL, SYBR Premix ExTaq II (Tli RNaseH Plus) (2×) 12.5 μL。扩增程序为95℃预变性30 s; 95℃变性5 s, 退火30 s, 40个循环。反应结束后升温至95℃, 然后按0.5℃ s-1缓慢降温至55℃, 持续读取荧光信号获得熔解曲线。
以可育条件下四分体时期为对照, 设其基因表达量为1, 采用2-∆∆Ct方法[ 13]计算不育条件下各时期的相对表达量。用SPSS16.0软件作数据one-way ANOVA, 用Duncan’s法作显著性比较。
以小麦 β-Actin为内参基因校正cDNA的拷贝数, 由熔解曲线(图1)可知 β-Actin熔解温度为85.5℃, ATP合酶α亚基基因、 APRT1和 APRT2的熔解温度分别为79.5、86.0和73.0℃, 并根据熔解确定最佳退火温度(表1); 然后对引物与模板的比例、荧光信号读取时间作出优化, 以减少杂峰的出现, 提高PCR产物的纯度。调整后使3个重复间的 Ct值差异控制在1以内, 4个基因的熔解曲线均为单一峰, 说明引物特异性良好, 干扰成分少。
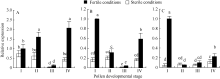
2.2.1 ATP合酶α亚基基因的表达差异 在不育条件下ATP合酶α亚基基因mRNA表达量在前3个发育时期持续下降, 四分体至单核期缓慢下降, 二核期显著下降, 四分体时期为4个时期表达量的最高时段(图2-A)。在对照可育条件下, 单核期表达量高于四分体和二核期, 二核期和三核期分别为4个时期表达量的最低和最高阶段。ATP合酶α亚基基因mRNA 在BNS不育条件下4个时期的表达量均低于相应可育条件下的表达量, 由此推断ATP合酶α亚基基因的下调表达与BNS花粉败育有关。BNS不育条件和可育条件下的ATP合酶α亚基基因表达量在单核期出现显著差异, 而在四分体时期和二核期差异不显著, 说明单核期是BNS育性转换的关键时期。在三核期ATP合酶α亚基基因表达量同样出现显著差异, 可育株的基因表达量比不育株高大约4倍, 此结果证明花药发育后期 ATP 含量与育性密切相关。
2.2.2 APRT1和 APRT2的表达差异 在不育条件下 APRT1 mRNA表达量4个时期呈现波动的趋势, 2次波峰出现在单核、三核期, 单核期表达量最高, 二核期表达量最低, 且四分体、单核和三核期差异不显著(图2-B)。对照可育条件下 APRT1表达量在前3个发育时期持续下降, 三核期表达量有显著提升, 说明三核期 APRT1基因表达量与BNS育性密切相关。仅可育条件下的单核期与不育条件下四分体、单核、三核期表达量差异不显著, 且 APRT1基因在BNS可育条件下4个时期的表达量高于相应不育条件下。
APRT2基因在BNS不育条件和可育条件下总体维持较低的表达水平, 不育条件下四分体、单核和二核期表达差异不显著, 四分体时期表达量最低, 三核期表达量最高, 二核与三核期表达差异显著; 三核期比二核期表达量提升2.23倍。可育条件下单核期相对表达量达到最低值, 单核、二核期表达差异不显著, 仅在三核期存在较显著的表达上调, 提升2.26倍(图2-C)。可育条件下的单核、二核期同不育条件下的四分体、单核、二核期 APRT2基因相对表达量差异不显著。与 APRT1基因相比, APRT2基因在BNS四分体、单核、三核期表达量都弱于 APRT1基因。比对 APRT1和 APRT2基因表达趋势后可知, 除对照时期外, 仅在三核期2个基因的表达量出现显著差异, 且可育比不育条件下提升更明显。
植物体旺盛的能量代谢是正常生命活动的保证, ATP是细胞内各种物质合成的直接能源。多种作物的花粉败育研究表明, 花药中ATP含量与育性密切相关, 可育株的ATP含量比不育株高数倍, 而且影响ATP分解反应和转换速率的ATP酶活性也以可育株比不育株强[ 8]。宋国琦等[ 14]在小麦YS雄性不育A3017中分离出ATP合酶α亚基基因, 另外, 对水稻红莲型和小麦黏性雄性不育的研究发现, ATP相关基因不同编辑方式导致雄性不育[ 9, 15]。这些研究证据表明, ATP合酶基因变异或表达异常与不育相关。ATP合酶α亚基是ATP合成酶F1F0结构的重要组成部分, 本试验中, 与BNS可育条件下表达结果比较, 不育条件下的ATP合酶α亚基基因在前3个时期表达持续下降, 单核期相对表达量有显著差异, 说明ATP合酶α亚基基因表达量与BNS育性转换密切正相关, 尤其在单核期这种关系更为明显, 这与苏晴[ 16]的观察结果一致。在三核期ATP合酶α亚基可育株的基因表达量比不育株升高大约4倍, 说明花药发育后期 ATP 含量与花粉育性紧密相关。
在生物体内, ATP的合成主要依赖于2条途径, 即从头合成途径和嘌呤补救途径。其中嘌呤补救途径有2个基本路线, 即腺嘌呤直接转化为一磷酸腺苷酸(一步法); 腺嘌呤先转化为腺苷酸, 再进行磷酸化。腺嘌呤磷酸核糖基转移酶(APRT)是一步法中催化底物腺嘌呤碱基和磷酸核糖焦磷酸(PRPP)转化为一磷酸腺苷酸(AMP)的关键酶。Xing等[ 1]研究表明, 温敏核不育小麦BNY-S育性转换初期的幼穗中 APRT2基因转录产物的丰度较不育处理前显著降低, 其他器官则没有明显变化, 且BNY-S的 APRT2基因SNP位点中一个碱基A换成C, 导致 APRT酶二级结构在螺旋、延伸链和环的位置和数量上许多变化, 可能影响 APRT 酶对腺嘌呤和 PRPP的结合效率。本研究结果显示, 温敏核不育小麦BNS在不育条件下, 四分体期至三核期的 APRT1基因的转录水平比可育条件下低, 表明其育性转换与幼穗中 APRT1基因转录水平有一定关系。在植物体中, APRT 基因以多基因家族的形式存在。Southern分析表明, 在大麦基因组中至少有2个基因编码 APRT[ 17], 在小麦中也已报道了2条基因编码 APRT[ 1]。拟南芥中的 APRT2基因比 APRT1具有更高的细胞分裂素亲和力, 但是在植物中表达强度弱于 APRT1[ 12], 后者结论与本试验结果相同, 但这种现象出现的原因还需进一步研究。
在BNS不育和可育条件下 APRT基因相对表达量水平较ATP合酶α亚基基因低, 但在三核期 APRT基因相对表达量均有较显著提高, 且可育条件下比不育条件下提升更明显, 即使是4个时期都维持较低表达水平的 APRT2基因, 在三核期表达量也分别提升了2.23倍和2.26倍。原因可能是ATP 合酶亚基操纵子上游有温度感应子, 在BNS中, 该温度感应子是隐性突变, 突变后对转录活化温度感应的阈值提高了, 因此在较低的温度下, 感应子不活化, 操纵子控制下的ATP合酶亚基基因表达量减少或不表达[ 10], 导致ATP从头合成途径无法进行。此时ATP合成的嘌呤补救途径将部分替代从头合成途径, 以保证花粉育性相关物质的顺利合成, 从而表现出 APRT基因的表达上调。与从头合成途径相比, APRT能更节能有效地直接利用细胞中的代谢产物腺嘌呤合成AMP, 进一步转化为ATP, 因此, 鉴于APRT在维持细胞内ATP平衡中的作用, APRT基因的表达水平也极可能通过能量代谢途径的变化而与植物雄性不育相关, 即BNS花粉中嘌呤补救途径的强弱将决定其育性的转换程度。此种机制外在表现为在完全不育条件下, 不育系花药内还有少量小孢子具有育性; 在完全可育条件下, 可育株的花粉也不能够全部转为可育[ 18, 19]。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|