为探明稻根负向光性与内源植物激素含量的关系, 以及外源激素对水稻根系生长的影响, 以扬稻6号(籼稻)、日本晴(粳稻)和中花11 (粳稻)的
The objective of this research was to investigate the relationship between rice roots negative phototropism and endogenous plant hormone levels, as well as the impact of exogenous hormones on rice root growth. The adventitious roots and primary roots of conventional cultivars Yangdao 6 (
水稻是世界上最重要的粮食作物之一[ 1], 水稻根系是植株吸收运输水分和肥料的主要器官, 还能合成多种活性物质, 并且起到固定植株的作用。植物各器官的生长发育受植物激素的调节, 各种激素维持在适宜的浓度范围[ 2], 以保持地上部和地下部发育的协调。水稻根系的生长和活力的激素调节, 对地上部的生长发育和产量形成起着重要作用。
本实验室最先提出和报道了水稻根“负向光性”现象, 并开展了相关研究, 指出稻根负向光性受到多种激素和环境因子的影响[ 3, 4, 5]。大量实验表明, 生长素IAA (indole-3-acetic acid)是影响植物向光性运动的核心激素, 光照诱导生长素横向运输, 使器官中两侧生长素不均等分布, 引发不对称生长而弯曲[ 6, 7, 8, 9]。赤霉素(gibberellins, GAs)与光信号响应也密切相关, 共同调控多种关键的和部分重叠的植物发育过程[ 10, 11, 12]。我们认为光照可看作是稻根生长的一种胁迫信号, 使植物激素能从合成部位快速转运到效应器, 在极低浓度下产生生理效应[ 2, 13], 而生长素、赤霉素和脱落酸这3类激素即是植物在胁迫条件下维持生长的关键因子[ 14], 其中脱落酸(abscisic acid, ABA)被认为是一种最为直接的应激响应激素[ 15, 16]。因此, 研究以上3种激素在稻根负向光性和生长过程中的作用具有重要意义。
本研究对比了籼稻和粳稻根负向光性生长的过程, 测定了光照前后根尖中内源IAA、GA3和ABA的含量变化, 观察了外施激素对稻根生长的影响, 重点研究了外施ABA对水稻根系形态和解剖结构的影响, 旨在进一步解释稻根负向光性的机制, 阐述植物激素与根系形态建成的关系。
水稻( Oryza sativa L.)品种粳稻日本晴(Nippon-bare)、籼稻扬稻6号, 种植于扬州大学试验田中。在水稻旺盛生长的7、8月份, 选取健壮的稻株, 洗净泥土并剪去所有根系, 在暗中水培, 使其新生不定根。另外, 在30℃恒温室中遮光水培以上2个品种和粳稻中花11 (Zhonghua 11)及其组成型表达 OsPIN1a转基因水稻(由绍兴文理学院生命科学学院的莫亿伟副教授提供, 简写为OsPIN1a), 取其种子根备用。植物激素标准品GA3、IAA和ABA购于北京Sigma- Aldrich公司。乙腈、甲醇均为色谱纯, 购自美国天地公司(Tedia Companic Inc., Fairfield, USA)。甲酸为分析纯; 水为二次蒸馏纯净水。
1.2.1 稻根的形态和解剖结构观察 将处理后的稻株固定在水中使侧根分散, 用数码相机拍摄高分辨率照片, 观察稻根形态。采用树脂半薄切片[ 17]及1%番红染色, 在光镜下观察与拍摄稻根显微结构。固定后的样品经丙酮脱水, 乙酸异戊酯过渡, CO2临界点干燥, 离子溅射镀金制样后在Philips XL-30型扫描电子显微镜下观察根表面结构。
1.2.2 稻根负向光性观测 选取根长势一致的稻株, 在透明玻璃缸中水培, 采用直射式白色光源从右侧照光, 稻根受光强度为100 μmol m-2。用电脑控制数码相机定时定点拍摄稻根负向光性生长的状态。
1.2.3 内源植物激素的提取 水培扬稻6号和日本晴粗壮大田苗不定根备用。设置黑暗对照和单侧光照处理, 照光4 h后根明显弯曲, 在体视显微镜下以垂直于入射光的方向沿中柱将根尖迅速切分为向光侧和背光侧两部分。分别称取对照、照光、向光侧和背光侧4组材料各1 g放入液氮中速冻, 研磨成粉末, 加预冷的80%甲醇溶液(内含1.0 mmol L-1 2,6-二叔丁基-4-甲基苯酚, BHT) 200 μL, 4℃低温避光浸提12 h, 4℃ 15 284× g离心15 min, 取上清液; 再用80%冷却甲醇200 μL浸提残渣2次, 每次12 h, 4℃ 15 284× g离心15 min, 合并3次上清液。将样品过C-18固相萃取柱, 以80%甲醇洗脱收集, 冷阱干燥后用流动相溶解并定容至1 mL。过0.45 μm滤膜, 用高效液相色谱分析每个样品2次, 取平均值。整个提取过程在弱光下进行, 防止激素见光分解。
1.2.4 激素含量测定 采用高效液相色谱法(HPLC), Dubhe C18柱型号规格为4.6 × 250 mm, 5 μm; 流动相A为5% (v/v)乙腈, 流动相B为50% (v/v)甲醇, 流动相C为0.6% (v/v)冰乙酸, 流速0.8 mL min-1, 梯度洗脱程序为0~10 min, 100% C; 10~30 min, 5% A, 50% B, 45% C。检测波长254 nm; 柱温40℃, 进样体积 20 μL, 每一个样品重复2次, 外标法定量。图1为3种植物激素标准溶液的色谱图。根据标准样品峰值计算出激素含量, GA3的线性方程为 y= 0.0005 x + 1.3792, R2 = 0.9943; IAA的线性方程为 y =3E-05 x + 0.6681, R² =0.9932; ABA的线性方程为 y =9E-06 x + 0.5674 , R² =0.9948。激素含量单位为ng g-1 FW。
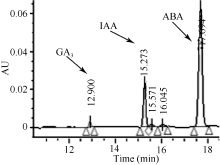 | 图1 3种植物激素标准品的高效液相色谱图Fig. 1 Chromatogram of standard samples of three plant hormones by high performance liquid chromatography |
1.2.5 稻根外源激素的处理 选取根长势一致的稻株, 采用水培法对根进行外源IAA、GA3、ABA等处理。IAA处理浓度分别为0、0.1、1、10、100和1000 µmol L-1; GA3和ABA的处理浓度分别为0、0.01、0.1、1、10和100 µmol L-1。
1.2.6 数据分析 利用WinRhizo Tron 2007软件获取扫描图片, 分析根长、直径、根尖数和表面积等根系参数; 利用Image J软件测量弯曲角度和生长量, 对侧根计数。每组数据3次独立重复。用Microsoft Excel 2007分析数据差异显著性, 所得结果以平均值±标准误差表示, 使用GraphPad Prism 8.0作图。
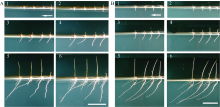
以扬稻6号和日本晴为代表对比籼稻和粳稻种子根负向光性的特征。图2可见, 两者都有负向光生长特性, 照光1 h根尖即开始背光弯曲(图2-A-2, B-2); 扬稻6号的初生根和不定根弯曲角度都大于日本晴。
以单侧光照和黑暗组材料为双对照, 高效液相色谱分析结果(图3)表明, 光照处理对扬稻6号和日本晴根尖中3种内源激素含量变化的影响趋势是一致的, 光照和向光侧的激素含量分别低于黑暗组和背光侧。2个品种的照光组IAA含量均低于黑暗组, 向光侧的IAA含量均低于背光侧, 差异显著。2个品种的照光组GA3含量均低于黑暗组; 在发生负向光性弯曲的根尖部位, 向光侧的GA3含量均显著低于背光侧。光照组ABA含量低于黑暗组, 向光侧ABA含量低于背光侧, 但含量差异不显著。
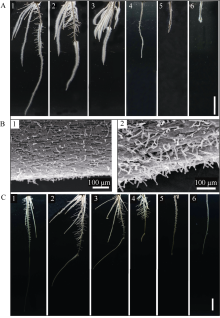
图4-A显示, 在结合单侧光照的试验浓度范围内, 随着外源IAA浓度的增加, 扬稻6号根的生长被抑制, 根负向光性随之消失; 在0.1~1.0 µmol L-1的浓度下初生根和次生根的根毛发生却被促进。处理72 h后, 生长素浓度为0的对照组, 主根生长量和侧根分布范围最大; 0.1 µmol L-1处理的主根尖端根毛发生被促进, 密度增大, 侧根分布范围减小; 1 µmol L-1处理的新生长部分和不定根尖端2~5 cm都有密集的根毛, 侧根仅分布在主根基部1 cm的范围内; 10 µmol L-1处理的主根生长受到抑制, 无不定根和根毛发生, 侧根数量减少; 100 µmol L-1处理的根生长受到明显抑制, 无根毛发生, 根直径增大; 1000 µmol L-1处理的根停止生长, 根尖膨大有分支侧根(图4-A-6)。扫描电镜下可见, IAA处理前长出的那部分根的根毛发生较少, 且根毛长度小; 经IAA处理后长出的部分根毛大量发生, 长度明显增大(图4-B)。
水稻生长素输出载体基因 OsPIN1a在植株各部分均有表达, 因而过表达 OsPIN1a的植株中生长素输出载体量增加。试验发现, 相同的处理条件下OsPIN1a植株的初生根和不定根的根毛发生都不明显, 但同扬稻6号相比侧根发生的范围和数量更大, 侧根生长被促进, 侧根长度明显增大; 高浓度IAA处理下, 仍有较多侧根发生(图4-C)。另外, OsPIN1a植株的最大负向光性弯曲角度大于扬稻6号, 对IAA浓度的耐受性更强, 1 µmol L-1的浓度仍促进弯曲, 角度达到最大。各处理浓度下, OsPIN1a植株的侧根发生数量均大于扬稻6号, 1 µmol L-1的IAA对侧根发生有促进作用, 随着浓度继续增大, 侧根发生被抑制(图5)。
外源GA3对扬稻6号和日本晴稻根的负向光性弯曲和生长的影响趋势基本一致。0~1 μmol L-1的浓度范围内, 负向光性弯曲角度和根的生长量均无显著差异。当浓度达到10 μmol L-1时, 根的弯曲角度减小, 但同时生长也显著受到抑制(表1)。据此推测, 10 μmol L-1的GA3之所以抑制根的弯曲, 很大程度上是由于根的生长受到明显抑制。外源GA3与稻根的负向光性反应之间不具有明显的相关性。
| 表1 GA3对水稻根负向光性和生长的影响 Table 1 Impact of GA3 to the negative phototropism and growth of rice root system |
与对照组相比, 随着ABA浓度的增大, 稻根负向光弯曲角度呈下降趋势, 但在0~1 μmol L-1的范围内无显著差异; 1~100 μmol L-1浓度范围内, 弯曲角度下降, 且较对照组呈显著或极显著差异, 但该下降是与稻根的生长量显著下降相关的。这说明受到超出生长耐受范围的ABA胁迫后, 稻根生长受到抑制, 负向光性弯曲随之减小(表2)。因此推测, 外源ABA处理对稻根的负向光性无直接影响。
| 表2 ABA对水稻根负向光性和生长的影响 Table 2 Impact of ABA to the negative phototropism and growth of rice root system |
ABA抑制扬稻6号根的生长。直径在0.2~5.0 mm的根长、根系总长、所有分支根数和根系表面积等指标均随着ABA浓度的增加而抑制程度增大, 处理组各项指标与对照组均有显著或极显著差异(表3)。
| 表3 ABA对水稻根系的影响 Table 3 Impact of ABA to the development of rice root system |
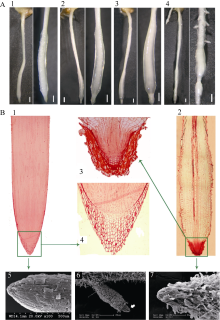
10 µmol L-1 ABA处理可以诱导扬稻6号种子根尖形成特殊形态结构。处理24 h后根尖端1~2 mm呈乳突状, 根尖以上0.1~1.0 cm的部分明显膨大, 体视显微镜下可以观察到表皮的大量根毛发生(图6-A-1); 处理后2~4 d, 膨胀部位与根尖之间出现较明显分界, 膨胀继续增大且呈透明状(图6-A-2, 3); 处理后7 d, 膨胀部位外层细胞凋亡, 出现分段皱缩, 其上方区域侧根发生数增加, 且侧根也呈现出同主根一样的膨胀形态特征(图6-A-4)。通过树脂半薄切片观察发现, 造成根膨胀的原因是细胞体积变大和径向细胞间隙增大, 而不是细胞数量的增加。与对照的根尖相比, 处理后的根尖根冠细胞层数较少, 分生区和伸长区细胞密集压缩在很小的范围内, 而且从该部分起便开始形成明显的中柱结构; 膨胀部位的细胞特征类似于接近衰亡的成熟区细胞, 体积增大、内含物消失、形状不规则, 且内外层之间有巨大径向间隙, 表皮结构不规则; 膨胀部位以上的根径恢复正常, 细胞体积有所减小, 但皮层细胞的层数与对照相比明显减少(图6-B-1~4)。扫描电镜观察表明, 对照组根尖表皮完整, 结构紧密, 根尖饱满弧度大(图6-B-5); 而处理后的根尖表皮开裂, 主根和侧根根尖顶端凸起都更尖锐, 与其后膨胀部位差异明显(图6-B-6, 7)。
水稻根的负向光性是发现较晚的植物向光性反应类型, 本质上也是由光受体接受光信号后诱导向光侧和背光侧生长素横向不均匀分布, 引起器官受光侧和背光侧生长速率不同而弯曲生长[ 9, 18]。水稻根负向光性与研究较深入的胚芽鞘向光性相比, 区别在于胚芽鞘在单侧光诱导下背光侧的生长速率加快而表现出向光弯曲, 而稻根在单侧光照下向光侧生长速率加快而表现为背光弯曲。因此稻根负向光性的机制一定程度上可以已有的向光性研究结论作为参考[ 9], 但同时又具有其特殊机制。
本研究表明, 单侧光照后根尖中的IAA总含量显著低于黑暗对照, 说明照光使部分IAA被降解; IAA浓度在向光侧和背光侧的差异也与莫亿伟等[ 4]的结论一致。我们推测, 由于根对IAA的敏感程度大于芽和茎, 因此当背光侧积累的IAA浓度可能超出促进生长的范围后, 便会抑制该侧的生长速率, 而另一侧的根自发地通过增大生长速率来补偿, 从而实现生长和发育的一致[ 9]。
我们认为单侧光照后向光侧IAA的含量显著低于背光侧的原因有两方面。一方面, 是光照引发了部分IAA降解。研究表明, 持续照光会使拟南芥体内游离态的IAA含量下降[ 19], 或转变成其他形式的化合物[ 20]。因此光照引起的生长素不均匀分布不仅源于生长素的运输, 还包括其合成、代谢以及信号互作网络的多种调控。另一方面, 是IAA发生了从向光侧到背光侧的横向运输。Sakai等[ 21]研究拟南芥胚芽鞘的向光性时发现, 单侧蓝光照射首先引起由胚芽鞘尖端向下的生长素运输, 随之引起生长抑制; 伸长区上方区域生长素的横向转移形成向光侧和背光侧的生长素浓度差异继续向下移动到伸长区, 伴随着弯曲生长的实现。虽然生长素极性运输抑制剂可以中断根的向光性反应, 但是生长素的不对称分布的机制很大程度上还是模糊的, 究竟有哪些生长素运输载体参与了实际的横向运输目前还不清楚[ 9]。
正常情况下籼稻的根负向光性略强于粳稻, 但我们发现组成型表达生长素输出载体合成基因 OsPIN1a的粳稻植株负向光性弯曲的角度明显大于扬稻6号, 这可能是生长素输出载体的表达量增加所致。
GA是一种重要的植物激素, 已知其调控种子萌发、伸长生长、向重性反应和开花时间等多种植物发育过程中的核心响应事件。研究表明, GA信号通路也与光信号传导和作用途径有密切联系。DELLA蛋白是GA信号传导的阻遏物, 主要通过抑制基因表达来阻止GA诱导植物生长发育过程[ 10, 11, 12], 同时也是多种转录调节因子的阻遏物, 其中包括能与光敏色素发生作用的PHYTOCHROME INTERA CTING FACTOR家族[ 22]; 另有报道显示光通过降低GA的水平来促进DELLA蛋白的积累[ 23]。反之, GA也可以诱导DELLA蛋白的降解[ 24]。拟南芥DELLA蛋白缺失单突变体表现出轻微的向光性和向重性弯曲角度的减小, 外施GA合成的抑制剂不仅引起野生型向重性的增强, 还对光受体 phyA cry1 cry2三重缺失突变体植株的向光性恢复有促进作用[ 25, 26], 因此GA信号可认为是抑制向光性反应的因子。
本试验中, GA3含量变化和巨大差异是超出我们预期的。光照后根尖GA3含量低于黑暗对照, 向光侧的GA3含量低于背光侧, 这应该是由光受体接受光信号后调节的结果。然而外源GA3处理对稻根负向光性的影响并不明显, 可见, GA3在植物体内的作用机制和外施作用机制有可能是不同的。这一内外的作用差异, 值得进一步探讨。
我们发现单侧光照后根尖ABA的含量比对照略有下降, 向光侧的ABA含量略低于背光侧, 但变化并不明显; 外施ABA对负向光性的影响也不明显, 高浓度下ABA对负向光弯曲角度的抑制, 应该是其抑制根正常生长的连带结果。值得思考的是, 水稻根在自然条件下生长在土壤中, 强光照射有可能对根系造成胁迫, 而ABA主要参与对环境胁迫的响应, 调控植物的生长过程[ 27], 且胁迫诱导的ABA在调控根系生长方面起着重要作用[ 28, 29], 因此可以从ABA的抗逆方面来考虑其与负向光性两者之间可能的关系。
有趣的是, 用10 µmol L-1的ABA处理扬稻6号的种子根, 会使伸长区细胞长度减小, 造成根长减小, 成熟区部位形成明显可见的膨胀, 细胞加快成熟和衰亡, 这在某种程度上与Chen等[ 30]报道的现象有相类似的地方。我们同时还观察到处理后侧根和根毛发生增加, 维管柱的发育被促进, 形成了导管分子和管胞。这些解剖结构特征说明ABA根据环境刺激直接或者间接地传递信号至细胞内, 从而改变细胞的命运, 发生特殊的形变以增强根系吸收和输导能力, 适应生长环境的改变。
需要注意的是, IAA被认为是激素网络互作的主导者[ 31]。GA和IAA的信号途径之间存在多种互作, IAA可以诱导多类GA合成基因的转录[ 32], GA也会促进IAA的运输[ 33]; 外施GA合成抑制剂多效唑(paclobutrazol, PAC)还可以使IAA的含量降低, ABA含量升高[ 34]; ABA和IAA控制的根系发育信号途径之间可能存在着相互联系[ 35]。ABA的积累可以调控生长素在根尖的运输, 这提高了质子分泌从而得以维持初生根的伸长和根毛发育[ 36, 37]。因此, 在水稻根发生负向光性过程中, 3种激素相互之间存在复杂的关系, 要厘清其发生作用的机制和照光前后的含量变化原因, 还需要进行更加深入的研究。
以扬稻6号和日本晴为代表的籼稻和粳稻都具有根的负向光性, 且前者的负向光性强于后者。两种材料中内源激素的含量变化对光照响应的趋势是相似的, 单侧光照引起3种激素的含量下降; 向光侧的含量低于背光侧。单侧光照和外施IAA共同促进了籼稻根毛的大量发生; 与普通水稻相比, OsPIN1a超表达稻株的根负向光性更强, 对外源IAA浓度的耐受性更高。外源GA3和ABA对扬稻6号和日本晴根的影响趋势基本一致, 与负向光性无直接关系。外施ABA抑制根系发育, 使单株根系总吸收表面积与根数和根长均明显下降。10 µmol L-1 ABA处理的根尖分生区和根冠发育不良, 伸长区细胞长度减小, 成熟区细胞变形使根局部膨胀, 维管柱的发育被促进。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|