碱性亮氨酸拉链蛋白(bZIP)作为真核生物中分布最广、最保守的一类转录因子, 参与多种生物学过程, 尤其在植物抵御各种逆境胁迫中有重要作用。采用RACE和RT-PCR技术克隆到茶树bZIP转录因子基因全长cDNA序列, 命名为
The basic leucine zipper proteins (bZIP) are one of the most extensive and conserved transcriptional factors families in eukaryotes, and plant bZIPs play important roles in many biological processes, especialy for resisting abiotic stresses. In this study, a bZIP full-length cDNA sequence was cloned using RACE and reverse transcription-PCR(RT-PCR) techniques from tea plant (
茶树( Camellia sinensis)原产于热带及亚热带, 是一种喜温畏寒的经济作物。茶树生长和茶叶生产受低温、干旱等环境条件的制约, 发掘茶树抗性基因, 培育抗性较强的茶树品种有重大意义。转录因子(transcription factors, TFs)在植物响应逆境胁迫中具有重要的作用。它能够激活或者抑制下游基因的转录, 使植物适应或抵御外界环境的变化。近年来, AP2/EREBP、MYB、NAC、WRKY和bZIP等转录因子在植物逆境响应中被广泛研究[ 1]。其中, bZIP是真核生物中分布最广、最保守的一类转录因子[ 2], 与植物抵御多种逆境胁迫密切相关, 但在茶树上还没有相关研究报道。因此, 克隆茶树bZIP转录因子基因, 分析其不同逆境胁迫下的表达特性, 为茶树抗性机制研究与抗性育种提供理论基础有重要意义。
bZIP转录因子(basic region/leucine zipper proetin), 由一个与DNA结合的碱性结构域和一个亮氨酸拉链二聚体组成, 是转录因子中最大家族之一[ 2]。植物bZIP蛋白主要专一结合核心序列为ACGT回文结构的顺式作用元件, 如A-box (TACGTA)、C-box (GACGTC)和G-box (CACGTG)等元件[ 3]。目前已经在拟南芥[ 4]、水稻[ 5]和豆科植物[ 6]等基因组中发现大量的bZIP家族基因。它们参与多种生物学过程, 包括光信号传导、花的发育、种子成熟、病菌防御以及各种非生物胁迫的响应等[ 4, 7, 8, 9, 10]。近年来, 已从玉米[ 11]、番茄[ 12]、高粱[ 13]、胡椒[ 14]、苎麻[ 15]等植物中克隆到逆境相关的bZIP转录因子, 并证实它们与植物抗性密切相关。Wang等[ 16]在烟草中过表达刚毛柽柳( Tamarix hispida) ThbZIP1, 能显著提高转基因烟草的耐盐性。Chen等[ 17]在水稻中克隆到一个 OsbZIP16, 进一步研究显示 OsbZIP16能正调控水稻抗旱性, 并且转基因水稻的抗寒性显著增强。Liao等[ 8]在拟南芥中过表达水稻bZIP转录因子基因 GmbZIP44、 GmbZIP46、 GmbZIP62和 GmbZIP78, 结果显示转基因植株的耐盐性和抗寒性都得到提高。
前期, 本课题组进行了茶树冷驯化转录组测序, 从中获得了一批受低温诱导差异表达的bZIP转录因子的EST片段[ 18]。本研究通过RACE技术, 克隆茶树 bZIP基因的cDNA全长, 并对其进行生物信息学分析和亚细胞定位, 以实时荧光定量PCR分析其在低温、ABA和高盐胁迫处理下的表达模式, 探究bZIP转录因子与茶树抗逆性的关系, 为茶树抗逆基因工程提供候选基因资源和理论依据。
所用的茶树品种为特早生国家级茶树品种龙井43, 种植于中国农业科学院茶叶研究所国家种质杭州茶树圃。参照已报道的茶树胁迫处理[ 19, 20, 21]及本实验室前期试验结果[ 22], 从日光温室中选取生长正常且长势相近的3年生盆栽茶树若干盆, 分别在低温(4℃)、ABA (100 μmol L-1)和NaCl (250 mmol L-1)胁迫下试验。
SMART RACE cDNA Amplication Kit和Advantage Polymerase Mix购于Clontech公司(Mountain View, CA, USA); SYBR Premix Ex Taq II (Perfect Real Time)、DNA Marker、TA Cloning Kit PCR2.1 Vector、大肠杆菌DH5α感受态细胞和 Taq聚合酶为TaKaRa公司产品(大连); DNase I Digestion of RNA Preparation、First-Strand cDNA Synthesis购自Invitrogen公司(Carlsbad, USA); 琼脂糖凝胶回收试剂盒购自Axygen公司(California, USA); RNA提取试剂盒购自天根公司(Tiangen, 北京)。脱落酸(ABA)购于SIGMA公司, NaCl、无水乙醇等为国产分析纯试剂。由上海华津生物技术公司合成引物并测序。
参照离心柱型植物总RNA快速提取试剂盒说明书提取茶树叶片总RNA。检测RNA浓度和完整性后于-80℃保存备用。用1 μg总RNA为模板, 参照SMART RACE cDNA Synthesis Kit的操作步骤合成5′和3′的cDNA, 用于RACE扩增, 以及反转录PCR (RT-PCR)扩增基因的全长开放阅读框(ORF)和亚细胞定位载体构建的PCR扩增; 以5 μg总RNA为模板, 按照DNase I Digestion of RNA Preparation和First-Strand cDNA Synthesis试剂盒说明书合成cDNA, 稀释40倍后作实时荧光定量PCR (qRT-PCR)模板, 进行qRT-PCR检测。
1.3.1 茶树 CsbZIP1基因的克隆 根据本实验室茶树冷驯化转录组测序结果(NCBI登录号为SRA061043), 经Blast比对筛选出与其他植物中报道的 bZIP基因高度同源的EST序列, 设计5′和3′-RACE特异引物5′GSP/3′GSP (表1)。参照SMART RACE cDNA Synthesis Kit的操作步骤进行茶树 bZIP基因的PCR反应, 反应条件为94℃预变性4 min; 94℃变性30 s, 68℃退火30 s, 72℃延伸2 min, 30个循环; 72℃延伸10 min。产物经1%琼脂糖凝胶电泳检测, 将目的条带回收纯化, 连接到PCR2.1载体, 转化大肠杆菌DH5α, 蓝白斑筛选阳性菌落, 挑取10个白色单菌落进行菌落PCR检测, 挑选3~4个阳性菌落送上海华津生物公司测序。经去载体、拼接, 得到茶树 bZIP基因的5′和3′端序列, 与中间序列拼接, 得到 bZIP基因的全长cDNA序列。在ORF上、下游区域设计RT-PCR特异引物RT-F/RT-R (表1), 以PCR扩增验证ORF序列。反应条件为94℃ 4 min; 94℃ 30 s, 58℃ 30 s, 72℃ 1 min, 35个循环。PCR产物经回收、连接、转化、测序和拼接后, 获得完整的茶树 bZIP基因全长cDNA序列。
| 表1 试验引物及其序列 Table 1 Sequence of primers in this study |
1.3.2 CsbZIP1生物信息学分析 利用NCBI的BlastX和BlastP进行核苷酸和氨基酸序列比对分析; 用DNAStar 软件查询开放阅读框; 用ProtParam预测蛋白质分子量和理论等电点; 用SMART (http://smart.embl-heidelberg.de/)进行保守域分析; 用DNAMAN进行多序列氨基酸比对; 用MEGA5.0软件中的邻近相连法构建系统进化树; 用NetPhos 2.0 Serve (http://www.cbs.dtu.dk/services/NetPhos/)预测蛋白质磷酸化位点; 用SWISS-MODEL (http://swissmodel.expasy.org/workspace/)和PyMol软件预测蛋白质三级结构; 用WoLF PSORT (http://wolfpsort.org/)进行亚细胞定位预测。
1.4.1 载体的构建 以CsbZIP1-GFP-F/CsbZIP1-GFP- R为引物, 扩增 CsbZIP1基因, 纯化扩增产物, 用 Kpn I和 Xho I酶切, 回收酶切产物; 再用 Kpn I和 Xho I对P2GWF7质粒进行酶切反应; 最后, 把酶切回收的PCR产物和质粒酶切片段连接, 构建载体p2GWF7-CsbZIP1, 转入DH5α, 菌液PCR、酶切筛选阳性克隆, 并对阳性克隆进行测序验证。
1.4.2 P2GWF7-CsbZIP1转化洋葱表皮细胞 取 50 mg mL-1金粉悬液50 μL于离心管, 依次加入5 μL质粒DNA (1 μg μL-1), 50 μL CaCl2(2.5 mol L-1)和20 μL亚精胺(0.1 mol L-1)(每加完一样可振荡3 s), 静置10 min; 然后振荡1 min, 冰上10 min, 9400× g离心10 s, 弃上清; 再用80 μL无水乙醇, 洗涤沉淀一次; 重新悬浮沉淀于10 μL无水乙醇中; 每次用10 μL滴于微粒载膜中央, 平铺, 晾至完全干燥, 待用。取新鲜洋葱, 用无菌刀片切取肉质较厚的3~4层鳞茎, 用镊子撕出表皮平铺于MS培养基上, 25℃预培养4 h。选用1100 psi的压力膜, 将10 μL金粉DNA混合物滴在压力膜中央, 将洋葱表皮放在琼脂糖培养基上, 采用PDS1000/He型基因枪(Bio-Rad)轰击。将轰击后的洋葱表皮细胞25℃暗培养16 h后制片, 于激光共聚焦显微镜下观察并照相。
以茶树 18S基因作为内参基因, 参照SYBR Premix Ex Taq II (Perfect real-time)的操作说明书对 CsbZIP1基因的表达进行荧光定量PCR分析, PCR体系为SYBR Premix Ex Taq25 μL、10 μmol L-1上下游引物各1 μL、ROX Dye II 1 μL、cDNA 2 μL, 加水至终体积50 μL。反应在ABI PRISM 7500实时定量PCR仪上进行, 程序为95℃ 15 s, 94℃ 5 s, 60℃ 34 s, 40个循环。反应结束后分析荧光值变化曲线和熔解曲线, 采用2-ΔΔCT法分析结果[ 23], 每个样品3次重复。
2.1.1 CsbZIP1全长cDNA克隆与序列分析 根据中间EST片段序列, 设计5′和3′-RACE特异引物, 分别扩增出928 bp和410 bp的序列(图1), 用SeqMan软件把3段序列拼接初步得到cDNA全长, 再查找其开放阅读框(ORF), BlastX比对其ORF, 在ORF上下游设计引物进行RT-PCR扩增验证, 扩增得到813 bp的序列(图1)。最终获得该基因cDNA全长序列1515 bp, 包含813 bp的完整ORF, 编码270个氨基酸, 理论等电点为7.175, 推测分子量29.484 kD。NCBI比对分析结果表明, 它含有bZIP家族典型的BRLZ结构域, 属于B-zip1家族; 与可可( Theobroma cacao) EOX97663.1、大豆( Glycine max) NP-001235033.1的氨基酸相似性分别为68%和66%。CsbZIP1蛋白与其他植物bZIP氨基酸序列进行多序列比对表明, 在N端具有保守的bZIP碱性结构域和亮氨酸拉链(图2)。对CsbZIP1氨基酸序列分析, 显示氨基酸序列
 | 图1 CsbZIP1的RACE及RT-PCR电泳结果Fig. 1 Electrophoresis results of RACE fragments and RT-PCR fragments of CsbZIP1 |
第95~127位为典型的bZIP碱性结构域和亮氨酸拉链结构域(图3)。因此, 该基因属于bZIP转录因子家族, 并命名为 CsbZIP1 (GenBank登录号为JX050148.1)。
2.1.2 CsbZIP1蛋白与拟南芥bZIP蛋白的系统进化树分析 根据Jakoby等[ 4]对拟南芥bZIP亚家族的分类, 从每个亚家族挑选取2~3个拟南芥 bZIP基因, 采用MEGA 5.0邻近相连法对CsbZIP1与21个拟南芥bZIP氨基酸序列比对, 并构建系统进化树(图4), 结果显示CsbZIP1与拟南芥Group F聚为一类, 从理论上推测CsbZIP1属于bZIP转录因子的F亚家族。
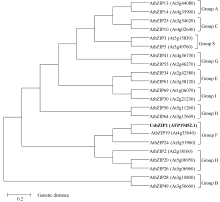 | 图4 CsbZIP1蛋白与21个拟南芥bZIP转录因子蛋白的进化树分析Fig. 4 Phylogenetic tree analysis of CsbZIP1 protein with 21 Arabidopsis bZIP proteins |
2.1.3 CsbZIP1编码蛋白的磷酸化位点预测 用NetPhos 2.0 Serve预测CsbZIP1蛋白磷酸化位点(图5)表明, 含有丝氨酸(Serine)、苏氨酸(Threonine)和酪氨酸(Tyrosine)的多个磷酸化位点中以丝氨酸位点最多, 有13个, 苏氨酸和酪氨酸位点各1个。由此推测磷酸化作用可能与CsbZIP1蛋白的活性调控有关。
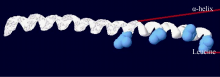
2.1.4 CsbZIP1编码蛋白的三级结构预测 用SWISS- MODEL预测CsbZIP1蛋白的三级结构, 经过PyMol软件模拟分析, 得到CsbZIP1蛋白的三维结构图(图6)。结果显示与Jakoby等[ 4]获得的拟南芥bZIP蛋白的三级结构模型图相似, 均含有bZIP转录因子典型的α-螺旋和亮氨酸拉链结构, 进一步证实获得的 CsbZIP1属于bZIP转录因子家族。
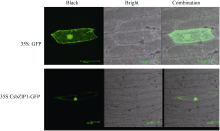
用WoLF PSORT软件进行亚细胞定位预测显示, CsbZIP1主要定位在细胞核内。洋葱表皮亚细胞定位试验的结果也显示CsbZIP1融合蛋白位主要定位于细胞核内(图7), 但是细胞内其他部位也检测到微弱信号。bZIP定位在细胞核内与它的功能密切相关。
荧光定量PCR结果表明(图8), 4℃低温处理能够诱导 CsbZIP1的表达, 且随着处理时间的延长, 表达量在处理 8 h最大, 达到11.59, 24 h降低为6.72。100 μmol L-1ABA 处理后 CsbZIP1的表达被抑制, 2 h的相对表达量最低只有0.2, 但随着胁迫的继续, 表达量逐渐上升, 在24 h时表达量升高到0.90, 但没有超过0 h的表达量。250 mmol L-1NaCl处理后, CsbZIP1的表达量呈先升高后降低的趋势, 处理4 h表达被诱导, 表达量达3.86, 随着处理时间延长至24 h, 表达量降低为1.21。 CsbZIP1在低温、高盐和ABA胁迫下均响应, 低温能够显著诱导其表达, NaCl短时间内也能上调其表达, ABA则能迅速抑制其表达。
bZIP作为一类重要的转录因子, 与植物逆境胁迫响应密切相关, 但在茶树上鲜见报道。本研究通过RACE和RT-PCR技术克隆获得茶树中的一个 bZIP基因, 它与其他植物bZIP具有较高的同源性, 序列分析表明含有bZIP转录因子家族典型的碱性结构域和亮氨酸拉链结构(氨基酸序列第95~127位), 属于B-zip1家族, 命名为 CsbZIP1。CsbZIP1蛋白与拟南芥不同亚家族bZIP蛋白的系统发育树分析显示其与F亚家族聚为一类。目前, 植物中关于F亚家族和B亚家族的研究报道较少, 但其他亚家族在ABA、逆境胁迫、种子发育、抗氧化、光信号转导、光合作用以及糖信号转导等方面发挥重要作用[ 4, 13, 24]; 磷酸化
位点预测结果表明CsbZIP1蛋白含有多个磷酸化位点, 可能与bZIP蛋白的活性调控有关。磷酸化和去磷酸化是ABA信号通路中的关键步骤, 低温、干旱和高盐等逆境胁迫能够刺激植物体内ABA含量增加, 从而激活SnRK2蛋白激酶, 将bZIP转录因子的保守域磷酸化, 从而使bZIP蛋白活化, 再通过与顺式作用元件结合调控基因表达, 以此来增强植物的抗逆性[ 3, 25, 26]。蛋白质三级结构预测显示, CsbZIP1蛋白具有高度保守的由α-螺旋和亮氨酸形成的bZIP结构域, 与报道的拟南芥AtbZIP蛋白的三级结构模型相似。
亚细胞定位预测显示CsbZIP1蛋白最可能定位于细胞核, 另外还可能定位在叶绿体、质体和胞液。为了进一步验证CsbZIP1定位在核内, 通过洋葱表皮亚细胞定位试验分析了它的亚细胞定位。试验结果与预测结果相近, CsbZIP1蛋白主要定位在细胞核, 同时在细胞的其他部位也能够检测到微弱信号。这与其他植物bZIP转录因子的亚细胞定位研究报道相一致[ 11, 14, 27]。
已有研究表明, bZIP转录因子在非生物胁迫, 如干旱、低温、高盐等中参与调控基因表达[ 2, 9, 13]。本研究用qRT-PCR分析 CsbZIP1在ABA、低温和盐胁迫下的表达模式。依据前人[ 19, 20, 21]报道的茶树胁迫处理结果及本实验室前期[ 22]的研究结果, 分别选用浓度100 μmol L-1和250 mmol L-1的ABA和NaCl处理茶树。低温是限制茶树生长的最重要影响因子之一, 但植物响应低温胁迫与ABA信号途径可能密切相关, 为了分析 CsbZIP1在低温和ABA处理后的表达模式变化, 我们选取在处理后0、2、8和24 h的样品试验。为了分析NaCl处理在短时内对表达的影响, 我们分析了处理后4 h的表达, 通过与0 h和24 h时的表达比较, 明确 CsbZIP1在短时(4 h)内的表达模式。结果表明, CsbZIP1对低温和ABA处理的响应模式不尽相同, ABA处理2 h表达被迅速抑制, 从2~24 h的过程中, 表达逐渐恢复到处理前的水平; 低温处理2 h则诱导其表达, 且在处理的24 h内表达均是上调的。说明在低温和ABA处理后, 短时内(2 h)调控作用相反, 但在2~24 h过程中能够诱导 CsbZIP1表达, 与处理前相比, 低温下的表达上调更显著, 表明 CsbZIP1在低温胁迫响应过程中起着重要作用。盐胁迫下, 4 h时的表达被显著上调, 24 h的表达比4 h低, 但仍比处理前0 h的表达量高, 推测在处理24 h内表达上调。Zou等[ 28]研究水稻 bZIP基因表明, 250 mmol L-1 NaCl处理24 h内的表达量是上调的, 且5 h的表达量最高。说明NaCl处理对 bZIP基因的诱导可能在4~5 h内就能够达到最大, 这为以后深入研究其在抗盐胁迫中的功能提供了参考。
大量的研究结果表明, 不同的 bZIP基因在逆境胁迫中的表达模式不尽相同。Liao等[ 8]将大豆 GmbZIP 44、 GmbZIP 46、 GmbZIP 62和 GmbZIP 784个基因转到拟南芥中过表达, 发现这4个基因均能增强对高盐和低温逆境的抗性, 而 GmbZIP 44、 GmbZIP 62和 GmbZIP 78的过表达能减弱ABA的敏感性, 表明这3个基因有可能通过上调 ABI1和 ABI2基因的表达来参与ABA信号途径, 对ABA、盐和低温逆境起负调控作用。Zou等[ 28]对水稻bZIP转录因子基因 OsABI5的表达研究表明, 4℃低温处理24 h后, 前5 h的表达量是下调的, 10 h后表达量逐渐上调。Orellana等[ 29]分离的番茄bZIP转录因子基因 SIAREB1同时受ABA和NaCl胁迫诱导, 100 μmol L-1 ABA处理24 h后, SIAREB1在叶片和根中的表达量是上升的; 300 mmol L-1 NaCl处理72 h后, 叶片和根中的表达量都是在6 h最大, 其后表达量降低。Ying等[ 11]克隆的玉米 ZmbZIP72基因的表达结果显示, NaCl胁迫(200 mmol L-1)处理24 h后, 表达量是增加的, 且在24 h表达量最大; 而4℃低温处理24 h后, 表达量变化不大。Gao等[ 6]研究大豆 GmbZIP1在不同逆境胁迫下的表达结果表明, 4℃低温处理24 h后, GmbZIP1的表达量是逐渐升高的, 24 h的表达量最大, 与本试验4℃低温表达模式相似。另外, Schlögl等[ 30]对甘蔗bZIP转录因子基因研究发现, 在100 μmol L-1 ABA处理12 h后, ScbZIP29和 ScbZIP31的表达量是上调的, 而 ScbZIP24的表达量是下调的, 这与本试验的ABA表达模式是相似的。可见, bZIP基因在ABA信号途径中可能起正调控作用, 也可能是负调控作用。 CsbZIP1可能还参与其他生物学功能, Cheng等[ 31]认为F亚家族的bZIP转录因子可能参与植物的光形态建成, 茶树bZIP的功能及其他家族基因有待后续发掘。但是, 从表达结果来看, CsbZIP1极有可能与茶树低温、盐、ABA胁迫等方面有密切关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|