第一作者联系方式: E-mail:13553158892@126.com
NAC转录因子在植物应答非生物胁迫中起重要作用。利用生物信息学分析推测花生栽培种转录因子基因 AhNAC4(登录号为HM776131.1)属于抗旱相关转录因子基因, 对比栽培品种山花11号 AhNAC4的2条cDNA序列( ShrNAC4-a和 ShrNAC4-b)及其相应的DNA序列( ShNAC4-a和 ShNAC4-b)表明, AhNAC4全长为1244 bp, 编码区长度为1050 bp, 含有2个内含子, 分别位于182~279 bp和547~642 bp处, 编码蛋白包含349个氨基酸。从抗旱性不同的32个栽培品种分离得到4类 AhNAC4, 分别命名为 AhNAC4-a1、AhNAC4-a2、AhNAC4-b1和 AhNAC4-b2, 缩写为 a1、a2、b1和 b2。 a1和 a2为等位基因, 二者在717 bp处存在1个碱基差异, 引起第174位氨基酸的改变, b1和 b2为等位基因, 二者存在14个SNP位点, 其中717 bp和924 bp处碱基的差异引起第174位和第244位氨基酸的改变。供试品种中基因型为 a1a1b1b1、 a1a1b2b2、a2a2b1b1、a2a2b2b2的品种数分别为10、5、15和2。从19个野生种中分离得到11类 NAC4的DNA序列( Aw1NAC4- Aw11NAC4), Aw1NAC4与栽培种 b1、b2的核苷酸序列同源性最高, Aw2NAC4与栽培种 a1、a2核苷酸序列同源性最高。推测栽培种 a1基因编码蛋白对花生抵御干旱起关键作用, a1和 b1基因编码蛋白的功能与野生种更接近。
NAC transcription factors play an important role in response to abiotic stress of plant. In this paper, bioinformatic analysis indicated that transcription factor gene AhNAC4(accession number HM776131.1) can response to drought signal. The comparison of cDNAs ( ShrNAC4-a and ShrNAC4-b) and genomic DNAs ( ShNAC4-a and ShNAC4-b) from Shanhua 11 showed that AhNAC4 has a full length of 1244 bp and an ORF of 1050 bp, containing two introns at 182-279 bp and 547-642 bp, and encoding 349 amino acids. Four kinds of AhNAC4 genes, named as AhNAC4-a1, AhNAC4-a2, AhNAC4-b1, and AhNAC4-b2(abbreviations: a1, a2, b1, and b2), were cloned from 32 cultivars with different drought resistances. Among them a1 and a2 were alleles, with only one locus different between the two genes, leading to the difference of corresponding amino acids at site 174; b1 and b2 were alleles, with 14 SNPs, of which two SNPs led to differences of the corresponding amino acids at sites 174 and 244. There were four genotypes of AhNAC4 in the 32 cultivars, containing 10 a1a1b1b1, 5 a1a1b2b2, 15 a2a2b1b1, and 2 a2a2b2b2. Meanwhile, 11 NAC4 genes ( Aw1NAC4- Aw11NAC4) were isolated from 19 wild peanut accessions in Arachis. Aw2NAC4 had the highest homology of nucleotide sequence with a1 or a2, and b1 or b2 had the highest homology of nucleotide sequence with Aw1NAC4. It is speculated that the protein encoding a1 plays a key role in responding drought stress, and the function of the proteins encoding a1 and b1 genes is closer with that of wild species.
最早在矮牵牛(Pharbifis nil) NAM、拟南芥(Arabidopsis thaliana) ATAF1/2和CUC2的N端发现一段高度保守的氨基酸序列, 命名为NAC结构域, 并将包含NAC结构域的蛋白称为NAC转录因子[1]。NAC转录因子是植物特有的转录调控因子, 是最大的转录因子家族之一[2]。NAC转录因子显著结构特点是, N端含有约150个氨基酸组成的高度保守的NAC结构域, C端有高度多样性的转录激活区[2, 3]。NAC转录因子不仅参与植物器官发育[3, 4]、次生壁的形成[5]、细胞周期的调控[6], 而且在植物抗逆境胁迫中具有重要的调控作用[7, 8]。Tran等[9]从拟南芥中分离到3个受干旱、高盐和ABA诱导表达的NAC基因(AtNAC019、AtNAC055和AtNAC072), 在3个基因的转基因植株中皆超量表达, 并显著增强拟南芥抗旱性。水稻中已分离的受干旱胁迫诱导表达的NAC转录因子基因有OsNAC6[10]、ONAC045[11]和OsNAC52[12]和SNAC1[13], Hu等[13]研究表明, 过量表达SNAC1基因促进转基因水稻叶片气孔关闭, 减少水分丧失速率, 增强抗旱能力, 结实率提高22%~34%。刘美英等[14]分离得到小麦NAC转录因子的基因TaNAC, 干旱诱导24 h, TaNAC基因转录水平表达量显著升高, 过量表达TaNAC的转基因烟草在模拟干旱胁迫处理下, 抗旱性明显高于非转基因烟草。因此, NAC转录因子在植物应答干旱胁迫中起着重要作用。
在花生中已分离的NAC基因包括AhNAC1[15]、AhNAC2和AhNAC3[16]以及AhNAC4(HM776131.1)。AhNAC1基因属于ATAF亚族, 与大豆GmNAC2[17]氨基酸序列一致性为78%, 过量表达GmNAC2的转基因烟草中活性氧清除系统基因的表达受抑制, 降低
了其对非生物胁迫的耐性。在ABA诱导、控水和低温条件下, AhNAC2和AhNAC3在花生组织中的表达均上调, 二者表达模式不同。AhNAC2属于AtNAC3亚族, 可被ABA高效诱导表达, 通过调节气孔大小来抵御干旱胁迫[18]; AhNAC3不能明显地被ABA诱导, 可以通过增强SOD活性减少活性氧的积累来抵御干旱胁迫, 推测其调控一种特殊的路径[19]。2012年, Liu等在GenBank中注册了AhNAC4的全长cDNA序列, 其在花生中功能尚未见报道。本研究利用生物信息学分析推测花生NAC4的功能和核苷酸序列及其编码蛋白氨基酸序列的差异, 揭示栽培品种及其与二倍体野生种间基因的等位变异, 为深入研究不同核苷酸序列AhNAC4基因的功能和花生抗旱育种提供参考。
包括32个栽培品种和19个花生属二倍体野生种(表1)。栽培品种分为三类[20, 21, 22], 抗旱性强的包括濮花28号、莱宾大豆、NC6、山花17号、花育31、鲁花8号、远杂9102、徐州68-4、山花12号、冀0212-4、山花13号、山花9号、鲁花14、阜花10号、豫花15、桂花1026、山花11号; 抗旱性中等的包括潍花10号、02P175、锦花14、湘花2008、山花8号、鲁花12、花育17、湛油41、开农49、79266; 抗旱性弱的包括吉花4号、锦花10号、桂花836、阜花12号、白沙1016。栽培品种由山东农业大学花生研究所提供, 野生种由中国农业科学院油料作物研究所姜慧芳研究员提供。
| 表1 供试的19个野生花生材料 Table 1 Nineteen germplasm accessions of diploid wild peanut for the experiment |
TIANgel胶回收试剂盒和植物总RNA提取试剂盒, 购自天根生化科技有限公司。pEASY-T1 Vector、大肠杆菌菌株DH5α 、EasyScript First-Strand cDNA Synthesis Kit, 购自北京全式金生物技术有限公司。其他试剂均为进口或国产分析纯。引物由上海生物工程有限公司合成, 测序工作由北京六合华大基因科技有限公司完成。
选取栽培品种山花11号大小一致的种子沙盒种植, 用Hoaglangd’ s溶液培养至幼苗主茎3个幼叶完全展开, 以15% PEG-6000溶液(用Hoaglangd’ s溶液配制)胁迫处理, 在处理后2 h时取幼叶, 液氮速冻, -80℃保存, 用于总RNA的提取。
以栽培种和野生种幼叶为材料, 用CTAB法提取总DNA。参照植物总RNA提取试剂盒说明书提取山花11号幼叶总RNA, 以RNA为模板、Oligo(dT)为引物, 按照EasyScript First-Strand cDNA Synthesis Kit描述的方法, 合成cDNA第1链。
参考AhNAC4的cDNA序列(GenBank登录号为HM776131.1)设计引物, 上游引物F: 5° -ATGGGAAT TCAAGAGAAAGACC-3° ; 下游引物R: 5° -TTCCTC ACCCTGGTTCATT-3° ; 以花生栽培品种山花11号总RNA经反转录生成的cDNA第1链为模板, 用引物F和R扩增AhNAC4的cDNA序列。分别以32个栽培品种和19个野生种基因组DNA为模板, 用引物F和R扩增花生NAC4的DNA序列。PCR程序为94℃ 5 min; 94℃ 30 s, 56℃ 30 s, 72℃ 1.5 min, 35个循环; 72℃ 7 min。
PCR扩增产物经1.0%琼脂糖凝胶电泳后, 按照DNA胶回收试剂盒说明书进行胶回收, 再与pEASY-T1克隆载体连接, 转化至大肠杆菌DH5α 中进行抗卡那霉素筛选。挑选白色单菌落, PCR检测鉴定后送北京六合华大基因科技有限公司测序, 从每个栽培品种选6~10个克隆, 野生种选3~5个。
利用NCBI(http://ncbi.nlm.ncih.gov/)和DNAMAN软件分析核苷酸序列及其推导的氨基酸序列同源性; 用(http://blast.jcvi.org/euk-blast/plantta_ blast.cgi)搜索拟南芥的NAC序列; 采用MEGA5.0软件的Neighbor- Joining算法构建系统进化树, 行BootStrap检验, 并重复1000次。以ProtParam (http://expasy.org/tools/ protparam.html)检验氨基酸基本理化性质; NCBI CDD数据库(Conserved Domain Databases)比对蛋白质保守结构域; TMHMM (http://www.cbs.dtu.dk/ services/TMHMM/)预测蛋白跨膜结构; PSORT (http://psort.hgc.jp/form.html)预测蛋白质的亚细胞位置。
AhNAC4蛋白理论分子量为39.13 kD, 等电点pI为7.66, 含有典型的NAC保守结构域, 无跨膜区域, 定位于过氧化物酶体。
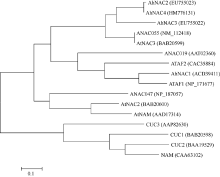
比较分析花生NAC4与已知功能的14个NAC的氨基酸序列(图1), 发现其与拟南芥及花生已知的3个转录因子NAC的5个保守结构域序列一致性较高。系统进化树分析(图2)表明, 花生NAC4与花生NAC2遗传距离最接近, 同属于AtNAC3亚族。
 | 图1 AhNAC4与其他NAC蛋白保守结构域对比Fig. 1 Comparison of NAC domain alignments between AhNAC4 and some other NAC proteins |
用引物F和R对山花11号的cDNA进行PCR扩增, 琼脂糖凝胶电泳检测获得约1.1 kb的特异性条带, 经克隆、测序获得AhNAC4的2条cDNA序列, 分别命名为ShrNAC4-1和ShrNAC4-2。
以32个栽培品种和19个野生种(表1)的DNA为模板进行PCR扩增, 获得约1.3 kb的片段, 经克隆、测序检测, 每个栽培品种得到2条不同的DNA序列, 依据核苷酸序列差异分为4类(图3); 每个野生种得到NAC4的一条DNA序列, 依据核苷酸序列差异分为11类(表2)。
 | 图3 栽培品种4类AhNAC4核苷酸序列的对比分析Fig. 3 Alignment of four kinds of AhNAC4nucleotides sequence in peanut cultivars |
| 表2 野生种与栽培种NAC4核苷酸序列的同源性 Table 2 Homology of NAC4nucleotide sequences in Arachisspecies (%) |
来自栽培品种山花11号的2条cDNA序列ShrNAC4- a和ShrNAC4-b同源性为98.19%, 与发表序列同源性分别为99.90%和98.10%。对应的2条DNA序列, 分别命名为ShNAC4-a和ShNAC4-b, 全长均为1244 bp, 包含1050 bp的编码区, 2个内含子分别位于182~ 279 bp和547~642 bp处(图3), 编码蛋白包含349个氨基酸。
2.4AhNAC4等位变异分析2.4.1AhNAC4核苷酸序列差异分析 根据核酸序列的差异, 将栽培品种的4类AhNAC4序列命名为AhNAC4-a1、AhNAC4-a2、AhNAC4-b1和AhNAC4-b2, 缩写为a1、a2、b1和b2 (图3)。a1和a2间同源性最高, 只有1个碱基的差异, 位于717 bp处, 每个栽培品种只包含其中的1个基因。b1和b2有14个SNP位点, 每个栽培品种只包含其中的1个基因。a1和b1有21个差异位点, 其中20个为SNP位点; a1和b2有11个差异位点, 10个为SNP位点。
2.4.2 AhNAC4编码蛋白氨基酸序列分析 a1、a2、b1和b2对应的编码蛋白命名为A1、A2、B1和B2。氨基酸序列分析表明, A1和A2间存在1个氨基酸的差异, 位于第174个氨基酸的位置; A1和B1间有2个氨基酸的差异, 位于第244和第311氨基酸的位置; A1和B2间有2个氨基酸的差异, 位于第174和第311氨基酸的位置; A2和B1间有3个氨基酸的差异, 位于第174、第244和第311氨基酸的位置; A2和B2间有1个氨基酸的差异, 位于第311氨基酸的位置; B1和B2间有2个氨基酸的差异, 位于第174和第244氨基酸的位置(图4)。
对抗旱性不同的32个品种进行NAC4的基因组成分析, 其中莱宾大豆、NC6、远杂9102、山花12号、冀0212-4、鲁花14、山花11号、潍花10号、02P175和湘花2008基因型为a1a1b1b1; 濮花28、徐州68-4、山花9号、花育17和开农49基因型为a1a1b2b2; 山花17、花育31、鲁花8号、阜花10号、豫花15、桂花1026、锦花14、山花8号、鲁花12、湛油41、吉花4号、桂花836、锦花10号、阜花12号和白沙1016基因型为a2a2b1b1; 山花13号和79266基因型为a2a2b2b2。对比32个品种的抗旱性及其基因型表明, 基因型为a1a1b1b1的10个品种中表现强抗旱性的品种有7个, 3个品种属于中等抗旱性; 基因型为a1a1b2b2的5个品种中表现强抗旱性的品种有3个, 2个品种属于中等抗旱性; 基因型为a2a2b1b1的15个品种中表现强抗旱性的品种有6个, 4个品种属于中等抗旱性, 5个品种属于弱抗旱性; 基因型为a2a2b2b2的品种只有2个, 山花13号为强抗旱性品种, 79266属于中等抗旱品种。
比较野生种与栽培种NAC4基因核苷酸序列的差异, 按照序列同源性从高到低, 将野生种的11类NAC4基因依次命名为Aw1NAC4、Aw2NAC4、Aw3NAC4、Aw4NAC4、Aw5NAC4、Aw6NAC4、Aw7NAC4、Aw8NAC4、Aw9NAC4、Aw10NAC4、Aw11NAC4(表2)。对11类野生种和4类栽培种NAC4基因进行核苷酸序列分析(图5), 发现核苷酸序列共有58个差异位点, 其中有53个是SNP位点, Aw5NAC4在862 bp处存在6个核苷酸序列的插入变异, Aw9NAC4、Aw10NAC4在911 bp处存在6个核苷酸序列的插入变异。
花生野生种NAC4的11条DNA序列Aw1NAC4~ Aw11NAC4分别编码蛋白AW1~AW11 (图6)。AW2、AW3、AW6的氨基酸序列完全一致, AW9和AW10的氨基酸序列也完全一致。AW5、AW9和AW10蛋白包含351个氨基酸, 其他蛋白均为349个氨基酸。栽培种4个NAC4基因编码蛋白的氨基酸序列差异位置分别是第174位、244位和311位, 野生种第174位的氨基酸与栽培种的A1和B1相同, 在244位的氨基酸与栽培种的B1相同, 在311位与栽培种A1、A2相同的野生种基因的有9个, 与栽培种的B1、B2相同的野生种基因有2个。栽培种与野生种基因间存在差异的其他10个氨基酸位点, 均表现为少数野生种基因的氨基酸改变。推测a1和b1基因编码蛋白的功能与野生种更接近。
花生栽培种(Arachis hypogaeaL.)是异源四倍体(AABB), 一般认为栽培种是由2个具有不同染色体组的二倍体野生种自然杂交的杂种, 再经一次性加倍事件进化形成[23]。本研究从每个栽培品种中克隆得到AhNAC4的2条DNA序列, 依据核苷酸序列差异将来自32个栽培品种的4类AhNAC4命名为a1、a2、b1和b2, 每个品种包含两类基因, 其中一类基因是a1或a2, 另一类基因b1或b2, a1和a2不会在同一品种内出现, b1和b2也不会在同一品种内出现, 据此判断, a1和a2是来自同一染色体组的等位基因, b1和b2是来自另一个染色体组的等位基因。野生种和栽培种NAC4编码蛋白的氨基酸序列比较(图6)显示, a1和b1基因编码蛋白的功能与野生种更接近。
本试验选用的32个花生品种分别于2011— 2012年进行了抗旱性鉴定, 抗旱等级的划分依据品种的抗旱系数(drought resistance coefficient, DC), 抗旱系数的计算公式为DC=Yd/Yp, 式中Yd为干旱胁迫下产量或生物量, Yp为非胁迫下产量或生物量, 抗旱系数是整株形态及生理生化性状对干旱综合反应的结果, 是对品种综合抗性的评价[24, 25, 26]。作物的抗旱性是多基因控制的数量性状, 受作物的形态特征、组织器官结构、生理生化性状及抗旱相关基因的转录与蛋白质翻译表达水平等诸多因素的控制, 不同品种的抗旱机制存在差异[27, 28, 29]。本研究测试的32个品种中, 基因型为a1a1b1b1和a1a1b2b2的品种共15份, 为强抗旱或中度抗旱。基因型为a2a2b1b1的品种共15份, 包含了强、中、弱三种抗旱类型, 并且在所检测的32个品种中, 抗旱性弱的品种的基因型均为a2a2b1b1。基因型为a2a2b2b2的品种只有2份, 山花13号为抗旱品种, 79266为中度抗旱品种, 且79266抗旱系数处于中度抗旱和弱抗旱性的临界值[20, 30]。推测栽培种a1基因编码蛋白对基因型为a1a1b1b1和a1a1b2b2花生品种抵御干旱起关键作用, 基因型为a2a2b1b1和a2a2b2b2的抗旱品种可能对其他抗旱基因的表达起关键作用。
本研究中AhNAC4属于AtNAC3亚族, AtNAC3亚族基因与植物的抗旱性密切相关。序列比对发现AtNAC3亚族存在一个同源性较高的区域, 位于第200~210个氨基酸处(图7)。在A1、A2、B1、B2蛋白存在差异的第174个氨基酸位点保守性弱, 在拟南芥的ANAC055和AtNAC3中为M(甲硫氨酸), 在GmNAC3和GmNAC4中为A (丙氨酸)和V (缬氨酸); 第244个和第311个氨基酸也是多变的。这3个氨基酸位点对花生抵御干旱所起的作用尚需进一步研究。
 | 图7 AtNAC3亚族氨基酸序列比对黑框代表AhNAC4蛋白的氨基酸差异位点。Fig. 7 Comparison of amino acid sequence of AtNAC3 subfamilyThe different sites of amino acid are shown by black frame. |
花生野生种对环境具有广泛的适应性, 在各种环境胁迫条件下, 比栽培品种具有更强的环境适应和逆境耐受能力, 并且在形态学和分子水平都有丰富的变异, 具有抗旱, 抗盐、抗病虫害等多种抗逆性状, 是栽培种遗传改良极其宝贵的基因资源[31, 32]。陈本银等[33]从花生野生种中发掘了15份高抗青枯病的种质, 抗病材料频率达到19%。本研究从19个野生种中分离得到11类NAC4的DNA序列(Aw1NAC4- Aw11NAC4), 相应编码蛋白有8类, 其中AW5、AW9、AW10蛋白比其他蛋白多2个氨基酸, 花生野生种NAC4基因具有丰富的序列多态性, 为进一步研究不同核苷酸序列NAC4基因的功能和野生种花生抗旱种质的发掘提供了参考。
AhNAC4(HM776131.1)编码的蛋白属于干旱胁迫响应的转录因子。AhNAC4全长为1244 bp, 编码区长度为1050 bp, 含有2个内含子, 分别位于182~ 279 bp和547~642 bp处, 编码蛋白包含349个氨基酸。从32个栽培品种分离的4类AhNAC4中, a1和a2为等位基因, 二者在717 bp处存在1个碱基差异, 引起第174位氨基酸的改变, b1和b2为等位基因, 二者存在14个SNP位点, 其中717 bp和924 bp处碱基的差异引起第174位和244位氨基酸的改变。推测栽培种a1基因编码蛋白对花生抵御干旱起关键作用。从19个野生种中分离得到11类NAC4的DNA序列, 其中Aw1NAC4与栽培种b1、b2的核苷酸序列同源性最高, Aw2NAC4与栽培种a1、a2核苷酸序列同源性最高。a1和b1基因编码蛋白功能与野生种的相似性大于a2和b2基因。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|