第一作者联系方式: E-mail: shenfangdi9@163.com
OpIAP ( Orgyia pseudotsugata inhibitor of apoptosis protein)是黄杉毒蛾核型多角体病毒中编码细胞凋亡抑制蛋白(inhibitor of apoptosis protein, IAP)的基因, p35基因编码苜蓿斜纹夜蛾核型多角体病毒中具细胞凋亡抑制作用的35 kDa蛋白。本研究人工合成了 OpIAP和 p35基因, 构建了同时含有 OpIAP和 p35表达盒的转双价基因载体pUbi:p35-RSS1P:Myc-OpIAP, 两基因分别由玉米泛素基因启动子( Ubiquitin, Ubi)和水稻蔗糖合酶-1启动子(sucrose synthase-1 promoter, RSS1P)驱动。通过基因枪介导法将该载体导入小麦品种扬麦16, 获得双价转基因小麦。对T0~T2代植株, 利用PCR、RT-PCR、qRT-PCR及Western blot分析, 确认导入的外源 OpIAP和 p35基因能够在4个转双价基因小麦株系中遗传并表达。用来源不同、致病力不同的禾谷丝核菌强致病株型R0301和WK207对转双价基因小麦的T1、T2代植株分别进行纹枯病抗性鉴定, 结果表明, 与受体扬麦16相比, 双价转基因小麦的T1、T2代植株对纹枯病的抗性明显提高, 说明 OpIAP和 p35基因的表达可以增强转基因小麦对来源不同、致病力不同的禾谷丝核菌的抗性。
OpIAP ( Orgyia pseudotsugata inhibitor of apoptosis protein) gene encodes an inhibitor of apoptosis protein (IAP) which comes from Orgyia pseudotsugatamulticapsid polyhedrosis virus. p35gene isolated from an Autographa californicanucleo-polyhedron virus encodes a 35 kDa apoptosis protein inhibitor. The expression of both genes displays enhanced resistance in tobacco, maize and cotton. In this study, the full-length coding sequences of OpIAPand p35 genes were synthesized, respectively. The transformation vector pUbi:p35-RSS1P:Myc-OpIAP containing two gene expression cassettes was constructed. In the expression vector pUbi:p35-RSS1P:Myc-OpIAP, the OpIAP gene was driven by the rice sucrose synthase-1 promoter and the p35 gene was driven by the maize ubiquitin promoter. Embryo calli of Yangmai 16 were bombarded by the gold particle containing pUbi:p35-RSS1P:Myc-OpIAP vector DNA. Transgenic wheat plants in T0-T2 generations were subjected to PCR, RT-PCR, qRT-PCR, and Western blot analyses. The results indicated that the introduced OpIAPand p35genes could be inherited and expressed in four transgenic wheat lines. Rhizoctonia cerealisisolate R0301 or WK207 was used to inoculate T1 and T2 plants for sharp eyespot severity assessments. The results showed that the transgenic wheat plants expressing OpIAPand p35 displayed significantly enhanced resistance to sharp eyespot compared with non-transgenic wheat Yangmai 16. Thus, the introduced OpIAPand p35genes could be used in improving wheat resistance to wheat sharp eyespot caused by different Rhizoctonia cerealisisolates.
小麦纹枯病是世界性的小麦土传真菌病害。近年来, 小麦纹枯病已成为多个国家和地区(中国、波兰等)影响小麦高产稳产的主要威胁[1, 2]。我国小麦纹枯病主要由禾谷丝核菌(Rhizoctonia cerealis)引起, 侵染小麦的基部叶鞘、茎秆及韧皮部, 阻碍营养物质的运输, 造成倒伏、枯死和枯白穗, 进而导致小麦产量损失严重, 一般减产10%~30%, 严重年份超过50%[3]。然而目前生产上推广的小麦品种大多对纹枯病的抗性较差, 并且缺乏理想的抗小麦纹枯病的种质资源; 近期研究表明, 小麦纹枯病抗性由几个主效基因和多个微效基因共同控制, 且存在基因间互作[4, 5], 常规育种方法在培育小麦抗纹枯病品种方面进展缓慢。因此, 挖掘和利用抗病有效基因、开展基因工程改良抗病性研究, 为抗纹枯病小麦育种提供了一条新途径。
细胞凋亡(apoptosis)是机体的正常细胞在受到生理和病理性刺激后出现的一种自发性死亡过程。对细胞凋亡抑制机制的认识主要来自动物细胞凋亡的研究, 其作用过程一般包括起始阶段(initiation phase)、效应阶段(effector phase)和降解阶段(degradation phase)。外界的各种凋亡信号刺激细胞, 使细胞在起始阶段发生一系列的生化反应并转变成多条信号转导通路, 进而激活下游的效应因子, 如Caspase(半胱氨酰天门冬氨酸特异性蛋白酶), 进入效应阶段, 在随后的降解阶段, 则会出现DNA的降解、细胞膜通透性增加等一系列细胞凋亡的典型表现。因此, Caspase是介导细胞凋亡中信号转导和实行细胞凋亡的直接效应物, 也是细胞凋亡过程的中心成分[6, 7]。近年来, 一些细胞凋亡抑制因子越来越多地被人们所认识, 常见的有Bcl-2 (B-cell leukemia/lymphoma 2)家族、CrmA (cytokine response modifier A)、IAPs (inhibitors of apoptosis proteins)和p35等。其中, Bcl-2家族蛋白成员间的相互作用对线粒体介导的细胞凋亡信号通路具有调控作用[8]; CrmA来自牛痘病毒, 是血清蛋白酶抑制剂, 能够直接抑制多种细胞凋亡中蛋白酶的活性[9]; IAPs是一个庞大的蛋白家族, 能通过半胱氨酸和组氨酸的重复区域(baculoviral inhibitor of apoptosis repeats, BIR)与细胞凋亡中的效应因子结合, 抑制其活性, 进而参与细胞凋亡的调控[10]。本研究中OpIAP基因来源于黄杉毒蛾核型多角体病毒(Orgyia pseudotsugatenuclear polyhedrosis virus)基因组, 编码由269个氨基酸组成的IAP蛋白OpIAP, 含有2个BIR。BIR是OpIAP抑制Caspase活性的核心区, 也是OpIAP抗细胞凋亡所必需的。OpIAP分子在C末端含有一个锌指结构, 该结构具有泛素连接酶(Ubiquitin ligase, E3)的活性, 能够参与蛋白质的泛素化降解, 进而抑制细胞凋亡发生[11]。p35是苜蓿银纹夜蛾核型多角体病毒(Autographa californicanuclear polyhedral virus, AcNPV)基因组中的1个细胞凋亡抑制因子, 由于该蛋白的电泳带为35 kD而得名[12, 13]。研究表明, p35蛋白的顶部有一突环结构, 包含Caspase切割位点, 当Caspase接近并切割这个突环时, p35分解为10 kD和25 kD的2个片段, 它们与Caspase形成紧密而稳定的复合物, 达到抑制Caspase活性的目的[14, 15]。
植物在受到病原菌等外界刺激后, 也会产生细胞凋亡反应, 也称为HR (hypersensitive response), 是植物防御活体型病原菌的重要机制。近年发现一些细胞凋亡抑制因子的表达可以提高转基因烟草、番茄和棉花等对腐生型病原菌的抗性。Dickman等将Bcl-2、Bcl-xl(B-cell lymphoma-extra large)、Ced-9 (Caenorhabditis eleganscell death gene 9)以及OpIAP等细胞凋亡抑制基因转入烟草, 发现转基因烟草能够抵抗腐生型真菌Sclerotinia sclerotiorum、Botrytis cinerea、Cercospora nicotianae的侵染和腐生型番茄点状枯萎病毒(Tomato spotted wilt virus, TSWV)的感染[16]。IAPs和p35分别属于作用机制不同的2类抗细胞凋亡因子[17], 若二者共同作用, 推测可能会更好地保护植物细胞免受病原菌的侵染。程梦兰[18]利用农杆菌介导法, 将p35和SeIAP(Spodoptera exigua inhibitor of apoptosis protein)基因同时导入玉米中, 得到的6株转双价基因玉米对纹枯病均表现出良好的抗性; Tian等[19]用农杆菌介导法将OpIAP和p35转入棉花中, 获得了对棉花黄萎病抗性明显提高的转OpIAP和p35基因棉花。但目前尚未见转OpIAP和p35双价基因在小麦抗病研究方面的相关报道。
本课题组人工合成了细胞凋亡抑制基因OpIAP和p35, 成功构建了双价转基因载体pUbi:p35-RSS1P: Myc-OpIAP。采用基因枪介导法将OpIAP和p35基因转入推广的小麦品种扬麦16中, 对转基因小麦T0~T2代植株进行了PCR检测、表达分析与纹枯病抗性鉴定, 以明确细胞凋亡抑制基因OpIAP和p35在转基因小麦抗纹枯病育种上的应用前景。
小麦品种扬麦16作为转OpIAP和p35双价基因的受体材料, 由江苏省农业科学院里下河地区农科
所程顺和研究员和张伯桥研究员提供。小麦纹枯病致病菌禾谷丝核菌R0301是江苏地区小麦纹枯病的主要致病菌种, 由江苏省农业科学院陈怀谷研究员和蔡士宾研究员惠赠; 禾谷丝核菌WK207是采自山东泰安的强致病性菌株, 由山东农业大学植物保护学院于金凤教授惠赠。R0301和WK207分别用于鉴定T1代和T2代转基因植株。单子叶表达载体质粒pAHC25和pAHC20均由美国农业部农业研究院Peter Quail博士惠赠, 中国农业科学院作物科学研究所张增艳实验室保存, pRSS1P:Myc-TaPIEP1由本课题组祝秀亮博士构建。
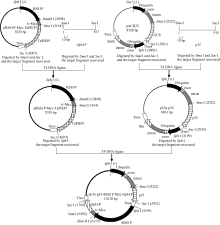
1.2.1 pRSS1P:Myc-OpIAP、pUbi:p35表达载体的构建
根据已公布的OpIAP(GenBank登录号为L22564.1)和p35(GenBank登录号为M16821.1)基因序列, 在其5′ 端和3′ 端分别添加SmaI和SacI限制性内切酶的酶切位点, 由北京奥科生物技术公司合成。用限制性内切酶SmaI和SacI (TaKaRa)消化含上述酶切位点的OpIAP和p35基因以及单子叶表达载体pAHC25和pRSS1P:Myc-TaPIEP1, 分别回收OpIAP (817 bp)和p35 (910 bp)基因的目的片段, 切除GUS基因的pAHC25载体骨架及TaPIEP1基因的pRSS1P:Myc- TaPIEP1载体骨架, 利用T4连接酶分别将回收的OpIAP基因的开放阅读框(ORF)和pRSS1P:Myc载体以及p35基因的ORF与pAHC25骨架载体片段连接(摩尔浓度比为3︰1), 构成表达载体pRSS1P:Myc- OpIAP和pUbi:p35 (图1), 分别转化到E. coli Top10感受态细胞中, 通过菌落PCR筛选阳性克隆并测序, 以确定成功构建转基因表达载体pRSS1P:Myc-OpIAP和pUbi:p35。
1.2.2 pUbi:p35-RSS1P:Myc-OpIAP转基因表达载体的构建 用限制性内切酶Sph I (TaKaRa)分别酶切质粒pRSS1P:Myc-OpIAP和pUbi:p35, 回收含目的基因表达盒的片段。用T4连接酶将这2个目的片段连接, 16℃孵化20 h (图1)。将连接产物转入E. coli TOP10感受态细胞, 通过菌落PCR筛选具上述2个基因表达盒的阳性克隆并测序分析, 测序正确后提取质粒DNA pUbi:p35-RSS1P:Myc-OpIAP, -20° C保存。其中p35基因转录受玉米泛素基因(Ubiquitin, Ubi)启动子驱动, OpIAP基因转录受水稻蔗糖合酶启动子(sucrose synthase-1 promoter, RSS1P)控制。c-Myc标签3′ 端序列与OpIAP基因5′ 端序列相融合, 能以Myc-OpIAP融合蛋白的形式表达。
利用徐惠君等[20]报道的基因枪介导法, 将转基因载体pUbi:p35-RSS1P:Myc-OpIAP质粒DNA和pAHC20 (含由Ubiquitin启动子驱动的Bar基因选择标记)按1︰1体积充分混合, 包裹在直径1.6 μ m的金粉微粒上。采用PDS-1000 He-1基因枪(Bia-Rod)轰击扬麦16幼胚愈伤组织共1978块。轰击后的愈伤组织于高渗培养基(SD2 + 0.4 mol L-1甘露醇 + 0.4 mol L-1山梨醇)上处理16 h, 然后转入SD2 (MS + 2, 4-D 2 mg L-1)培养基黑暗条件下(26℃)恢复培养2周, 转至1/2 MS + Bialaphos 4 mg L-1培养基上选择并分化成苗, 小苗长到1~2 cm时, 移入1/2 MS + IAA 0.5 mg L-1+Bialaphos 3 mg L-1的培养基上壮苗, 再生植株生长到6~8 cm高且根系较好时移入花盆, 置中国农业科学院作物科学研究所温室培养, 以获得转OpIAP和p35双价基因小麦的T0代植株。从外源OpIAP和p35基因PCR呈阳性的转基因小麦T0代植株上收获T1代种子, 单株种植T1代转基因植株, 并进行转基因的分子检测和抗病性鉴定, 逐代类推。
1.4.1 PCR检测 采用改良CTAB法[21], 从转OpIAP和p35双价基因小麦及扬麦16幼苗叶片中提取基因组DNA作为PCR检测的模板。根据OpIAP和p35双价表达转基因载体pUbi:p35-RSS1P:Myc- OpIAP的序列, 设计2对特异引物(OpIAP-TF/ OpIAP-TR和p35-TF/p35-TR)检测转入的2个基因(图2)。引物OpIAP-TF (5′ -GATGACTGAGGCGTG TGTG-3′ )位于OpIAP基因读码框, OpIAP-TR (5′ -AT GTATAATTGCGGGACTCTAAT-3′ )位于Tnos终止子; p35-TF (5′ -TGGGGCAAATCCGAAAAGTA-3′ )位于p35基因读码框, p35-TR (5′ -AAAAACCCATCTCAT AAATAACG-3′ )位于Tnos终止子。转OpIAP和p35基因的预期扩增片段大小分别为424 bp和307 bp。以转OpIAP和p35基因小麦扬麦16的T0~T2植株DNA为模板进行PCR扩增检测, 用扬麦16作为阴性对照, 质粒pUbi:p35-RSS1P:Myc-OpIAP作为阳性对照。检测转入的OpIAP基因的扩增条件为94℃ 5 min; 94℃ 45 s, 58℃ 45 s, 72℃ 45 s, 35个循环; 72℃ 10 min。检测转入的p35基因的扩增条件为94℃ 5 min; 94℃ 45 s, 56℃ 30 s, 72℃ 30 s, 36个循环; 72℃10 min。扩增产物经2.0%琼脂糖凝胶电泳检测。
1.4.2 RT-PCR和qRT-PCR分析 用TRIzol试剂(Invirogen)提取转基因小麦及扬麦16小麦株系的叶片总RNA, 按FastQuant RT kit (with gDNase) cDNA合成试剂盒(TIANGEN)说明书合成第1链cDNA。以第1链cDNA为模板, 首先用小麦TaActin基因特异引物(TaActin-F: 5′ -CACTGGAATGGTCAAGGCTG-3′ ; TaActin-R: 5′ -CTCCATGTCATCCCAGTTG-3′ )使各样本cDNA模板量均一化。然后用OpIAP基因特异的引物(OpIAP-QF: 5′ -ATGAGCAGCCGAGCAATT-3′ ; OpIAP-QR: 5′ -ACGCCTCAGTCATCACCC-3′ ), p35基因特异引物(p35-426F: 5′ -CGACGAACGCAACGA CTACTA-3′ ; p35-672R: 5′ -TTTGAACGACGACGGC AATA-3′ ), 对转基因小麦中目标基因转录情况进行半定量RT-PCR分析。扩增OpIAP基因的条件为94℃ 5 min; 94℃ 45 s, 58℃ 30 s, 72℃ 30 s, 36个循环; 72℃ 10 min。扩增p35基因的条件为94℃ 5 min; 94℃ 45 s, 56℃ 30 s, 72℃ 30 s, 35个循环; 72℃ 10 min。
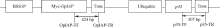 | 图2 pUbi:p35-RSS1P:Myc-OpIAP双价基因的植物表达载体框架图箭头指示区为用特异引物PCR扩增的转基因片段区。Fig. 2 Scheme of pUbi:p35-RSS1P:Myc-OpIAP expression vectorThe double-head arrows indicate the regions amplified in the PCR assays. |
在ABI PRISMR7300实时荧光定量PCR仪(ABI, USA)上进行实时荧光定量PCR (qRT-PCR)分析。反应体系25 µ L, 按SuperReal PreMix Plus (SYBR Green) (TIANGEN)反应体系, 95℃预变性5 min; 95℃变性15 s, 60℃退火31 s, 41个循环, 以TaActin为内参照(引物为TaActin-F和TaActin-R), 用OpIAP和p35特异的引物OpIAP-QF/OpIAP-QR和p35-426F/ p35-672R进行扩增。每个反应均有3次独立的重复试验。以转基因阴性植株Z3-27为对照, 用2-Δ Δ CT方法[22]计算转基因小麦中OpIAP、p35基因的相对表达量。
选取T2代转基因株系中分子检测为阳性的植株, 提取叶片总蛋白。将-70℃冻存的小麦叶片在液氮中充分研磨, 加入蛋白质提取液混匀。该蛋白提取液含62.5 mmol L-1 Tris-HCl (pH 7.4)、10%甘油、0.1% SDS、2 mmol L-1 EDTA-Na2、1 mmol L-1 PMSF (phenyl methane sulfonyl fluoride)和5% β -巯基乙醇。将混合液放置冰上10 min, 然后于4℃下13 400 × g离心20 min, 上清液即为总蛋白质。将总蛋白进行SDS-PAGE电泳并经湿转法转膜后, 与稀释900倍的anti-c-Myc抗体(一抗)杂交, 用一步法快速WB (HRP)试剂盒(康为世纪)进行第二次杂交, 化学发光后进行曝光显影, 检测c-Myc-OpIAP融合蛋白在过表达株系中的表达。
将纹枯菌在煮熟的麦粒上培养, 待麦粒表面长满菌丝后待用。在小麦分蘖盛期, 用消毒镊子夹取长满菌丝的麦粒, 放入麦苗根基部, 每株放4~5粒有菌麦粒, 保湿3~5 d。于乳熟期进行纹枯病抗性调查, 每株系鉴定约30株, 按0~5级调查纹枯病病级, 0级为无症状; 1级为叶鞘变褐, 有病斑, 但病菌未侵入茎秆; 2级为病菌侵入茎秆, 病斑环绕茎秆不超过1/2; 3级为病斑环绕茎秆的1/2~3/4; 4级为病斑环绕茎秆的3/4以上; 5级为出现枯、白穗或整株死亡[23]。按魏学宁等[24]报道的方法计算病情指数(DI)。
式中, i为某个病级, xi为该病级的植株数, N为调查总植株数。
抽穗期调查转基因小麦T1、T2代植株(已检验确定的阳性植株)的株高及1~3蘖的百分率, 与未转基因扬麦16比较。每个株系调查30株。
用Microsoft Excel软件作统计分析, 采用t-检验分析转基因株系与阴性对照间差异的显著性, P< 0.05表明差异显著, P< 0.01则表明差异极显著。
2.1.1 转OpIAP和p35双价基因小麦的获得 由测序分析结果可知, OpIAP和p35双价表达转基因载体pUbi:p35-RSS1P:Myc-OpIAP构建成功, 2个基因表达盒的序列和方向均正确。p35基因转录受玉米泛素基因(Ubiquitin, Ubi)启动子驱动。OpIAP基因转录受水稻蔗糖合酶启动子(sucrose synthase-1 promoter, RSS1P)驱动, 且c-Myc标签与OpIAP基因融合, 能以c-Myc-OpIAP融合蛋白的形式表达。
利用基因枪介导法将上述载体pUbi:p35-RSS1P: Myc-OpIAP的质粒DNA轰击转化小麦推广品种扬麦16的幼胚愈伤组织1978块, 经过分化、筛选和再生, 获得77株再生植株。利用OpIAP和p35转基因特异引物PCR分析这些再生植株中转入的基因。结果表明, 转OpIAP和p35双价基因均为阳性的植株有4株(Z3-2、Z3-17、Z3-42和Z3-75), 转化率为0.2% (4/1978)。
2.1.2 转OpIAP和p35基因小麦的PCR检测 提取转基因小麦T0~T2代植株叶片基因组DNA作为目标基因PCR检测的模板, 利用2个转基因表达盒所特异的引物对转OpIAP和p35基因小麦T0~T2代植株进行PCR检测。结果表明, 4个转基因小麦株系(Z3-2、Z3-17、Z3-42和Z3-75)的T0~T2代植株中均能检测到外源OpIAP和p35(图3), 说明导入的OpIAP和p35在这4个转基因小麦株系中均能遗传。
2.1.3 转基因植株中OpIAP和p35基因的转录表达
采用半定量RT-PCR分析上述4个转OpIAP和p35双价基因小麦株系T2代植株中OpIAP和p35的转录水平, 结果表明, 这4个转基因抗病株系植株中
OpIAP和p35的转录水平均高于未转基因小麦(受体)扬麦16。进一步以转基因小麦中的阴性植株Z3-27为对照, 利用qRT-PCR分析上述4个转基因小麦株系中OpIAP和p35基因的相对表达量, 结果表明,
这4个转基因株系的抗病植株中OpIAP和p35基因的表达水平明显高于转基因小麦中的阴性植株Z3-27和受体扬麦16, 且在不同植株中的表达量存在差异, RT-PCR与qRT-PCR结果基本吻合(图4)。
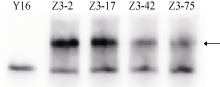
野生型受体小麦扬麦16的蛋白不能与anti-c- Myc抗体产生杂交条带, 而4个转基因株系(Z3-2、Z3-17、Z3-42、Z3-75)的蛋白均能与anti-c-Myc抗体产生杂交带, 说明在这4个转双价基因小麦株系中c-Myc-OpIAP融合蛋白均被表达(图5), 且这4个转基因小麦株系中c-Myc-OpIAP融合蛋白表达量与这些外源基因的转录表达水平相吻合。
对转OpIAP和p35双价基因小麦T1、T2代4个株系的植株、受体扬麦16以及抗、感病对照(抗病
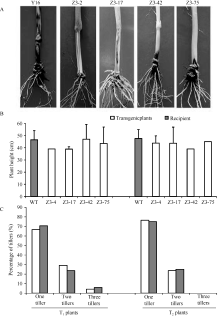
品种CI12633和感病品种扬麦158)分别接种禾谷丝核菌R0301、WK207进行纹枯病抗性鉴定。其中, T1代中阳性植株共39株(Z3-2株系9株、Z3-17株系10株、Z3-42株系11株、Z3-75株系9株), T2代阳性植株共43株(Z3-2株系12株、Z3-17株系9株、Z3-42株系10株、Z3-75株系12株)。鉴定结果表明, 转OpIAP和p35双价基因小麦株系Z3-2、Z3-17、Z3-42和Z3-75的T1、T2代各株系阳性植株的病级与病情指数均低于同株系中阴性植株及未转基因小麦扬麦16 (受体)。其中接种禾谷丝核菌R0301的T1代转基因小麦的平均病级为1.45 (1.27~1.62), 平均病情指数为29.00 (25.42~32.34), 而4个株系中阴性植株的平均病级为2.01 (1.85~2.17), 平均病情指数为40.61 (36.94~43.34), 未转基因小麦扬麦16的平均病级为2.31, 平均病情指数为45.17; 接种禾谷丝核菌WK207的T2代转基因小麦的平均病级为1.57 (1.35~ 1.79), 平均病情指数为31.28 (27.04~35.78), 而4个株系的阴性植株的平均病级为2.25 (2.00~2.50), 平均病情指数为45.05 (40.00~48.00), 未转基因小麦扬麦16的平均病级为2.46, 平均病情指数为49.31。T1、T2代转基因阳性植株比阴性植株的病情指数分别降低了28.6%和30.6%, 比受体小麦扬麦16的病情指数分别降低了35.8%和36.6% (表1)。转基因小麦阳性植株茎基部的纹枯病病斑均明显小于受体小麦扬麦16 (图6-A)。以上结果表明, 转入细胞凋亡抑制基因OpIAP和p35的表达能够显著增强转基因小麦对来源不同、致病力不同的禾谷丝核菌的抗性。
| 表1 转OpIAP和p35基因小麦及受体的纹枯病抗性鉴定 Table 1 Responses of OpIAP and p35 transgenic and host wheat lines to R. cerealis |
于抽穗期对转OpIAP和p35双价基因小麦T1、T2代植株分别进行生长发育状况统计。结果表明, 与未转基因小麦扬麦16相比, 转OpIAP和p35双价基因小麦株系Z3-2、Z3-17、Z3-42和Z3-75的T1、T2代植株的株高与分蘖均未见明显差异。其中T1代转基因小麦的平均株高为45.08 cm (38.83~47.00 cm), 而未转基因小麦扬麦16的平均株高为46.5 cm; T2代转基因小麦的平均株高为43.90 cm (39.00~45.00 cm), 未转基因小麦扬麦16的平均株高为47.2 cm (图6-B)。从分蘖数统计结果上看, T1、T2代转基因小麦与未转基因受体小麦扬麦16的分蘖数分布状况基本相近(图6-C)。以上结果表明, 细胞凋亡抑制基因OpIAP和p35的表达对转基因小麦的生长发育未产生明显影响。
目前, 对植物中细胞凋亡抑制基因的作用机制还了解甚少, 一些研究表明, 转入的细胞凋亡抑制基因的表达可以不同程度地提高一些转基因植物对腐生型病原菌的抗性[16, 17, 18, 19, 25, 26]。如Pual等[25]通过农杆菌介导法将细胞凋亡抑制基因(Bcl-xl、Bcl-2和Ced-9)转入香蕉, 得到2株转Bcl-xl、2株转Bcl-2和3株转Ced-9基因的香蕉植株, 与对枯萎病(Fusarium oxysporum f. sp.cubense)敏感的对照Lady Finger相比, 这7株转基因香蕉的抗病性均明显增强。Lincoln等[26]和Wang等[27]研究表明, 细胞凋亡抑制基因p35的表达能够有效阻碍由一些腐生型病原菌所引起的细胞凋亡。小麦对纹枯病的抗性受多基因控制, 尚未发现主效QTL。本实验室克隆并研究了几个小麦抗纹枯病相关基因的功能[28, 29], 但OpIAP和p35基因是否可以提高小麦纹枯病抗性未见报道。本研究构建了细胞凋亡抑制基因OpIAP和p35的双价表达转基因载体, 通过基因枪介导法获得4个转OpIAP和p35双价基因小麦株系, 经T0~T2代分子检测, 证明了转基因植株的真实性。T1、T2代转基因小麦的纹枯病接种鉴定结果表明, 转入OpIAP和p35基因的表达显著提高了转基因小麦对纹枯病的抗性。这些说明细胞凋亡抑制基因在单子叶和双子叶作物防御一些腐生型病原菌反应中具有一定作用。
通过对T0~T2代转基因植株中转入基因的PCR检测和转录分析, 我们发现OpIAP和p35两基因在4个转基因小麦株系中遗传并表达; 利用Western blot进一步分析, 发现上述4个转基因株系中蛋白均能与anti-c-Myc抗体产生一条杂交带, 说明这4个转基因小麦株系中c-Myc-OpIAP融合蛋白能够表达。由于OpIAP基因与p35基因位于同一个转基因表达载体上, p35蛋白也应该在这些转基因小麦株系中表达, 是否如此仍需后续实验来验证。此外, 本研究采用南方和北方致病力不同的2个禾谷丝核菌菌株(R0301和WK207)进行抗病性鉴定, 转OpIAP和p35双价基因小麦T1、T2代植株的平均病情指数分别比受体扬麦16分别降低35.8%和36.6%, 说明转入细胞凋亡抑制基因OpIAP和p35的表达能够在一定程度上提高转基因小麦对来源不同、致病力不同的禾谷丝核菌的抗性, 具有一定的应用价值。
研究表明, 细胞凋亡抑制基因OpIAP和p35的导入能够提高植物抑制由病原菌所引起的细胞凋亡。如Hansen等[30]用去氧核醣核酸断裂法(DNA laddering)观察农杆菌处理后转基因愈伤组织DNA的形态及农杆菌处理后的玉米胚胎横截面, 发现将凋亡抑制基因OpIAP和p35导入玉米胚性愈伤组织可以抑制农杆菌诱导的PCD (programmed cell death)。Tian等[18]通过DNA laddering和流式细胞仪分析OpIAP和p35基因对棉花枯萎菌毒素引起细胞凋亡的抑制作用, 发现与受体棉花植株相比, OpIAP和p35基因的表达在一定程度上抑制了转基因棉花对枯萎菌毒素所引起的细胞凋亡。因此, 我们推断转OpIAP和p35表达也应该提高转基因小麦的细胞凋亡抑制能力, 是否如此仍需后续实验的进一步验证。
为了解OpIAP和p35基因表达对转基因小麦生长发育的影响, 我们还对转OpIAP和p35基因小麦T1、T2代植株的株高和分蘖数进行了调查。结果表明, 与转基因受体小麦扬麦16相比, 转基因小麦T1、T2代在株高、分蘖数以及成熟时间方面均未受到显著影响, 可能与使用的启动子具有韧皮部组织与诱导表达特点有关。驱动OpIAP转录的RSS1P启动子具有在韧皮部组织特异表达的特性[31], 能驱动OpIAP在小麦的韧皮部组织特异表达; 驱动p35基因的Ubiquitin启动子可被如热击、干旱、冷害等逆境和病原菌诱导表达[29, 32, 33], p35基因可在接种禾谷丝核菌的转基因植株根部及茎基部受诱导而表达更强。
通过人工合成基因、双价表达转基因载体构建与遗传转化, 成功将细胞凋亡抑制基因OpIAP和p35转入小麦品种扬麦16中; 经过分子检测与接种抗病鉴定, 创制、选育出纹枯病抗性提高的转OpIAP和p35双价基因小麦新种质4份。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|