第一作者联系方式: E-mail: god-zhuwenwen@163.com
马铃薯块茎形状(薯形)是选育马铃薯品种尤其是加工品种最重要的性状之一。前人研究表明薯形是由位于第10染色体的单基因 Ro控制的, 并且圆形对长形为显性。本研究以二倍体马铃薯长薯形基因型10618-01和圆薯形基因型320-02及其213个F1代薯形分离群体为材料, 基于马铃薯基因组相关序列信息结合分离群体分组分析法开发标记, 获得了一个CAPS标记1137-CAPSVI。利用该标记对53份不同薯形的四倍体马铃薯高代品系进行验证, 结果表明该标记的选择准确率达83.02%, 进一步的Pearson双侧相关分析显示其相关性达极显著水平, 且该标记对圆薯形材料的选择准确率更高, 达91.42%。该CAPS标记的获得对于四倍体马铃薯分子标记辅助育种, 加速马铃薯品种尤其是加工专用型品种的选育具有重要意义。
Tuber shape is one of the most important traits for potato cultivars especially for the processing varieties. Previous study shows that a single gene Roon chromosome 10 controls most variation for round versus long tuber shape. In this study, based on the potato genome sequence information and bulked segregation analysis strategy, we developed a CAPS marker 1137-CAPSVI using the diploid potato genotypes 320-02, 10618-01 and their 213 F1 tuber shape segregated population. This marker was verified in 53 tetraploid breeding lines with diverse tuber shapes. The results showed that the consistency rate between the marker and tuber shape was 83.02% and the accuracy of the CAPS marker 1137-CAPSVI for selecting round tuber shape was up to 91.42%, and the further Pearson correlation analysis result showed that the marker was significantly correlated with tuber shape. The CAPS marker provides a basis for molecular marker-assisted selection in potato breeding especially for processing variety.
块茎形状即薯形是马铃薯的重要农艺性状之一, 也是鉴别品种特征的重要依据之一[1]。不同的消费习惯和加工产品对薯形的要求不同, 如我国东北地区消费者偏好圆薯形品种, 而中原和南方地区消费者偏好椭圆形或长薯形品种; 一般炸条要求长薯形品种, 而炸片需要圆薯形品种[2]。因此, 选育特定薯形的品种将满足不同消费者和加工需求, 对于促进马铃薯产业全面发展具有重要意义。
马铃薯薯形遗传机制研究历史较长, 最初研究者认为马铃薯薯形的遗传符合孟德尔遗传, 并且长形对圆形为显性[3]。而后来Emme等[4]的研究结果表明薯形由一个主效基因控制, 且圆形对长形为显性。随后的研究也发现长薯形材料的自交后代薯形不分离, 而圆薯形材料的自交后代薯形分离, 进一步证明圆形对长形为显性[5]。1985年, Masson[6]将控制圆薯形的基因命名为Ro, 并确定该基因距着丝粒12.2 cM。1994年, van Eck等[7]将Ro基因定位在第10染色体上。
传统的马铃薯育种周期长、基础群体量大、表观鉴定和选择效率差, 分子标记辅助选择技术有效地提高了选择效率、加速了育种进程。获得易于操作且与特定性状紧密连锁的分子标记是进行标记辅助选择的前提。到目前为止, 已有几十个马铃薯性状被标记, 如抗晚疫病、抗青枯病、抗病毒病等抗性性状, 炸片颜色、块茎休眠、薯肉颜色等品质性状以及耐旱性、耐冻性等抗逆性状。然而, 关于薯形分子标记的报道较少。马铃薯栽培品种是高度杂合的四倍体(Solanum tuberosum, 2n=4x=48), 遗传背景狭窄、染色体高度杂合、遗传重组频率高且存在严重的自交衰退现象[8], 开发分子标记困难。而自
然界中绝大多数马铃薯以二倍体形式存在, 相对于四倍体, 二倍体染色体数目较少, 遗传背景相对简单, 易于分析和进行遗传操作[9]。同时, 已经完成的马铃薯单倍型基因组序列框架图覆盖了马铃薯95%以上的基因, 为薯形基因分子标记的开发提供了资源。基于上述马铃薯遗传特性, 研究者大多利用二倍体材料开发标记, 再将开发的标记应用到四倍体材料中。本研究拟基于马铃薯基因组序列信息开发二倍体材料薯形分子标记, 并用四倍体材料进行验证, 以获得与栽培马铃薯薯形紧密连锁的分子标记, 为马铃薯标记辅助育种提供条件。
二倍体材料长薯形隐性纯合基因型10618-01 (roro)、圆薯形显性杂合基因型320-02 (Roro), 及其213个F1代薯形分离群体, 作为开发薯形分子标记的试验材料。
四倍体材料为随机选择的53份来源于51个杂交组合的后代无性系(表1), 作为验证薯形分子标记的试验材料。
| 表1 四倍体马铃薯材料信息 Table 1 Information of tetraploid potato clones |
选取马铃薯幼嫩叶片, 用CTAB法提取供试材料基因组DNA, 并用琼脂糖凝胶电泳检测DNA质量。
收获成熟马铃薯块茎后, 每个基因型选取最大的3个块茎, 利用游标卡尺测量每个块茎的最大纵轴(匍匐茎生长方向)及最大横轴(垂直于匍匐茎生长方向)长度, 计算每个块茎纵轴对横轴的比值I, 3个块茎比值I的平均值作为衡量该基因型块茎形状的指标, 当I< 1.4时, 块茎为圆形; I≥ 1.4时, 块茎为长形[10]。
根据320-02和10618-01的F1代材料表型鉴定结果, 构建圆形混池(round bulk, RB)和长形混池(long bulk, LB), 圆形混池由I值在1.2以下的10个基因型组成, 长形混池由I值在1.9以上的10个基因型组成。两池的DNA样品均由各基因型DNA等
量混合组成。
根据前期薯形基因定位(未发表)结果, 从马铃薯基因组序列网站(http://solanaceae.plantbiology.msu.edu/pgsc_download.shtml)中下载相关序列, 选取特定区域序列, 利用在线引物设计网站(http://www.idtdna.com/Primerquest/Home/Index)进行引物设计, 将引物Tm值设定在58~62℃之间, 预扩增片段大小设定在700 bp到1000 bp之间。将引物预计扩增序列利用在线网站(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)进行开放阅读框分析, 并将获得的引物利用PGSC中的数据进行比对, 选取只有唯一匹配位点的引物送交生工生物工程(上海)有限公司合成。
利用圆形亲本320-02和长形亲本10618-01的DNA为模板检测引物, 选择在双亲中都能扩增出单一条带的引物, 将PCR产物纯化后连接到T载体上, 转化大肠杆菌, 并涂布在含有Amp、X-gal和IPTG的LB平板上过夜培养。从320-02和10618-01各挑取12个白斑克隆, 经PCR检测后, 各选取6个阳性克隆测序。将测序结果利用DNAStar中的SeqMan程序进行比对分析, 获得SNP位点, 进而利用在线软件dCAPS Finder 2.0 (http://helix.wustl.edu/dcaps/dcaps.html)开发CAPS或dCAPS标记, 选择在双亲中扩增产物有差异的引物开发SCAR标记。PCR体系含8 µ L ddH2O、1.5 µ L缓冲液(10× PCR)、0.3 µ L dNTPs (10 mmol L-1)、1.5 µ L引物(2 µ mol L-1)、0.2 µ L Taq酶(2.5 U µ L-1)、2 µ L DNA (20 ng µ L-1)。扩增条件为94℃ 3 min, 94℃ 30 s, 60℃ 30 s, 72℃ 50 s, 35个循环, 72℃ 10 min。
酶切反应体系含PCR产物8 µ L、10× NE buffer 1.5 µ L、BSA 0.15 µ L、ddH2O 5.3 µ L、Afl II内切酶0.05 µ L。于37℃反应3 h。以1.6%琼脂糖凝胶电泳检测。
根据分子标记检测结果, 将与圆形亲本和长形亲本带型一致的基因型分别记为1和0, 利用统计分析软件SPSS17.0的Pearson双侧检验对四倍体薯形材料表型鉴定结果和标记检测结果进行相关性分析。
根据先前获得的薯形基因遗传图谱信息(未发表), 从PGSC中获得长度为42 kb的相关scaffold序列, 基于该序列设计了29对引物(表2)。用圆形亲本320-02和长形亲本10618-01的DNA为模板对引物特异性进行检测(图1), 其中有17对引物在两亲本中均扩增出单一条带, 特异性好, 可用于设计CAPS或者dCAPS标记。其他引物有的只扩增出其中某一亲本的条带, 有的扩增出多条带, 可用于设计SCAR标记。
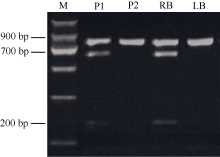
将在两亲本中均扩增出单一条带的PCR产物测序和比对发现, 在引物1137-F45R45的扩增产物中, 圆形亲本和长形亲本之间存在3个SNP位点。通过在线软件dCAPS Finder 2.0发现3个SNP位点中有2个位于限制性内切酶的酶切识别位点内, 分别是HpaII酶切位点(识别序列为“ CCGG” )和AflII酶切位点(识别位点为“ CTTAAG” )。由于与Ro连锁的标记扩增条带含有AflII酶切位点, 可以被切开, 而与ro连锁的标记扩增条带不含该酶切位点, 不能被切开, 因此利用AflII内切酶进行PCR产物酶切, 显性杂合圆薯形亲本及圆形混池的PCR产物酶切带型中同时存在未被切开的900 bp条带和酶切得到的700 bp及200 bp条带, 隐性纯合长薯形亲本及长形混池的PCR产物不能被酶切, 而表现为900 bp的单一条带(图2)。以上结果表明CAPS标记1137-CAPSVI开发成功。利用该标记及先前开发的薯形标记对二倍体薯形F1代213个基因型进行检测, 结合表型数据, 构建了Ro基因位点的遗传连锁图谱(数据未列出), 结果显示, 1137-CAPSVI标记与Ro基因的遗传距离为6.2 cM。标记检测结果与表型鉴定结果吻合度达95.31%, Pearson双侧相关分析发现相关系数r为0.900, 达极显著水平。
| 表2 本研究所设计的引物信息 Table 2 Information of primers designed in this study |
对供试的四倍体高代品系薯形鉴定表明, 在53份四倍体材料中, I值小于1.4的圆形材料35份, 占总材料数的66.04%; I值大于1.4的长形材料18份, 占总材料数的33.96%。总体I值范围在0.8~ 2.2之间, 主要集中在1.1~1.4之间, 其中在1.2~ 1.3之间的材料最多, 共11个, 占总材料数的20.75% (图3)。
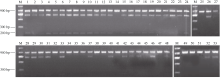
利用标记1137-CAPSVI对53份四倍体薯形品系检测表明, 53份材料的表型鉴定结果与标记检测结果吻合度达83.02% (图4和表3)。将表型鉴定结果与标记检测结果做Pearson双侧相关分析, 相关系数r为0.611, 达极显著水平。在35个圆薯形的材料中, 标记检测为圆形的有32个, 表型鉴定结果与标记检测结果吻合度达91.42%; 在18个长薯形的材料中, 标记检测为长形的为12个, 表型鉴定结果与标记检测结果吻合度达66.67%。在38个标记检测为阳性的材料中, 有32个表现为圆薯形, 标记检测结果与表型鉴定结果吻合度达84.21%; 在15个标记检测为阴性的材料中, 有12个表现为长薯形, 标记检测结果与表型鉴定结果吻合度达80%。上述结果表明该标记与四倍体马铃薯薯形是密切相关的, 可用该标记较好地区分四倍体马铃薯薯形, 当用于鉴定圆薯形材料时准确率更高。
传统育种主要依赖于表型选择。环境条件、基因间互作、基因型等多种因素会影响表型选择的准确性。培育一个优良品种往往需要七八年甚至十几年时间, 而借助分子标记辅助育种可大大提高选择准确性和育种效率[11]。基于马铃薯的遗传特性, 利用二倍体材料开发相关分子标记, 继而应用到四倍体中, 这是马铃薯标记辅助育种的通常途径, 例如, 根据来源于二倍体野生种Solanum bulbocastanum马铃薯RB基因开发的分子标记可对栽培品种晚疫病抗性性状进行有效筛选[12]; 通过对二倍体群体中抗线虫基因H1的定位, 开发了可应用于栽培种线虫抗性选择的复合PCR标记[13, 14]。本研究利用二倍体长、圆薯形的亲本及后代极端性状混池成功开发了一个CAPS标记, 并利用该标记对53份四倍体马铃薯材料进行了验证, 结果表明该标记与薯形性状紧密连锁, 可应用于四倍体材料的薯形辅助选择, 提高育种效率, 节约育种成本。
标记辅助育种技术在马铃薯多个性状上得以应用, 例如Bryan等[15]开发出与抗马铃薯孢囊线虫紧密连锁的分子标记SPUD1636, 利用该标记可辅助筛选马铃薯抗孢囊线虫植株; Bradshaw等[16]利用RFLP标记结合BSA分析方法筛选到2个与抗晚疫病连锁的标记, 并用于马铃薯抗晚疫病育种; 李飞[17]根据马铃薯关键脱氢酶基因SAD开发了一个可应用于马铃薯耐冻性选择的CAPS标记。与马铃薯其他标记筛选相关性状相比, 本研究所开发的标记用于筛选四倍体圆薯形材料效率更高, 达到90%以上, 这对马铃薯育种尤其是薯片加工品种选育将起到积极作用。
在利用CAPS标记1137-CAPSVI对四倍体材料检测时, 我们发现PCR产物酶切条带的亮度不尽相同, 这可能是由于圆薯形对长薯形为显性, 普通栽培种中圆薯形材料可能存在4种基因型形式(RoRoRoRo、RoRoRoro、RoRororo和Rorororo), 即使在等量酶切底物条件下, 具有RoRoRoRo基因型的圆薯形材料的标记特异性条带(700 bp和200 bp)最亮, 其他3个基因型的标记特异性条带的亮度依次逐渐减弱, Rorororo基因型的圆薯形材料的特异性条带最弱。因此, 要想利用标记特异性条带的亮度来区分圆薯形材料、长薯形材料以及其基因型差异, 需在实际操作时用饱和扩增的PCR产物进行完全酶切。
在标记辅助育种中, 对目标性状选择的准确性是一个核心问题, 标记的准确与否直接影响到分子标记选择的成败[18]。本研究中有9份材料(3个圆形材料和6个长形材料)的分子标记检测结果与表型鉴定结果不一致, 可能是因为除主效基因Ro影响马铃薯块茎形状之外, 还存在一些修饰基因[19, 20]。Bjö rn等[21]研究表明, 在第2、第4和第11染色体上存在3个影响薯形的基因座; Prashar等[22]利用马铃薯高密度遗传图谱结合表型鉴定结果, 分别于第2和第10染色体上鉴定出两个块茎形状主效QTL, 这些修饰基因都会影响标记关联度。另外, 群体规模小, 环境因素及人工鉴定误差也会影响鉴定结果的准确性。因此, 在进行马铃薯薯形分子标记辅助选择时, 选用多个薯形QTL连锁标记或功能基因标记进行检测, 结果将更加准确可靠。
| 表 3 53份四倍体材料表型鉴定和标记检测结果 Table 3 Phenotype and marker test results of 53 tetraploid clones |
开发了一个可用于四倍体马铃薯薯形辅助选择的分子标记1137-CAPSVI, 该标记对圆薯形材料的选择准确率可达91.42%, 这对利用标记辅助选择加速马铃薯加工品种的选育和进一步探明薯形的遗传机制具有重要意义。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|