**同等贡献(Contributed equally to this work)
第一作者联系方式: E-mail:caozheng5192@163.com, Tel: 027-87282689
BEL1-like (BELL)家族蛋白是植物中普遍存在的一类具有同源异型结构域的转录因子。拟南芥中BELL家族蛋白能与KNOTTED1-like蛋白互作形成异源二聚体, 并结合到特异顺式作用元件来调控基因的表达, 从而影响植物生长发育进程。本文采用隐马可夫(HMM)模型, 在玉米基因组中鉴定到15个 BELL家族基因( ZmBELL), 分布于7条玉米染色体。通过与拟南芥 BELL基因的序列比较将这些基因分为两大类。在玉米8种组织中 ZmBELL有不同的表达模式, 具有明显的组织表达特异性。基于基因共表达分析及BELL-like蛋白特异结合的顺式元件分析, 预测到86个可能受 ZmBELL调控的下游靶标基因。这86个基因和12个 ZmBELL表达模式相同, 并且在基因启动子区存在与BEL1-like蛋白结合的顺式元件。这些结果为进一步解析玉米 BELL家族基因的功能和作用机制积累了有价值的资料。
The BEL1-like family (BELL) proteins, that are ubiquitous homeodomain transcription factors among plant species, interact with KNOTTED1-like protein to regulate a range of developmental processes by binding specific cis-acting element to modulate gene expression. BELL family genes in maize still need to be studied systematically. Here, we identified 15 BELL family genes ( ZmBELLs) in maize genome using the Hidden Markov Model (HMM). These ZmBELLs distributed non-uniformly in seven chromosomes of maize, were clustered into two groups on the basis of the similarity with their orthologs in Arabidopsis thaliana. Furthermore, these ZmBELLs exhibited different expression patterns in eight tissues studied, showing strong tissues-specific expression. Moreover, based on co-expression profiles and specific motif bound by BEL1-like protein, we predicted 86 genes showing co-expression pattern with 12 ZmBELLs in eight tissues studied and harboring specific motif bound by BEL1-like protein in the promoter region. The results could provide valuable informations for dissecting function and molecular mechanism of ZmBELLs in maize.
Gehring等(1987)发现, 一些基因突变后可产生同源表型, 并从中分离得到一个极为保守的序列, 称之为同源异型盒(homeobox)[1]。同源异型盒基因编码具有同源异型盒结构域(homeodomain, HD)的一类转录调控因子, 在动、植物生命发育中都扮演着重要角色[2]。典型的同源异型盒结构域由60个氨基酸组成, 在三维空间中折叠形成3个螺旋区, 第1个螺旋和第2个螺旋形成环状结构, 第二个螺旋和第3个螺旋形成螺旋-转角-螺旋结构[3]。但某些同源异型盒基因例外, 它们编码一个由63个氨基酸组成的非典型DNA结合结构域, 在第一个螺旋和第二个螺旋之间插入了3个额外的氨基酸残基(P-Y-P)[4], 这一类同源异型盒基因称为TALE (Three Amino-acid Loop Extension)基因家族[5, 6]。在植物中, TALE基因家族包括KNOX (KNOTTED-like homeodomain)和BELL (BEL1-like homeodomain)两类亚基因家族。
BELL基因家族是TALE家族的一个分支, 几乎存在于所有的生物中[7]。苔藓中有4个BELL家族基因, 拟南芥和水稻中分别有13个[8, 9]和14个BELL家族基因[10]。虽然BELL家族基因存在于不同物种中, 但它们编码的蛋白在结构上仍有高度相似性, 都含有一个典型的HD结构域, 在HD上游包含SKY和BEL两个保守结构域[11]。这3个保守结构域对于BELL家族蛋白在植物体内行使功能具有重要意义。SKY和BEL特异识别并结合KNOX蛋白的MEINOX结构域, 形成BEL-KNOX异源二聚体, 进而从细胞质转移到细胞核[12, 13]。在细胞核内, 二者的HD结构域特异结合到各自的靶序列上, 调控下游基因表达[13, 14]。如拟南芥BELL家族蛋白BLH1和KNOX家族蛋白KNAT3形成异源二聚体, 调控ABA响应基因的表达水平, 影响种子发芽和生长[15, 16]; 而KNOX家族蛋白STM和BEL家族蛋白ATH1、PNY、PNF具有相似功能, 调控植物顶端分生组织的发育[17]。虽然在植物中发现了多个BELL家族基因, 但是大多数基因的功能至今未知。目前, 关于BELL家族基因的研究大多集中在拟南芥上, 而在玉米中还未进行。本文利用生物信息学方法, 通过HD、SKY和BEL同源结构域在玉米基因组中搜索BELL家族基因, 并比较分析玉米BELL家族基因及其蛋白质结构, 以及这些基因的组织特异表达及其可能调控的下游靶基因, 以期为玉米BELL家族基因的研究积累有益的资料。
从TAIR (The Arabidopsis Information Resource)网站上提取拟南芥BELL家族基因的氨基酸序列, 以FASTA格式保存。在MaizeGDB (http://www. maizegdb.org/)上输入拟南芥BELL家族基因氨基酸序列, 根据玉米BELL家族蛋白同源结构域HD、SKY和BEL, BLASTp初步筛选玉米BELL家族蛋白。比对筛选到的BELL家族蛋白多序列(muscle 3.7), 将BELL家族蛋白特有SKY (E-value < 0.0055)和BEL (E-value < 0.00089)蛋白质序列用hmmbuild (hmmer3.1 b1)生成HMM文件, 搜索玉米B73 Pfam (http://pfam.sanger.ac.uk/)数据库, 进一步查找玉米BELL家族蛋白编码基因。根据MaizeGDB上查找的基因信息, 将基因标注于玉米10条染色体上。从MaizeGDB下载玉米BELL基因序列, 以FASTA格式保存, 分别导入基因结构显示系统(GSDS, http:// gsds.cbi.pku.edu.cn/)[18], 绘制基因结构图, 对个别显示错误的结构图进行手工修正。
分别从MaizeGDB和TAIR (The Arabidopsis Information Resource)网站上提取玉米和拟南芥BELL家族蛋白的氨基酸序列, 以FASTA格式保存。用软件CLC Sequence Viewer (Version 6)比对氨基酸多序列, 采用邻近算法(Neighbor-Joining, NJ, Bootstrap检验1000次)构建系统进化树。将玉米BELL蛋白氨基酸序列导入在线蛋白结构域分析系统(SMART, http://smart.embl-heidelberg.de/)[19], 绘制基因蛋白结构图, 再根据HMM得到的SKY和BEL结构域位置信息, 完善基因和蛋白结构图。然后, 根据所预测的基因序列设计引物, 以PCR扩增cDNA序列并测序, 比较扩增序列与预测序列, 验证玉米BELL家族基因预测序列的准确性。
从qteller (http://qteller.com/qteller3/)下载玉米BELL家族基因的表达量数据, 选取根、茎、叶、茎顶端分生组织、雌穗、雄穗、胚和胚乳8个组织的表达量数据, 运用heatmap.2制作heatmap图。进一步, 选取B73的三叶期幼苗的根系、幼叶、拔节期的茎、雌穗、雄穗以及授粉25 d后的胚乳共6个组织, 采用TRIzol试剂(Invitrogen, USA)提取总RNA, 逆转录成cDNA (TransScript One-Step gDNA Removel and cDNA Synthesis SuperMix, TransGen Biotech, China)。以Actin1基因(GRMZM2G126010)为内对照, 运用实时定量PCR方法(SYBR FAST qPCR Kit, KAPA Biosystems, USA)检测BELL家族基因在6个组织中的相对表达水平。
基于qteller中基因表达数据, 将玉米BELL家族基因依次同39 656个玉米基因进行表达量的相关性分析, 筛选出与BELL家族基因表达量显著相关(P< 0.0001)的基因。然后, 抽取表达水平显著相关基因转录起始位点上游1000 bp的启动子序列, 基于BELL家族基因特异性结合的DNA序列(TGACAGG/ CT)[20], 筛选可能与BELL基因共表达且受BELL基因调控的基因。用Gene Ontology(GO)富集预测这些共表达基因的功能, CytoScape2.7.0分析基因间的关系, MAPMAN (MAPMAN 3.5.1 R2)分析基因参与的代谢途径, 找出参与相同代谢途径的共表达基因。
根据BELL家族蛋白结构域HD、SKY和BEL, 基于HMM模型在玉米基因组数据库中共筛选到15个玉米BELL家族成员。表1显示, 这15个基因分布于7条玉米染色体, 其中第1染色体上有7个, 第5和第6染色体上分别有2个, 第3、第4、第8、第9染色体上各有1个。这15个基因序列长度不一, ZmBELL7长约10 kb, ZmBELL6只有1681 bp, 大多数基因在5 kb左右。有趣的是, 不同基因所含外显子数目基本相同, 除了ZmBELL9包含5个外显子外, 其他基因都只有4个外显子, 说明基因序列长度和所含外显子数之间可能没有直接关系。另外, 同一基因外显子长度差别较大, 如ZmBELL7外显子长度从65 bp到1327 bp不等, 可能与基因选择性剪切有关。这些基因大多数可以产生选择性剪切转录本, 如ZmBELL1有6个转录本, ZmBELL2有7个转录本, ZmBELL9可达8个转录本, 只有5个基因在现有表达数据中只有1个转录本(表1)。由于ZmBELL1第1个转录本不包括BEL家族结构域SKY和BEL, 故选择第2个转录本进行后续研究, 其他的基因均用第1个转录本进行后续研究。
| 表1 玉米中的BELL基因家族成员 Table 1 BELL family members in maize |
15个ZmBELL预测可分别编码263~755个氨基酸。结构域分析发现, 所有蛋白都含有同源异型结构域HD, 属于homeodomain蛋白(图1)。在HD上游, 这15个ZmBELL蛋白也具有BEL保守结构域, 属于BELL家族蛋白。但在这15个ZmBELL中, 只有12个蛋白同时具有SKY和BEL两个保守结构域, 这两个结构域是BELL家族蛋白区别于其他同源异型盒家族蛋白的关键。而ZmBELL15、ZmBELL11和ZmBELL6并无SKY结构域, 暗示这3个蛋白的作用机制和生物学功能与其他BELL蛋白的差别。以cDNA序列扩增并测序证实, ZmBELL2、ZmBELL4、ZmBELL5、ZmBELL10、ZmBELL11和ZmBELL13序列与预测一致, 仅有ZmBELL1在第1708位存在一个T/C替换, 说明BELL基因外显子、结构域和生物信息预测基本一致。
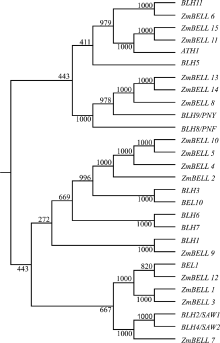
根据玉米和拟南芥BELL家族蛋白的氨基酸序列, 利用CLC Sequence Viewer (Version 6)软件构建玉米和拟南芥BELL家族蛋白的系统进化树(图2)。玉米BELL家族蛋白可以明显分为两个分支, 每个分支又分为两大类。第一个分支含ZmBEL6、ZmBELL15和ZmBELL11, 与BLH5同源, 归为一类; 而ZmBELL13、ZmBELL14和ZmBELL8与BLH9/ PNY和BLH8/PNY同源性高, 归为另一类。第二个分支包含9个蛋白, 它们之间的同源关系比较复杂, 但是对于每个玉米BELL蛋白仍可以找到与之同源性相对较高的拟南芥BELL蛋白。由于玉米中BELL家族基因的功能大多数是未知的, 而拟南芥BELL基因研究的比较深入, 因此, 将拟南芥BELL家族基因和玉米BELL家族基因进行同源分析, 能为玉米BELL家族基因功能及其调控网络研究提供指导。
从图3可以看出, 玉米BELL家族基因表达有明显的组织特异性, ZmBELL9、ZmBELL1、ZmBELL2、ZmBELL4、ZmBELL10和ZmBELL5主要在根和茎中表达, ZmBELL12主要在茎中表达, ZmBELL7主要在叶片中表达, ZmBELL6在茎顶端分生组织表达量高, ZmBELL11在胚中表达量高, ZmBELL14、ZmBELL15、ZmBELL13和ZmBELL8在雄穗和雌穗发育器官中高水平表达, 另外ZmBELL15在叶片中、ZmBELL8在茎顶端分生组织中的表达也较高。在玉米的各个组织器官中, 均有ZmBELLs的表达, 说明ZmBELLs可能参与多个组织器官发育的调控, 影响整个植株的生长。8个ZmBELL在6个不同组织中的表达水平分析(图4)表明, ZmBELL7在B73叶片中特异表达, ZmBELL14在雄穗和雌穗中表达量高, ZmBELL15在叶片、雌穗和雄穗中表达量高, ZmBELL10在幼苗根系中高水平表达。所检测的8 个ZmBELL的表达模式与基于生物信息学数据分析结果基本一致。
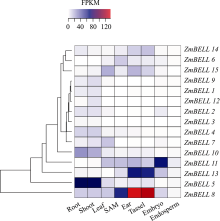 | 图3 15个玉米BELL家族基因表达谱方框内颜色显示玉米BELL基因表达水平。Fig. 3 Expression profile of 15 BELL genes of maizeColors in square represent the expression level of maizeBELL genes. |
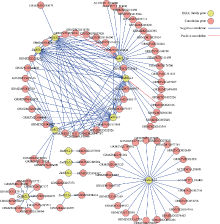
相关性分析发现, 3359个基因与15个ZmBELL的表达量呈极显著相关(R2> 0.9322, P < 0.0001)。根据BELL家族蛋白特异性结合顺式元件序列TGACAGG/CT, 在3359个基因的启动子中, 经motif筛选鉴定到86个与ZmBELL表达水平显著相关且在其启动子区含有TGACAGG/CT顺式元件的下游靶标基因(图5)。其中, 3个玉米BELL基因的表达水平分别仅与1个靶基因的表达显著相关, 如ZmBELL11的表达与GRMZM2G000674的表达正相关; 9个BELL基因分别可与多个靶基因的表达显著相关, 如ZmBELL12的表达与23个靶基因的表达呈正相关。有趣的是, ZmBELL3、ZmBELL4和ZmBELL5这3个基因的表达水平均与GRMZM2G000973的表达正相关; ZmBELL1、ZmBELL3、ZmBELL4、ZmBELL5和ZmBELL9这5个基因的表达水平与GRMZM2G059392的表达显著正相关, 表明在玉米发育进程中可能存在多个玉米BELL基因共同调节1个靶基因表达的情况。这种1个靶基因与多个BELL基因表达相关的情况主要发生在ZmBELL1、ZmBELL3、ZmBELL4、ZmBELL5、ZmBELL9和ZmBELL10上, 而这6个基因在玉米多组织器官中共表达, 也暗示在玉米发育调控中这些基因协同作用的重要性。
玉米KNOTTED1(KN1)基因的功能研究揭示了植物heomobox基因组织器官特异性表达在维持植株正常发育中的重要性。玉米KN1仅限定在茎顶端分生组织中表达, 一旦KN1在叶维管束中异位表达则诱发细胞增殖, 叶片长出“ 瘤状” 的结[21, 22]。而拟南芥的ATH1在茎中异位表达, 抑制细胞增殖, 茎长度明显缩短[14, 23]。对ZmBELL在8个组织器官的表达分析发现, 15个ZmBELL表现出多种表达模式, 特别是4个基因(ZmBELL5、ZmBELL8、ZmBELL10和ZmBELL13)具有显著不同的表达模式, 各自在特定的组织器官中高水平表达, 也说明这些基因在维持特定组织器官的建成和发育中具有重要作用。
模式植物拟南芥中的BELL家族基因的功能解析也为玉米BELL家族基因的功能与作用机制的研究提供了指导。拟南芥BLH2/SAW1和BLH4/SAW2在叶片、心皮、花药、茎等多个组织中表达[9], 在saw1saw2双突变体叶片中, BP (BREVIPEDICELLUS)异位表达, 叶片呈锯齿状且卷曲[24]。BLH2/SAW1和BLH4/SAW2的同源基因ZmBELL7在叶片中表达量最高, 可能与玉米叶片的生长发育相关。拟南芥BLH9/ PNY影响茎顶端分生组织、茎、胚座的发育, 突变体pny花序节间异常, 角果小、畸形且成簇生长[13, 25]; 而BLH8/PNF和BLH9/PNY同源, 二者共同调控拟南芥花序原基的生长, 维持茎顶端分生组织的发育平衡[26]。ZmBELL8、ZmBELL13和ZmBELL14与BLH8/PNF和BLH9/PNY聚在同一亚组, 且与BLH8/ PNF和BLH9/PNY具有相似的表达模式, 在雌、雄穗中表达量高, 推测这3个玉米BELL基因可能参与玉米花序发育的调控。相似地, 拟南芥的ATH1是光调控转录因子, 也在花序和茎基部高水平表达, 调控花序发育和茎基部边缘生长[23, 27]。ZmBELL11和ZmBELL15与ATH1高度同源且在玉米花序和茎等组织中表达水平较高, 推测ZmBELL11和ZmBELL15可能具有ATH1相似的生物学功能。
已有研究表明, BELL家族蛋白可特异性结合靶基因启动子区TGACAGG/CT DNA motif进而调控基因表达[20]。据此, 受BELL家族基因所调控的靶基因一般应具有两个特征, 即与BELL家族基因的表达高度相关和在基因启动子区具有TGACAGG/CT motif。基于以上两个特征, 我们共筛选到86个假定的受ZmBELL所调控的下游靶基因。其中, 3个ZmBELL与假定的下游靶基因表现为一对一的对应关系, 暗示这3个ZmBELL的调控途径的特异性; 而9个ZmBELL分别调控多个靶基因, 说明这些ZmBELL基因可能通过多条途径调控植株的正常发育或涉及多个组织器官的建成和发育的调控。另外, 少数基因受多个ZmBELL的调控, 成为重要的调控节点, 也说明这些基因的重要性。例如5个转录调控因子(AC202396.4_fg010、GRMZM2G106560、GRMZM2 G875502、GRMZM2G129146和GRMZM2 G137352)和4个胁迫响应相关的基因(GRMZM2G 032962、GRMZM2G006468、GRMZM2G090177和GRMZM2G 329144)的表达可能分别受多个ZmBELL的调控(图5), 这些基因在玉米生长发育和胁迫响应中可能具有重要的作用。尽管这些假定的调控关系还需要进一步的实验验证, 但这些基于生物学信息学的结果为进一步的研究提供了可供参考的线索。另外, 还有3个ZmBELL基因未被鉴定到其调控的下游基因, 可能与本试验中所提取的基因启动子序列较短(1 kb), 所使用的表达数据仅局限于8个组织器官等有关。
采用隐马可夫(HMM)模型在玉米基因组中的鉴定到15个BELL家族基因(ZmBELL)。ZmBELL不均匀分布于玉米7条染色体上, 与拟南芥的直系同源基因的相似性比较分为两大类。ZmBELL在玉米8种组织中表现出多种表达模式, 具有明显的组织表达特异性。另外, 基于共表达分析和特异性motif筛选所鉴定到的86个基因可能受12个ZmBELL基因所调控。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|