第一作者联系方式: 刘芳, E-mail:g5n2a5f@163.com
** 同等贡献(Contributed equally to this work)
脂肪酸去饱和酶基因( FAD2)是控制植物体中油酸含量的关键基因, 在甘蓝型油菜中有4个 FAD2基因的拷贝, 分别定位在A1、C1、A5、C5染色体上。本文克隆了1个 FAD2拷贝基因, 依据油菜基因组数据库信息, 将其定位到C1染色体上, 命名为 BnFAD2-C1, 其开放阅读框为1155 bp。采用RACE (rapid-amplification of cDNA ends)技术获得了175 bp的5° UTR序列和212 bp的3° UTR序列。采用荧光定量PCR技术研究发现, BnFAD2-C1在根、花和角果皮中仅保持本底水平的表达, 在种子发育中期呈现高效表达, 具有种子特异性诱导表达的特征。根据甘蓝和油菜基因组数据库信息, 同源克隆到 BnFAD2-C1基因的启动子(promoter)和内含子(intron)序列, 并通过PLACE和PlantCARE网站分析, 初步预测到调控该基因转录的潜在顺式作用元件。通过茉莉酸诱导处理, BnFAD2-C1基因表达量发生变化, 推断茉莉酸在 BnFAD2-C1基因的表达过程中可能发挥一定的调控作用。
Fatty acid desaturase gene ( FAD2) is a key factor in regulating oleic acid content. There are four copies of FAD2 located on chromosomes A1, C1, A5, and C5 in Brassica napus. One copy containing 1155 bp open reading frame was cloned with previous research method and named as BnFAD2-C1, which was location on chromosome C1 based on the genome database information of oleracea and oilseed. The untranslated regions (UTR) of 5′ and 3′ end with 175 bp and 212 bp length respectively were cloned by RACE (rapid-amplification of cDNA ends) technique. The expression pattern of BnFAD2-C1 gene was identified using quantity PCR technique, showing a seed-specific inducible expression in mid developmental seeds and a background-level expression in root, flower and siliqua wall. The promoter and intron region were also cloned and analyzed using PLACE and PlantCARE websites to predict some potential cis-elements in regulating BnFAD2-C1gene transcription. At the same time, jasmonic acid (JA) was inferred to make certain contributions to regulate BnFAD2-C1gene expression showing a changeable expression quantity when treated with jasmonic acid.
一般植物种子中多不饱和脂肪酸(polyunsaturated fatty acid, PUFA), 例如亚油酸(18:2Δ 9, 12), α -亚麻酸(18:3Δ 9, 12, 15)含量普遍较高。亚油酸是亚麻酸的合成前体, 由脂肪酸去饱和酶2 (FAD2; EC1.3.1.25)催化油酸脱氢形成[1]。油酸可以降低血脂与血压, 防止动脉硬化的出现[2]; 同时, 富含油酸的菜籽油因含有较少的多不饱和脂肪酸(主要为亚油酸和亚麻酸), 而更利于存储, 货架期更长[3]。
FAD2基因能够将油酸磷脂胆碱去饱和成亚油酸磷脂胆碱, 是控制种子中油酸含量的关键基因[4]。FAD2基因首先发现于拟南芥(Arabidopsis thaliana) [1], 并相继在大豆[5]、棉花[6]、花生[7]、芝麻[8]和白菜[9]中被克隆。该基因一般存在多个的拷贝, 拷贝基因间的功能有着较大差异[10]。甘蓝型油菜(Brassica napus, AACC)源于白菜(Brassica rapa, AA)和甘蓝(Brassica oleracea, CC)的天然杂交, 经两倍化之后形成[11], 因此甘蓝型油菜中存在多个FAD2基因的拷贝。借助于油菜与白菜、甘蓝的同源性, Yang等[12]从甘蓝型油菜中克隆了4个FAD2基因, 分别定位在油菜A、C基因组上。Lee等[13]也克隆了4个FAD2基因拷贝, 并预测了4个拷贝在基因组上的分布结构。
前人研究表明[14], FAD2基因的表达量对油菜种子中油酸含量有着重要影响。本研究针对BnFAD2- C1基因, 克隆了其全长cDNA序列, 分析BnFAD2- C1基因在不同组织中的表达规律; 克隆目的基因启动子及内含子序列, 并预测到可能调控该基因表达的潜在元件; 对该基因进行茉莉酸诱导分析, 初步阐明BnFAD2-C1基因的功能, 以及在转录水平调控该基因表达的元件, 并证明该基因的表达确实受到茉莉酸的诱导调控, 为BnFAD2-C1基因转录调控规律的深入研究提供依据, 进而为高油酸油菜分子育种提供理论基础。
甘蓝型油菜湘油15来源于国家油料改良中心湖南分中心; 本试验中所用到的引物均由南京金斯瑞合成。
取幼嫩的油菜叶片, 参照DNA提取试剂盒(购于天根公司)说明书提取油菜基因组DNA。使用肖钢等[15]设计的FAD2基因编码区保守序列的扩增引物P1/P2, 以基因组DNA为模板采用PrimeSTAR HS DNA聚合酶(TaKaRa, Japan)进行高保真扩增。扩增体系包含10× buffer 5 µ L, dNTP (2.5 µ mol L-1) 4 µ L, 正、反向引物各1 µ L, DNA 1 µ L, PrimeSTAR HS DNA聚合酶1 µ L, 用ddH2O补足50 µ L。反应条件为95℃ 5 min; 95℃ 50 s, 58℃ 50 s, 72℃ 2.5 min, 28个循环; 72℃ 10 min。用1.5% 琼脂糖凝胶检测PCR结果。将PCR产物纯化回收后, 进行加A反应, 然后将其连接到pMD18-T载体(TaKaRa, Japan), 转化到大肠杆菌中, 由铂尚公司完成测序工作。
参考Kiefer等[16]的方法采用CTAB法提取油菜总RNA, 按照消化试剂盒(TaRaKa, Japan)说明书操作, 去除RNA中的基因组DNA。将消化后的RNA按照SMATERTM RACE cDNA扩增试剂盒说明扩增BnFAD2-C1基因全长cDNA, 并由铂尚生物技术(上海)有限公司测序。
根据已获得的全长cDNA序列, 在该基因3′ UTR序列区域设计特异性引物进行定量PCR检测。引物序列为, C1-FAD2-F (正向): 5′ -TTTCTCTTG GTCTGGTTTAGTCTTT-3′ , C1-FAD2-R (反向): 5′ -A TAACACAACAAAATGAGACAATAA-3′ ; 采用上述方法提取油菜不同组织及不同发育时期种子的RNA, 包括根、花、角果皮(开花后10、15、20、25、30、35和40 d), 种子(开花后10、15、20、25、30、35和40 d)。将RNA按照上述方法消化后, 按照PrimeScript II 1st strand cDNA Synthesis Kit)说明书(TaKaRa, Japan)进行cDNA第1链的合成, 选择2Actin作为内参基因, 进行定量PCR检测。反应体系为20 µ L, 2× SYBR Premix ExTaq10 μ L, 正、反向引物各 0.5 μ L, 第1链cDNA 0.5 μ L, ddH2O 8.5 μ L。在Bio-Rad CFX 96 定量PCR仪上扩增, 程序为95℃ 30 s; 95℃ 5 s, 60℃ 30 s, 40个循环。
根据油菜基因组和甘蓝基因组的同源性分析, 与甘蓝相比, 油菜BnFAD2-C1基因的5° UTR序列内部缺失很长一段序列, 该序列是甘蓝的内含子区域, 那么以油菜基因组DNA和cDNA为模板进行PCR扩增, 根据油菜与甘蓝的同源性, 在甘蓝BnFAD2- C1基因5° UTR上游约2000 bp处设计特异性引物C1-QF (正向): 5′ -GGTGGTGACTAATTGGTTCCTT GTG-3′ 与位于BnFAD2-C1基因编码区内部的反向引物C1-R: 5′ -GATTGCTTTCTTGAGGTCTCCGAG- 3′ 共同扩增。然后将PCR产物克隆到大肠杆菌中, 测序。利用PLACE和PlantCARE网站对BnFAD2-C1启动子及内含子序列进行预测分析。
取开花后25 d的油菜角果, 嵌入含有不同浓度茉莉酸的MS培养基中(pH 6.0)处理48 h, 茉莉酸浓度依次为0、25、50、75、100、125和150 µ mol L-1。然后提取种子的RNA, 并进行反转录和定量PCR检测, 具体方法分别参照1.2和1.3。
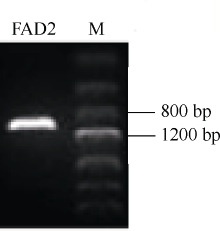
使用P1、P2引物, 从油菜基因组中高保真扩增得到一个FAD2拷贝基因, 长度约1100 bp (图1)。将其转化到大肠杆菌后测序, 获得1155 bp序列信息(图2), 该序列与油菜基因组数据库同源比对, 结果发现该序列定位在C1染色体上, 同源性为100%, 因此将其命名为BnFAD2-C1; 将其与甘蓝基因组数据库同源比对, 同源性达到100%。采用RACE技术扩增了175 bp的5° UTR序列和212 bp的3° UTR序列, 并确定了BnFAD2-C1基因的转录起始位点。
采用荧光定量PCR技术, 针对不同组织及不同发育时期的种子进行定量分析(图3), BnFAD2-C1基因主要在种子中表达, 在其他组织中几乎不表达。并且在油菜种子发育的前期, BnFAD2-C1基因只有本底表达的水平, 进入中期即油脂合成期时, 该基因出现迅速高表达现象, 并且延续到种子成熟, 其表达量一直持高不下。说明BnFAD2-C1属于种子特异性表达基因, 并且在种子发育的中期有诱导现象, 可以将其定义为诱导型种子特异表达基因。
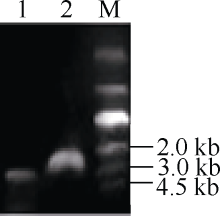
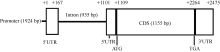
基因表达情况的变化主要取决于基因的转录调控过程, 而转录调控过程中发挥关键作用的因素则是启动子区域。为了研究启动子在转录过程中如何发挥调控作用, 首先克隆了该基因的启动子序列。根据甘蓝和油菜基因组数据库信息, 设计特异引物C1-QF/C1-R, 分别以基因组DNA和cDNA为模板, 使用高保真酶HS PrimerSTAR (TaKaRa, Japan)扩增BnFAD2-C1基因5° 端侧翼序列(图4), 以cDNA为模板的扩增结果相对于以DNA为模板的扩增结果约少1000 bp, 即在基因组DNA中存在, 而在cDNA中并不存在; 同时, 测序结果显示, 在5° UTR内部穿插了935 bp核酸序列, 这段序列长度在以cDNA为模板扩增的测序结果中并未发现, 因此可证明这段序列应为内含子序列。同时, 测序结果显示, 在5° UTR上游区域存在1924 bp的核酸序列, 应为启动子序列, 该基因全长序列的结构模式如图5所示, 内含子嵌入5′ UTR内部, 位于翻译起始位点ATG上游8 bp处, 转录起始位点位于内含子上游167 bp处。BnFAD2-C1基因启动子区域与甘蓝的同源性很高, 仅有一个碱基的差异, 5′ UTR区域也只存在一个碱基的差异, 但是油菜BnFAD2-C1基因的内含子区域比甘蓝缺失了37个碱基序列。
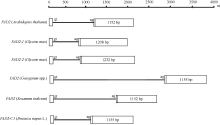
BnFAD2-C1基因中内含子位于5′ UTR内部, 这一结构特征同样存在于拟南芥、棉花、大豆和芝麻中, 且此类内含子序列均以GT开始, 以AG结束, 为GT-AG结构模式, 序列长度从420~3150 bp不等(图6)。
基因的表达主要受转录水平的调控, 其中启动子发挥关键作用。从BnFAD2-C1基因的表达量分析可知, 该基因在种子发育中期具有诱导种子表达的现象。那么, 为了探明BnFAD2-C1基因表达调控的机制, 现采用生物信息学方法分析该基因的启动子序列。如图7所示, 在启动子序列中存在一些胚乳特异性表达元件(GCN4-motif, skn-1), 赤霉素应答元件(P-box, GARE), 热激蛋白结合位点(HSE), 脱落酸应答元件(ABRE, MBS), 茉莉酸应答元件(CGTCA-motif), 水杨酸应答元件(TCA-element), 抗性应答元件(TC-rich), 分生组织表达特异性元件(CAT-box), 厌氧诱导表达元件(ARE), 光诱导元件(AE-box、GA-motif、ACE、3-AF1和CATT-motif)。核心启动子元件TATA-box存在于-25~ -32 bp, 具有增强启动子功能效应的元件CAAT-box存在于-53~ -57 bp。
 | 图7 BnFAD2-C1基因启动子及内含子序列生物信息学分析结果Fig. 7 Bioinformatic analysis of the nucleotide sequences of BnFAD2-C1 gene promoter and intron |
利用PlantCARE和PLACE网站预测分析内含子序列, 发现在内含子+1027~ +1030 bp处和+944~ +948 bp处分别存在TATA-box和CAAT-box元件。另外也存在一些类似启动子中的元件, 如胚乳特异表达元件(GCN4-motif, skn-1), 光诱导元件(CATT- motif、Box I、3-AF1和ATCT-motif), 厌氧诱导元件(ARE)。
不同浓度的茉莉酸处理开花后25 d的油菜角果, 然后经定量PCR检测分析显示, 当茉莉酸浓度在0~50 µ mol L-1时, 随着茉莉酸浓度的增加, 种子中BnFAD2-C1基因的表达量逐渐增加, 但是表达量增加的量不到0.3倍; 当茉莉酸浓度大于50 µ mol L-1时, 随着其浓度的增加, BnFAD2-C1基因表达量下降, 当茉莉酸浓度达到150 µ mol L-1时, BnFAD2-C1基因的表达量下降一倍多(图8), 说明该基因在表达过程中确实受到茉莉酸的影响。
本研究成功克隆了甘蓝型油菜BnFAD2-C1基因的全长cDNA序列, 确定了该基因的转录起始位点。研究了该基因在甘蓝型油菜不同组织, 种子发育的不同时期的表达量变化情况, 结果显示, 该基因主要在种子发育的中后期高效表达, 在种子发育的前期表达量极低, 在其他组织基本不表达, 因此我们认为该基因属于诱导型种子特异性表达基因。该基因在种子中的表达规律和油菜脂肪酸的积累模式规律较为接近, 在油菜种子发育的中后期脂肪酸尤其是亚麻酸快速积累且持高不下[17], 说明BnFAD2-C1基因在催化油酸去饱和形成亚油酸的过程中发挥了重要功能。
针对BnFAD2-C1基因的启动子序列分析发现, 预测到的胚乳特异诱导表达元件可能是导致该基因在种子中特异表达的因素, Vicente等[18]发现, P-box和胚乳特异性转录因子相互作用可以促进zein基因在胚乳发育过程中大量表达。另外, 突变ABRE或G-box序列可以引起种子中napA启动子功能下降[19]。不仅启动子具有调控基因表达的作用, 内含子也具有增强基因表达的功能, 称为内含子增强效应(intron-mediated enhancement, IME)。这一类内含子大多位于5′ UTR内部, 并且具有类似核心启动子的元件TATA-box和CAAT-box; 发挥IME功能的元件不仅存在于内含子, 在5′ UTR和CDS区也大量存在, 并且内含子区的增强效应元件主要分布于内含子5′ 端, 其中CGATT (距离转录起始位点小于1 kb)可能是产生IME功能的主要元件[20]。本研究中克隆的内含子位于5′ UTR内部, 并且在距离转录起始位点862 bp (+862)处存在一个CGATT元件(图7)。因此, 我们初步推测该内含子可能具有IME功能。我们下一步工作可以针对BnFAD2-C1基因启动子及内含子区域进行缺失分析, 确定控制种子中BnFAD2-C1基因特异性高效表达的主校元件。
茉莉酸是在植物发育过程中尤其是抵御伤害的情况下发挥重要功能的信号分子[21], 在许多双子叶植物中, 茉莉酸具有诱导抗性基因表达产生抗性蛋白的功能[22]。研究表明, 植物经外源茉莉酸处理后, 为了降低膜的流动性, 增加其稳定性, 脂肪酸组分会发生改变, 其中饱和脂肪酸C16:0和C18:0及单不饱和脂肪酸C18:1组分增加, 多不饱和脂肪酸C18:2和C18:3 n-3组分减少[23, 24]; 同时, 茉莉酸会促进油脂及相应的次级代谢物的产生, 提高含油量[23, 25, 26]。茉莉酸对于脂肪酸和含油量的改变主要通过对脂肪酸合成基因KASI、SAD、ω -6 FAD和ω -3 FAD的表达量的调控来实现, 其中KASI、SAD和ω -6 FAD基因会因茉莉酸的刺激表达上调, ω -3 FAD基因则下调[23]。开花后25 d的油菜角果, 经不同浓度的茉莉酸处理后, 其种子BnFAD2-C1基因表达量出现明显的变化(图8), 说明BnFAD2-C1基因的表达受到茉莉酸的调控。Rouster等[27]发现存在于大麦Lox1基因启动子区域的CGTCA和TGACG元件, 当二者中的一个或者两个同时突变会导致基因的表达不受茉莉酸的诱导, 证实这两个调控元件是茉莉酸信号的应答元件。生物信息学分析结果显示, 在BnFAD2- C1基因的启动子区域存在一个CGTCA-motif元件(图7), 初步推测该基因该元件可能是茉莉酸的应答元件, 响应茉莉酸的刺激诱导BnFAD2- C1基因表达量变化, 但还有待进一步验证, 因此, 我们后续工作可以通过缺失分析方法来进一步确定茉莉酸调控元件所在区域, 进而针对该区域深入探索, 发现茉莉酸发挥功能的根源及其原理。
克隆了甘蓝型油菜BnFAD2-C1基因的全长cDNA序列, BnFAD2-C1是种子特异性诱导基因; 从油菜基因组中克隆了该基因的内含子序列和启动子序列, 且初步预测到该基因调控序列的顺式作用元件, 该基因的启动子区域可能存在受茉莉酸诱导调控的应答元件。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|