第一作者联系方式: 刘颖, E-mail:summertime1212@163.com
** 同等贡献(Contributed equally to this work)
为揭示小麦纹枯病抗源的遗传多样性, 发掘优异的抗性种质, 利用沟带接种法对前期筛选出的88份抗性种质进行了3年田间抗性鉴定, 鉴定出抗或中抗纹枯病的小麦种质32份。利用分布于全基因组的SSR标记对这些抗源进行了遗传多样性分析, 59个SSR标记共检测到308个等位变异, 每个标记可以检测到2~13个等位基因, 平均5.2个; 多态性信息含量(PIC)的变异范围为0.12~0.89, 平均为0.61, 表明材料的遗传丰富度较高。根据聚类分析和主成分(PCA)分析, 32份小麦纹枯病抗源按照遗传相似系数可划分为2个组群, 国外引进品种和国内改良品种聚为一类, 国内农家品种聚为一类, 并且与地理分布特征相符。利用与纹枯病抗性QTL紧密连锁的14个SSR标记对32份抗源进行基因型分析, 发现与抗性QTL连锁的2BS上的 Xwmc154和7DS上的 Xbarc126普遍存在, 可用于分子标记辅助选择。在武农148、陕983、陕农78、Coker 983、H-Line、Mason和Compair中仅检测到一个已报道的抗病QTL, 而在Tyalt中没有检测到已知抗病QTL, 这些材料有可能携带新的纹枯病抗性基因/QTL, 可以在育种中加以利用。
A three-year filed identification with artificial inoculation was carried out to validate 88 wheat germplasm resources resistant to sharp eyespot identified in previous studies. Thirty-two accessions showed resistance or moderate resistance to sharp eyespot. Rich genetic diversity among these resistant resources was revealed by 59 SSR markers across the whole wheat genome. A total of 308 alleles were detected with 2-13 alleles per marker and an average of 5.2. The polymorphism information content (PIC) ranged from 0.12 to 0.89 with an average of 0.61. The clustering and principal component analysis (PCA) based on molecular marker data indicated that the 32 resistant accessions were grouped in improved variety (including alien varieties) and landraces, which was consistent with geographic distribution. The 32 resistant varieties were genotyped with 14 SSR markers closely linked to QTLs for sharp eyespot resistance. Xwmc154 on 2BS and Xbarc126 on 7DS were frequently detected in the resistant resources. As a consequence, they are recommended in marker-assisted selection. Only one known resistance QTL was detected in varieties Wunong 148, Shaan 983, Shaannong 78, Coker 983, H-Line, Mason, and Compair, whereas no resistance QTL was found in Tyalt. These varieties might carry novel resistance genes/QTLs against wheat sharp eyespot and are promising in wheat breeding.
小麦纹枯病又称尖眼点(斑)病(wheat sharp eyespot), 是由禾谷丝核菌(Rhizoctonia cerealis)或立枯丝核菌(Rhizoctonia. solani)引起的一种土传真菌病害, 在世界各小麦产区均有发生。病菌侵染后, 植株叶鞘、茎秆上出现云纹斑, 茎蘖腐坏, 严重影响小麦生长发育, 导致产量降低和籽粒品质下降[1]。由于气候变暖、施氮量增加和耕作制度改变等原因, 纹枯病已成为影响我国黄淮和长江中下游麦区的主要病害之一[2]。种植抗病品种是小麦纹枯病的根本解决方法, 不仅能有效地减少产量损失, 还可以避免因使用农药而造成的残毒和环境污染问题[3], 但抗源的筛选是培育抗纹枯病品种的关键。
小麦纹枯病抗性为多基因控制的数量性状, 易受环境因素的影响, 抗性遗传机制比较复杂。目前, 我国尚未发现对纹枯病免疫的品种(系), 生产上推广应用的品种大多感病, 但品种间存在抗性差异[4]。利用ARz × 扬麦158、Niavt 14 × 徐州25、Luke × AQ24788等组合构建的重组自交系群体, 共定位了20多个纹枯病抗性QTL, 分布于除3A、7A、1B、4B、5B、1D、4D和6D染色体以外的其余染色体[5, 6, 7, 8, 9, 10, 11, 12, 13]。这些已报道的位点的表型变异解释率普遍较低, 无法直接用于抗性育种。因此, 要想实现小麦抗纹枯病育种, 一方面需要加强小麦种质资源鉴定力度, 筛选优质抗源, 发掘主效抗性QTL; 另一方面, 对于一些中度抗病的资源材料, 需聚合微效抗病基因。
SSR标记具有共显性、多态性丰富、重复性好等特点, 因此被广泛应用于遗传多样性分析、抗性QTL定位和分子标记辅助育种等的研究中, 尤其是当供试材料性状相近时, 基于SSR标记聚类相较于表型聚类具有更高的灵敏度。而且利用与抗性QTL相关的SSR标记对抗性材料进行等位位点分析, 可以了解抗性位基因在参试材料中的分布情况, 发掘出新的抗源, 并为杂交育种工作中抗性亲本的选择提供理论依据[14]。Ogbonnaya等[15]利用穗发芽抗性QTL相关的SSR标记将28个不同小麦抗感品种区分开。Sardouie-Nasab等[16]利用2A、4D和3B染色体上的耐盐QTL对30份耐性和敏感性小麦品种进行单倍型分析, 筛选出9个在耐盐品种中广泛分布的SSR标记, 可以用于分子标记辅助选择。Yu等[17]通过与小麦瘿蚊抗性基因H13、H22、H23、H26和H32紧密连锁的8个SSR标记, 对118份人工合成六倍体小麦进行单倍型分析, 发现19份携带新抗性基因的抗源。目前, 小麦纹枯病抗源发掘工作还不够深入, 更没有利用分子标记分析其遗传多样性的报道。在前期初步鉴定中, 我们从3500余份国内外小麦种质材料中筛选出88份纹枯病抗性较好的材料。本研究对这些材料又进行了连续多年抗性鉴定, 发掘出抗性好且稳定的种质材料; 同时, 利用SSR标记分析抗源材料的遗传多样性, 明确其遗传背景和亲缘关系, 初步鉴定出携带抗纹枯病QTL, 为合理利用这些抗源材料和深入研究相关抗性基因奠定了基础。
88份初步鉴定的纹枯病抗性材料包括46份国内改良品种, 来自江苏、河南、陕西等10个省区; 17份国内农家品种, 来自江苏、河南、新疆等省区; 25份国外引进品种, 分别来自美国、法国、德国等8个国家。以辐麦63作为感病对照(见附表)。
| 附表 供试材料及其抗性评价 Supplementary table Name and resistance grade of wheat germplasm used in this study |
分别于2010— 2011、2011— 2012和2013— 2014年在江苏省农业科学院粮食作物研究所试验田进行田间试验。其中2010— 2011、2011— 2012年度的试验设置为顺序排列, 1个重复; 2013— 2014年度试验按随机区组设计, 2个重复。
采用大田播种沟撒病麦粒法人工诱发纹枯病。将小麦籽粒浸泡24 h后, 装入两层塑料袋中进行高压蒸汽灭菌。之后将事先培养好的小麦纹枯病菌R0301菌株接入灭菌麦粒中, 在25℃下于恒温培养箱中培养15 d左右, 期间每3 d上下颠倒混匀一次, 使菌丝在麦粒上充分生长。在小麦播种沟里均匀撒播病麦粒, 再将供试材料以行距15 cm、株距5 cm条播于沟内, 覆土、喷水保湿1周。翌年3月中旬, 将培养好的病麦粒以100 g m-1均匀撒入麦行, 进行二次接种, 中耕后喷水保湿一段时间以确保充分发病。在5月中、下旬调查纹枯病田间发病情况, 按0~5级分级标准[18]调查病情, 采用病情指数(DI)作为衡量抗病性强弱的指标。同时, 采用李洪连等[19]的相对抗病性评价方法, 并引入相对抗病指数(RRI)来评价种质材料抗病程度, 分为免疫(RRI=1.00)、高抗(0.80≤ RRI< 1.00)、抗病(0.60≤ RRI< 0.80)、中抗(0.40≤ RRI< 0.60)、中感(0.20≤ RRI< 0.40)和感病(RRI< 0.20)。

RRI= 1 - (某品种的DI/发病最重品种的DI)
式中, i表示纹枯病病级(0~5级); xi为某病级的茎秆数。
于2014年对参试品种进行发苗, 并参照Ma等[20]的SDS法, 从嫩叶中提取总DNA, 用紫外分光光度法检测其质量和浓度, 稀释至50 ng µ L-1, -4℃贮存备用。随机选取12份材料作为样本, 从77个SSR标记中依照在基因组分布均匀、扩增条带清晰稳定、具有多态性的原则选取59个, 其中14个SSR标记与纹枯病抗性QTL紧密连锁(表1)。PCR体系10 µ L, 包括DNA模板10~20 ng、左右引物各0.2 µ mol L-1、0.2 mmol L-1的dNTPs、1.5 mmol L-1的MgCl、1× PCR buffer和0.1 U Taq酶。PCR程序为94℃预变性5 min, 然后按“ 94℃ 30 s/50~60℃ 45 s/ 72℃ 50 s” 进行38个循环扩增, 最后72℃延伸7 min。扩增产物经8%非变性聚丙烯酰胺凝胶电泳, 银染法显色, 统计带型。
| 表1 携带抗纹枯病QTL的品种名称及相关SSR标记 Table 1 Wheat varieties carrying resistance QTLs against sharp eyespot and their SSR markers |
根据各软件分析的格式要求, 分别以二进制和基因型记录SSR分析结果。相同迁移率记为1, 无带记为0; 同时记录基因型, 以数字1、2、3等表示。应用Power Marker V3.25软件统计SSR位点等位变异数、基因多样性、遗传距离和多态性信息含量(PIC)。以NTSYS-pc Ver.2.10e统计分析软件计算遗传相似系数(genetic similarity, GS)并按非加权算术配对法(UPGMA)和SHAN程序聚类分析, 同时根据遗传距离采用Eigen模块进行主成分分析。
88份小麦材料的纹枯病年度间平均病情指数分布范围为25.63~59.62, 总平均值为39.79。根据3年平均病情指数, 总体抗病水平以国外引进品种最强(35.09), 国内农家品种次之(40.28), 国内改良品种抗性最差(42.16)。3年中表现稳定中抗及以上的种质材料有32份(表2), 占33.33%。国内改良品种对纹枯病的抗性普遍较差, 3年抗性指数达到中抗及以上的材料只有8份, 分别来源于陕西、河南等地, 仅占总改良品种的14.81%, 这也是小麦纹枯病近年来在我国大面积发生的主要原因; 农家品种和国外引进品种达到中抗以上的品种较多, 如农家品种红蚰子两年鉴定为抗病; 引进品种中抗性较好的有FHB143、关东107、Tyalt、Niavt30等, 其中关东107的3年重复鉴定均为抗病。
| 表2 表现稳定抗和中抗纹枯病的材料 Table 2 Wheat cultivars with stable and moderate-resistance to sharp eyespot |
59对SSR引物在32份小麦抗源中共检测到308个等位变异, 单个位点平均5.2个等位变异, 变幅为2~13个。标记的平均遗传多样性0.65, 多态性信息含量(PIC)变幅为0.12~0.89, 平均为0.61 (表3)。基因组间比较结果显示, D基因组的平均PIC值最高, 为0.66, A基因组的最低, 为0.54; 第2同源群与其他同源群相比, 具有较高的遗传多样性, 平均PIC值达0.68, 第4同源群平均PIC值最低, 为0.45; 不同地理来源品种PIC值比较结果显示, 国外引进品种的遗传多样性较高, 农家品种次之, 国内改良品种最低, 为0.44。
| 表3 抗源材料不同基因组及同源群的遗传多样性 Table 3 Genetic diversity in different genomes and chromosomes in wheat accessions |
 | 图1 Xgwm334-7B和Xwmc581-7B位点等位变异及频率Fig. 1 Alleles at loci Xgwm334-7B and Xwmc581-7B and their frequencies |
标记的等位变异数目与其PIC值呈显著相关 (r= 0.78, P< 0.01), 但也有少数标记表现出明显的选择倾向。例如, 位于7B染色体上的Xwmc581和Xgwm344, 同样都具有5个等位变异, Xwmc581各个等位变异出现的频率较为一致, 而Xgwm344位点中130 bp大小的等位变异出现的频率高达65.6%, 远高于其他变异(图1)。这种现象出现的原因是某些等位变异可能与农艺性状基因连锁, 致使其受到较强的选择压而保留下来。
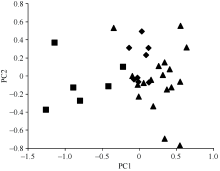
应用NTSYS-pc Ver.2.10e软件对32份抗源进行PCA分析, 构建二维聚类图(图2, 前二维贡献率为44.9%)。国内农家品种与国外引进品种、国内选育品种相比呈现了宽广分布的特征, 表明其遗传背景较为广泛且遗传多样性较为丰富。国内改良品种分布于聚类图的右上方, 聚合较为紧密, 与国外引进品种分化不明显, 说明国内外小麦改良品种的遗传基础从总体上均逐渐趋向同质化。部分国外引进品种和国内选育品种相互之间存在交叉现象, 表明二者可能存在相同或相近的血缘关系。
32份抗源的遗传相似系数(GS)变异范围为0.68~0.89。Ulka和Compair的遗传相似系数最大, 为0.89, 说明这2个抗源的遗传背景非常相近, 其次是兴育7号与FHB143 (0.86)、剑子麦与小白头(0.85)。遗传相似系数最小的组合是剑子麦与CI12633 (0.68), 其次是白朝玉与Ulka (0.70)、关东107与Compare (0.70)。在育种时选择亲缘关系较远的抗源配置组合, 其后代的变异类型较多, 培育出纹枯病抗性品种的可能性也会增大。
32份小麦纹枯病抗源SSR聚类分析(图3)结果显示, 在GS为0.75水平上可分为两大类, 第一类包括27个品种, 且以国内改良品种和国外引进品种为主; 第二类包括5个品种, 都是国内农家品种。国内改良品种多数在GS=0.80处聚为一类, 而国外引进品种GS变异范围为0.70~0.89, 遗传背景较为复杂。
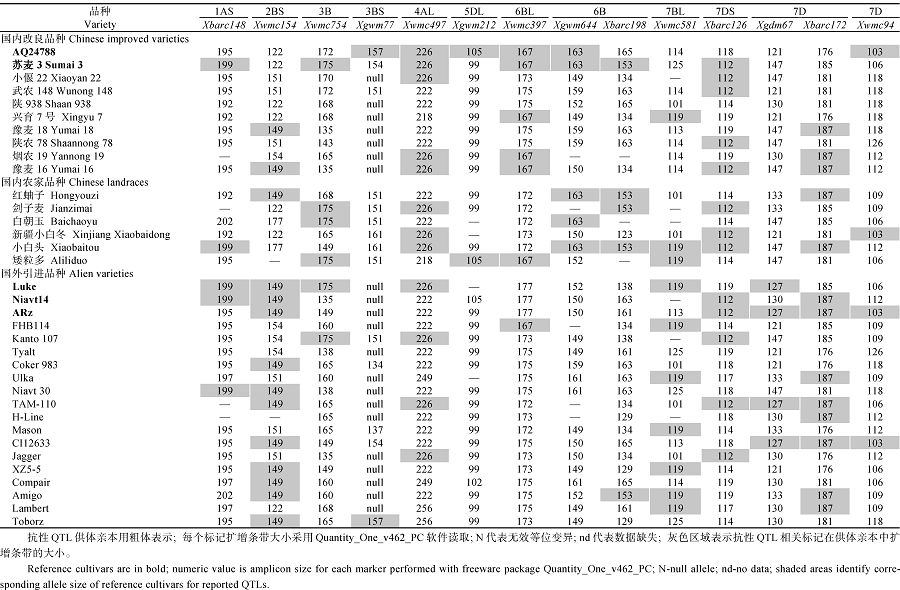
利用与已报道的抗性QTL紧密连锁的14个SSR标记对32个抗源进行等位变异分析, 其中10个抗性QTL分别来源于抗性种质AQ24788、ARz、Luke和Niavt14, 另外2个抗性QTL则来源于感病种质苏麦3号。分析结果表明, 除位于2BS、4AL、7BL和7DS染色体上的抗性QTL以外, 大部分已报道的抗病QTL在32份小麦抗源中较少得到检测(表4)。许多抗源种质仅含有1个抗性QTL, 如武农148、陕938、陕农78、Coker983、Mason等, 而两年鉴定结果为R的Tyalt中则没有检测到任何一个已报道的抗病QTL。另外, 某些抗病QTL在不同地理来源的抗源中分布也有所不同, 例如, 位于2BS染色体上的QTL在国外引进抗源中普遍存在, 而国内改良品种和农家品种中则很少被检测到; 4AL染色体上的抗病QTL主要集中在国内改良品种和国内农家品种中, 19个国外引进品种中只检测到4个。
| 表4 与纹枯病抗性相关的SSR标记在34份小麦种质中扩增片段的大小 Table 4 Allele sizes of 14 SSR markers associated with sharp eyespot resistance QTL in 34 wheat varieties (bp) |
Khlestkina等[23]用22个SSR标记对54个西伯利亚春小麦进行遗传多样性分析, 平均等位变异为6.6, 变幅为3~11。Peng等[24]对来自俄罗斯的53个抗蚜虫小麦品种和18个感蚜虫小麦品种进行遗传多样性分析, 以81对SSR引物共检测到545个等位变异, 平均等位变异数为6.7。Liu等[25]利用24对SSR引物对30个小麦品种进行遗传多样性分析, 共检测到等位变异数目为115, 变幅范围在2~9之间, 平均等位变异数目为4.6。本文利用覆盖全基因组的59个SSR分子标记对32份小麦抗性种质进行了遗传多样性分析, 共检测到308个等位变异, 平均为5.2, 变幅为2~13, 这与前人研究结果相似。在大部分六倍体小麦中B基因组的多态性较高, 而在四倍体和少数六倍体小麦中, A基因组的多态性高于B、D基因组[24]。32份纹枯病抗性种质的多态性分析结果与前人研究结果略有不同, 等位基因数目表现为A基因组最低(4.80), B和D基因组等位变异数目差异较小。PIC值以A基因组的多样性最低, D基因组(0.66)略高于B基因组(0.63), 这可能是与本研究中B基因组上部分SSR标记表现出明显的选择倾向有关, 其SSR标记的等位变异数目与PIC的相关系数为0.67, 低于A基因组(0.87)和D (0.72)基因组。
聚类分析和二维因子主成分结果都表明, 国内农家品种具有广泛遗传背景, 国内引进品种和国内选育品种遗传背景相对集中。国内改良品种、国内农家品种和国外引进品种大多各自聚为一类, 说明亚群的划分与地理分布相关。选用不同地理来源、不同生态类型和亲缘关系远的抗纹枯病小麦材料作为育种亲本, 其杂交后代变异类型更为丰富, 甚至可能会出现超亲分离现象, 有利于纹枯病抗性品种的选育。李斯深等[26]利用国外高抗纹枯病种质和当地推广品种育成了山农730216、山农330645-1等抗纹枯病种质14份。蔡士宾等[6]利用国外抗纹枯病小麦ARz和Niavt14为抗源, 以国内改良品种扬麦158为受体亲本, 通过复交组合, 聚合了抗病基因, 育成了02P12、02P315等兼抗纹枯病和赤霉病的新种质。
朱芳芳[13]在Niavt14中定位了3个抗性QTL, 其中Xbarc126与7DS染色体上的纹枯病抗性QTL紧密连锁, 扩增片段大小为112 bp, 32份国内外小麦抗源中有12份能检测到Xbarc126-112带型, 占37.5%, 说明该等位基因在抗源中存在较为普遍, 可以作为小麦纹枯病抗源的检测标记用于分子标记辅助选择。与之类似的还有Xwmc154-149, 在抗源中的存在比例为40.6%。蔡士宾等[6]用抗病种质ARz和扬麦158构建了重组自交系(RIL)在7D染色体上定位了2个抗性QTL, 最高能解释14.68%的表型变异。参照Genetic-physical图谱[21]与Somers遗传图[22], 与这2个抗性QTL紧密连锁的Xwmc94、Xgdm67和Xbarc172均处在7DL-5染色体区段内, 标记之间的遗传距离也不超过8 cM, 推测该染色体区段存在主效抗性基因, 或者是7DL染色体上存在纹枯病抗性基因簇。TAM-110和CI12633拥有Xgdm67-127、Xbarc172-187两个等位变异, 同抗性来源供体ARz带型一致, 表明这2个抗源都含有该抗性QTL; 而豫麦18、红蚰子、Niavt 14等只含有Xbarc172-187等位基因, 出现这种情况的原因可能是染色体重组事件的发生致使这些材料另一侧的等位基因产生变化, 表明这些抗源也有可能含有该纹枯病抗性QTL[27]。
引自德国的小麦抗源Tyalt, 其3年的平均病情指数为28.59, 抗性表现良好, 且没有检测到已知抗性QTL, 说明该抗源可能含有新的抗性基因。武农148、陕983、陕农78、Coker983、H-Line、Mason、Compair仅检测到1个抗性QTL, 而这些品种对纹枯病抗性都达到R或MR级, 因而不能排除它们还携带未知的抗性QTL, 因此需开发新的分子标记作进一步检测, 以确定是否为新的抗源材料。
在初步筛选的基础上, 经过3年田间接种鉴定, 获得32份对纹枯病抗性稳定的小麦种质, 其中18份是国外引进品种, 而国内改良品种和农家品种分别只有8份和6份。在32份抗源材料中, 利用SSR标记检测部分已知的抗性QTL, 其中Xwmc154和Xbarc126频率分别为40.6%和35.7%。在Tyalt中没有检测到已知抗性QTL, 在武农148、陕983、陕农78、Coker983、H-line、Mason和Compare中仅检测到1个抗性QTL, 这些材料有可能是携带未知抗性QTL的新抗源。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|