第一作者联系方式: E-mail: mmmjjjttt@sina.com
稻瘟病是黑龙江省水稻生产中的主要病害之一, 造成重大产量损失。本文为明确不同遗传背景下4个稻瘟病菌株群致病性及其寄主品种的抗性改良情况, 以中国鉴别品种、日本清泽鉴别品种、水稻单基因系品种和当地水稻品种为鉴定体系, 以各群菌株为研究靶标, 通过喷雾接种方式, 结合联合抗病性和基因聚合方式完成改良分析得出下列结论: (1)在中国鉴别品种体系下, 源自空育131、垦稻12、上育397和哈9811的菌株分别被划分为10个、6个、6个和9个生理小种, 源自哈9811的菌株的优势小种为ZF1, 其他3个类群菌株的优势小种均为ZG1。(2)在日本清泽鉴别品种体系下, 源自空育131、垦稻12、上育397和哈9811的菌株分别被划分为19个、11个、13个和14个生理小种, 其致病率平均值分别为54.17%、46.21%、41.67%和59.90%。(3)在水稻单基因系品种体系下, 源自空育131、垦稻12、上育397和哈9811的菌株分别被划分为20个、11个、12个和16个致病型, 其致病性相似系数分别介于0.20~0.87、0.25~0.90、0.25~1.00和0.31~0.88。(4)在当地水稻品种体系下, 源自空育131、垦稻12、上育397和哈9811的菌株分别被划分为12个、7个、9个和13个致病型, 其最佳抗性品种分别为龙盾104、松粳6号、松粳9号和龙稻7号。(5)从抗性改良角度分析, 应用联合抗病性方式, 其联合抗病性系数和联合致病性系数平均值分别介于0.71~0.92和0~0.08, 效果较好; 应用基因聚合方式, 对源自空育131、垦稻12、上育397和哈9811的菌株表现免疫的基因组合分别有2个、2个、5个和7个。综合分析, 以水稻单基因系品种为体系进行稻瘟病菌株致病性分析效果较好; 2种抗性改良方式效果都较好, 但也各有利弊。
Rice blast is one of the most serious rice diseases in Heilongjiang province, resulting in high incidence and yield reduction. In order to definite the pathogenicity of P. oryzaeisolates and resistance improvement of nurse varieties under different genetic backgrounds, the experiment was conducted using four groups of Pyricularia oryzae ( P. oryzae) isolates and rice varieties including Chinese differential varieties, Japanese differential varieties, monogenic rice lines and landrace. Using the method of spraying inoculation and associational resistance and gene pyramiding analyses, the main results were as follows: (1) Under the Chinese differential varieties system, the P. oryzaeisolates from Kuiku 131, Kendao 12, Shangyu 397, and Ha 9811 were divided into ten, six, six, and nine physiological races respectively, and predominant physiological race of P. oryzaeisolates from Ha 9811 was ZF1 while the predominant physiological races of the other three groups of P. oryzaeisolates were all ZG1. (2) Under the Japanese differential varieties system, the P. oryzaeisolates from Kuiku 131, Kendao 12, Shangyu 397, and Ha 9811 were divided into 19, 11, 13, and 14 physiological races respectively, furthermore, the average disease incidence was 54.17%, 46.21%, 41.67%, and 59.90%, respectively. (3) Under the monogenic rice lines system, the P. oryzaeisolates from Kuiku 131, Kendao 12, Shangyu 397 and Ha 9811 were divided into 20, 11, 12, and 16 pathogenic types respectively, additionally, their similarity coefficient of pathogenicity was 0.20-0.87, 0.25-0.90, 0.25-1.00, and 0.31-0.88, respectively. (4) Under the landrace system, the P. oryzaeisolates from Kuiku 131, Kendao 12, Shangyu 397, and Ha 9811 were divided intotwelve, sever, nine and thirteen pathogenic types respectively, with the best blast-resistance varieties of Longdun 104, Songjing 6, Songjing 9, and Longdao 7. (5) Using the method of associational resistance, the average associational resistance coefficient and associational pathogenicity coefficient were 0.71-0.92 and 0-0.08, respectively; Using the method of gene pyramiding, the number of immunity gene combination to the P. oryzaeisolates from Kuiku 131, Kendao 12, Shangyu 397, and Ha 9811 were two, two, five and seven. In conclusion, using monogenic rice lines to research the pathogenicity of P. oryzae is better than using other appraisal systems. And good effects can be get from two resistance improvement methods, but both of them have their advantages and disadvantages.
稻瘟病是由稻瘟病菌(无性态为稻梨孢菌, Pyricularia oryzae)引起的一种侵染性病害, 也是黑龙江省水稻生产中重要病害之一, 常年产量损失在5.00%以上。据不完全统计, 1964— 2013年黑龙江省稻瘟病累计大发生13次, 损失稻谷600万吨以上[1]。2006年, 空育131等多个水稻品种发病, 发病面积超过66.7万公顷, 产量损失巨大[2]。稻瘟病菌作为Flor “ 基因对基因” 假说[3]的模式真菌之一, 其致病性受异核现象、准性重组等遗传机制影响, 变异频繁, 这给水稻种质利用自身抗性, 实现合理布局及区域抗瘟育种提供了可行性。因此, 在获得稻瘟病菌致病性具体信息前提下, 可以通过上述方式实现病害生态控制, 科学环保。
目前, 关于稻瘟病菌致病性研究, 报道很多。在研究方式上, 多以中国鉴别品种[4]、日本鉴别品种[5]或水稻单基因系品种[6]为鉴定体系, 个别研究者也曾利用当地水稻品种为鉴别体系。在研究靶标方面, 多以某一区域内稻瘟病菌为靶标。刘志恒等[7]应用中国鉴别品种将辽宁省148个稻瘟病菌株划分为7群39个生理小种, 确定了ZA1号小种的优势地位; 马军韬等[8]应用日本清泽鉴别品种将黑龙江省178个稻瘟病菌株划分为104个生理小种, 确定了077.7号小种的优势地位; 杨秀娟等[9]应用水稻单基因系品种对福建省87个稻瘟病菌株进行了致病性测定, 明确了无毒基因AvrPid-2和AvrPik的高频率地位。此外, 肖丹凤等[10]、刘文德等[11]、李湘民等[12]也进行过类似研究。与此同时, 个别研究者也以源自同一哺育品种的稻瘟病菌为靶标展开过研究, 宋成艳等[13]应用中国鉴别品种将53个以空育131为哺育品种的稻瘟病菌株划分为7群16个生理小种, 确定了ZD1号小种的优势地位; 兰波等[14]应用中国鉴别品种和水稻单基因系品种将100个以丽江新团黑谷为哺育品种的稻瘟病菌株划分为3群11个生理小种, 确定了ZA1号小种的优势地位, 同时确定了AvrPiz-t和AvrPik的高频率地位。过往的相关研究, 分别在不同时期、不同地域对稻瘟病的合理防控起到了积极的促进作用, 虽研究角度各有不同, 但多数研究在方式上尚略显单一。
本研究选用的稻瘟病菌哺育品种具有产量高、品质优和成熟期短等优点, 在黑龙江省累计推广面积很大, 后代血缘种质分布广泛。明确其病菌的致病性对指导生产益处很大。因此, 本文以4个遗传背景不同的稻瘟病菌株群为研究靶标, 运用4种鉴定体系较全面地分析其致病性及鉴定品种的抗性情况, 以期为相关研究提供理论借鉴。
供试水稻: 品种51份, 包括中国鉴别品种7份, 分别为特特普、珍龙13、四丰43、东农363、关东51、合江18和丽江新团黑谷; 日本清泽鉴别品种12份, 分别为新2号、爱知旭、藤坂5号、草笛、梅雨明、福锦、K1、Pi-4号、砦1号、K60、BL1和K59; 水稻单基因系品种24份, 各含有1个已知抗瘟基因, 分别为IRBLa-A (Pi-a)、IRBLi-F5 (Pi-i)、IRBLks-S (Pi-ks)、IRBLk-Ka (Pi-k)、IRBLkp-K60 (Pi-kp)、IRBLkh-K3 (Pi-kh)、IRBLz-Fu (Pi-z)、IRBLz5- CA (Pi-z5)、IRBLzt-T (Pi-zt)、IRBLta-K1 (Pi-ta)、IRBLb-B (Pi-b)、IRBLt-K59 (Pi-t)、IRBLsh-S (Pi-sh)、IRBL1-CL (Pi-1)、IRBL3-CP4 (Pi-3)、IRBL5-M (Pi-5)、IRBL7-M (Pi-7)、IRBL9-W (Pi-9)、IRBL12-M (Pi-12)、IRBL19-M (Pi-19)、IRBLkm-Ts (Pi-km)、IRBL20-IR24 (Pi-20)、IRBLta2-Pi (Pi-ta2)和IRBL11-Zh (Pi-11); 当地水稻品种8份, 分别为松粳6号、松粳9号、龙稻4号、龙稻7号、绥粳4号、垦稻12、龙盾104和空育131。
供试稻瘟病菌株为目前黑龙江省水稻生产上常见的60株, 具有较强致病力, 分别来源于2009— 2011年黑龙江省各积温区。其中, 以空育131为哺育品种的稻瘟病菌株20株, 来源于黑龙江省第3积温区, 由字母A开头。以垦稻12为哺育品种的稻瘟病菌株11株, 来源于黑龙江省第2积温区, 由字母B开头。以上育397为哺育品种的稻瘟病菌株13株, 来源于黑龙江省第3积温区, 由字母C开头。以哈9811为哺育品种的稻瘟病菌株16株, 来源于黑龙江省第2积温区, 由字母D开头。
使用燕麦片番茄汁培养基分离与活化菌株, 每升培养基中含燕麦片30 g、番茄汁150 mL、琼脂17~20 g; 供菌株产孢使用高粱粒培养基[15]。
经无菌水清洗后, 浸泡4 h, 25℃培养至产生霉层, 镜检后挑取单个分生孢子点接于燕麦片番茄汁培养基上, 25℃培养3 d左右, 将菌丝块挑入装有高粱粒培养基的三角瓶中, 25℃培养25 d左右, 无菌水洗脱高粱粒表面菌丝, 平铺在无菌铁托盘中, 盖上无菌纱布, 待高粱粒表面形成大量分生孢子后, 以0.025%的吐温-20水洗下孢子, 血球计数板计数, 将孢子悬浮液浓度调至3× 105个孢子 mL-1, 用于接种[15]。
通过幼苗三叶一心期喷雾接种方式分析稻瘟病菌致病性及水稻品种抗性。以育秧盘育苗, 每个品种保苗15株, 3次重复。待幼苗长至三叶一心时, 使用孢子悬浮液接种, 剂量为每盘100 mL。然后在26℃、相对湿度100%条件下暗培养30 h, 光照培养120~144 h, 发病完全后, 按下列标准调查[16, 17]。病情分为6级, 0为无任何病斑; 1为褐色病斑, 直径小于0.50 mm; 2为褐色病斑, 直径为0.50~1.00 mm; 3为椭圆形病斑, 直径为1.00~3.00 mm, 周围褐色, 中央灰白色; 4为纺锤形病斑, 直径3 mm以上, 病斑无融合或略微融合; 5同4, 但由于病斑融合, 叶片上半部枯死。统计分析时, 将0~3级归为抗病反应型, 4~5级归为感病反应型。各重复间如果抗、感反应型不一致, 按感病反应型统计。
稻瘟病菌致病力用致病率表示, 致病率 = (致病菌株数/总菌株数) × 100%。
水稻品种抗性用抗性频率表示, 抗性频率 = (非致病菌株数/总菌株数) × 100%。
用稻瘟病菌致病性相似度聚类分析方式评价病菌致病性分化情况, 菌株间致病性相似度用致病性相似系数表示。将水稻品种与稻瘟病菌的反应型作为性状, 抗病反应型记为“ 1” , 感病反应型记为“ 0” , 构成二态性状。利用DPS v7.05分析软件, 以UMPGA法进行聚类分析[18]。相似系数=1-相异系数。
水稻品种搭配种植后的抗性用联合抗病性方式[19, 20]分析, 其包括联合抗病性系数和联合致病性系数2个评价指标, 以联合抗病性系数最大的同时联合致病性系数最小为最佳搭配原则。联合抗病性系数=组合中共同非致病菌株数/总菌株数; 联合致病性系数=组合中共同致病菌株数/总菌株数。
基因聚合后抗性用聚合后抗性频率表示, 聚合后抗性频率=100%× (总菌株数-聚合后共同致病菌株数)/总菌株数。
应用Microsoft Excel 2010软件统计与计算数据。
表1和表2表明, 依据接种后中国鉴别品种对供试各菌株抗、感反应型的不同, 源自空育131的菌株被划分为4个群10个生理小种, ZA群为优势菌群, 出现频率为40.00%, ZG1号小种为优势小种, 出现频率为25.00%, ZA1和ZA9号小种为强毒力小种; 菌株致病率介于14.29%~100.00%, 平均值为44.29%, 强毒力菌株为A-11和A-2; 中国鉴别品种抗性频率介于0~90.00%, 平均值为55.71%, 珍龙13抗性最强, 丽江新团黑谷无抗性。
| 表1 中国和日本鉴别品种对稻瘟病菌株生理小种鉴定分析 Table 1 Physiological race identification of P. oryzae isolates using Chinese and Japanese differential varieties |
源自垦稻12的菌株被划分为3个群6个生理小种, ZE群和ZG群为优势菌群, 出现频率均为36.36%, ZG1号小种为优势小种, 出现频率为36.36%, ZA17和ZA33号小种为强毒力小种; 菌株致病率介于14.29%~85.71%, 平均值为38.96%, 强毒力菌株为B-9和B-10; 中国鉴别品种抗性频率介于0~90.91%, 平均值为61.04%, 珍龙13和四丰43抗性最强, 丽江新团黑谷无抗性。
源自上育397的菌株被划分为4个群6个生理小种, ZE群为优势菌群, 出现频率为38.46%, ZG1号小种为优势小种, 出现频率为30.77%, ZD1号小种为强毒力小种; 菌株致病率介于14.29%~57.14%, 平均值为30.77%, 强毒力菌株为C-11; 中国鉴别品种抗性频率介于0~100.00%, 平均值为69.23%, 特特普、珍龙13和四丰43抗性最强, 丽江新团黑谷无抗性。
| 表2 中国鉴别品种对稻瘟病菌株的抗性频率分析 Table 2 Resistance frequency of Chinese differential varieties to P. oryzae isolates (%) |
源自哈9811的菌株被划分为3个群9个生理小种, ZF群为优势菌群, 出现频率为50.00%, ZF1号小种为优势小种, 出现频率为50.00%, ZA17号小种为强毒力小种; 菌株致病率介于14.29%~85.71%, 平均值为41.96%, 强毒力菌株为D10; 中国鉴别品种抗性频率介于0~100.00%, 平均值为58.04%, 四丰43抗性最强, 丽江新团黑谷无抗性。
表1和表3表明, 依据接种后日本清泽鉴别品种对供试各菌株抗、感反应型的不同, 源自空育131的菌株被划分为19个生理小种, 017.4号小种出现频率略高, 为10.00%, 377.7号小种为强毒力小种; 菌株致病率介于16.67%~91.67%, 平均值为54.17%, 强毒力菌株为A-11; 日本清泽鉴别品种抗性频率介于15.00%~85.00%, 平均值为45.83%, 砦1号抗性最强, 新2号和K59抗性最差。
源自垦稻12的菌株被划分为11个生理小种, 每个菌株为1个小种, 377.3号和177.7号小种为强毒力小种; 菌株致病率介于16.67%~83.33%, 平均值为46.21%, 强毒力菌株为B-9和B-10; 日本清泽鉴别品种抗性频率介于18.18%~100%, 平均值为53.79%, 砦1号抗性最强, 新2号抗性最差。
| 表3 日本鉴别品种对稻瘟病菌株的抗性频率分析 Table 3 Resistance frequency of Japanese differential varieties to P. oryzae isolates (%) |
源自上育397的菌株被划分为13个生理小种, 每个菌株为1个小种, 177.3号小种为强毒力小种; 菌株致病率介于8.33%~75.00%, 平均值为41.67%, 强毒力菌株为C-5; 日本清泽鉴别品种抗性频率介于23.08%~100.00%, 平均值为58.33%, 砦1号抗性最强, 新2号和草笛抗性最差。
源自哈9811的菌株被划分为14个生理小种, 237.7号和436.5号小种出现频率略高, 均为12.50%, 377.7号和777.5号小种为强毒力小种; 菌株致病率介于8.33%~91.67%, 平均值为59.90%, 强毒力菌株D10和D8; 日本清泽鉴别品种抗性频率介于6.25%~ 81.25%, 平均值为40.10%, 砦1号抗性最强, 爱知旭抗性最差。
表4表明, 依据接种后水稻单基因系品种对供试各菌株抗、感反应型的不同, 源自空育131的菌株被划分为20个致病型, 每个菌株为1个致病型; 菌株致病率介于20.83%~91.67%, 平均值为57.08%, 强毒力菌株为A-18和A-11; 菌株间致病性相异系数介于0.13~0.80, 转换成相似系数后介于0.20~0.87, 菌株A-5和A-6致病性相似度最高; 在源自空育131的菌株中, 与24个抗瘟基因相对应的无毒基因全部出现, 总出现频率为206次, 单个菌株含有无毒基因数量介于3~21个, 平均值为10.30个, 无毒基因AvrPiz- 5和AvrPi9出现频率较高, 分别占总出现频率的9.22%和8.74%; 水稻单基因系品种抗性频率介于5.00%~95.00%, 平均值为42.92%, IRBLz5-CA (Pi-z5)抗性最强, IRBLkp-K60 (Pi-kp)抗性最差。
源自垦稻12的菌株被划分为11个致病型, 每个菌株为1个致病型; 菌株致病率介于33.33%~95.83%, 平均值为60.61%, 强毒力菌株为B-9和B-10; 菌株间致病性相似系数介于0.25~0.90, 菌株B-5和B-11致病性相似度最高; 在源自垦稻12的菌株中, 24个无毒基因全部出现, 总出现频率为104次, 单个菌株含有无毒基因数量介于1~16个, 平均值为9.45个, 无毒基因AvrPiz-5和AvrPi9出现频率较高, 均占总出现频率的9.62%; 水稻单基因系品种抗性频率介于0~90.91%, 平均值为39.39%, IRBLz5-CA (Pi-z5)和IRBL9-W (Pi-9)抗性最强, IRBLi-F5 (Pi-i)和IRBL19-M (Pi-19)抗性最差。
源自上育397的菌株被划分为12个致病型, 菌株C9和C11为1个致病型, 其余每个菌株为1个致病型; 菌株致病率介于20.83%~87.50%, 平均值为60.58%, 强毒力菌株为C7; 菌株间致病性相似系数介于0.25~1.00, 菌株C-9和C-11致病性相似度最高; 在源自上育397的菌株中, 24个无毒基因全部出现, 总出现频率为123次, 单个菌株含有无毒基因数量介于3~19个, 平均值为9.46个, 无毒基因AvrPi9、AvrPiz-5和AvrPib出现频率较高, 分别占总出现频率的10.57%、8.94%和8.94%; 水稻单基因系品种抗性频率介于0~100.00%, 平均值为39.42%, IRBL9-W (Pi-9)抗性最强, IRBLa-A (Pi-a)、IRBLks-S (Pi-ks)和IRBLkp-K60 (Pi-kp)抗性最差。
| 表4 水稻单基因系品种对稻瘟病菌株的抗性频率分析 Table 4 Resistance frequency of monogenic rice lines to P. oryzae isolates (%) |
源自哈9811的菌株被划分为16个致病型, 每个菌株为1个致病型; 菌株致病率介于12.50%~ 91.67%, 平均值为59.38%, 强毒力菌株为D2、D10和D8; 菌株间致病性相似系数介于0.31~0.88, 菌株D-7和B-13致病性相似度最高; 在源自哈9811的菌株中, 24个无毒基因全部出现, 总出现频率为156次, 单个菌株含有无毒基因数量介于2~21个, 平均值为9.75个, 无毒基因AvrPiz-5和AvrPi9出现频率较高, 分别占总出现频率的9.62%和8.97%; 水稻单基因系品种抗性频率介于6.25%~93.75%, 平均值为40.63%, IRBLz5-CA (Pi-z5)基因抗性最强, IRBLi-F5 (Pi-i)和IRBLta-K1 (Pi-ta)基因抗性最差。
表5表明, 依据接种后当地水稻品种对供试各菌株抗、感反应型的不同, 源自空育131的菌株被划分为12个致病型, A-1等5个菌株组成优势致病型, A-2等4个菌株组成亚优势致病型; 菌株致病率介于12.50~100.00%, 平均值为32.50%, 强毒力菌株为A-18和A-11; 当地水稻品种抗性频率介于0~ 90.00%, 平均值为67.50%, 龙盾104抗性最强, 空育131无抗性。
源自垦稻12的菌株被划分为7个致病型, B-1等5个菌株组成优势致病型; 菌株致病率介于25.00%~ 100.00%, 平均值为42.05%, 强毒力菌株为B-9和B-10; 当地水稻品种抗性频率介于0~81.82%, 平均值为57.95%, 松粳6号和龙盾104抗性最强, 垦稻12无抗性。
源自上育397的菌株被划分为9个致病型, C-2等3个菌株组成优势致病型; 菌株致病率介于0~ 87.50%, 平均值为25.96%, 强毒力菌株为C11和C9; 当地水稻品种抗性频率介于38.46%~92.31%, 平均值为74.04%, 松粳9号和龙盾104抗性最强, 空育131抗性最低。
| 表5 当地水稻品种对稻瘟病菌株的抗性频率分析 Table 5 Resistance frequency of local rice varieties to P. oryzae isolates (%) |
源自哈9811的菌株被划分为13个致病型, 无明显优势致病型; 菌株致病率介于12.50%~100.00%, 平均值为37.50%, 强毒力菌株为D10; 当地水稻品种抗性频率介于12.50%~93.75%, 平均值为62.50%, 龙稻7号抗性最强, 空育131抗性最低。
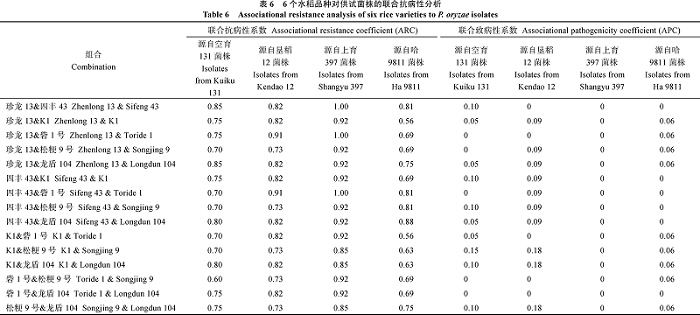
| 表 6 Table 6 |
从中国鉴别品种、日本鉴别品种及当地水稻品种中各选取2个综合抗性较好的水稻品种, 应用联合抗病性方式分析其搭配种植后的抗性效果(表6)。2个水稻品种搭配后, 对源自空育131、垦稻12、上育397和哈9811的菌株的联合抗病性系数平均值分别为0.74、0.80、0.92和0.71, 联合致病性系数平均值分别为0.06、0.08、0和0.04。针对源自空育131的菌株, 无最佳组合。其中, 联合抗病性系数最高的是珍龙13& 四丰43组合与珍龙13& 龙盾104组合, 联合抗病性系数最低的是珍龙13& 砦1号等5个组合; 针对源自垦稻12的菌株, 珍龙13& 砦1号为最佳组合; 针对源自上育397的菌株, 珍龙13& 四丰43、珍龙13& 砦1号和四丰43& 砦1号为最佳组合; 针对源自哈9811的菌株, 四丰43& 龙盾104为最佳组合。
从24个水稻单基因系品种中分别选取部分抗性较好的因子, 应用基因聚合方式分析其对哺育品种的抗性改良效果(表7)。4个类群菌株共涉及聚合基因11个, IRBLz5-CA (Pi-z5)和IRBL9-W (Pi-9)利用频率较高。其中, IRBLz5-CA (Pi-z5) & IRBL1-CL (Pi-1)组合和IRBLz5-CA (Pi-z5) & IRBLzt-T (Pi-zt)组合对源自空育131的菌株表现免疫, 说明水稻品种空育131聚合上述2个基因组合中的任何一个便可实现品种抗性的高效改良。此外, 对源自垦稻12、上育397和哈9811的菌株表现免疫的基因聚合方案各不相同, 涉及的基因组合分别为2个、5个和7个。
本文以4个遗传背景清晰、来源不同的稻瘟病菌株群为靶标进行致病性分析并探寻其解决方案, 较之区域内菌株致病性分析, 侧重点不同。兰波等[14]曾进行过相同遗传背景下稻瘟病菌株致病性分析, 但遗传背景仅有1个, 缺乏横向对比, 而且菌株的遗传背景来自普感品种丽江新团黑谷, 对病菌难以形成定向选择压力, 而本文供试菌株遗传背景较为丰富, 代表性偏强。以往致病性研究多以1~2种鉴别体系为主展开分析[7, 9], 本文研究应用了4种鉴定体系展开分析, 系统性较强。
从各鉴定体系对菌株的生理小种或致病型划分结果分析, 中国鉴别品种和当地水稻品种将菌株划分得略显粗糙; 日本清泽鉴别品种将菌株划分得相对细致, 但不足在于无法量化每个基因的准确抗性; 水稻单基因系鉴别品种由于含有基因较多, 致病型划分结果较好, 同时还可以量化每个基因的准确抗性。此外, 由于带有中、日鉴别品种血缘的水稻种质在黑龙江省具有一定的种植面积, 因此这2种鉴别体系的应用仍具有一定现实意义。
在本文研究条件下, 稻瘟病菌株致病力及水稻品种抗性均为相对概念, 与压力群体的选择有直接关系。从菌株整体致病力角度分析, 60株供试菌株对水稻单基因系品种的致病率平均值为59.10%, 致病力较强; 而相同的菌株对当地水稻品种的致病率平均值为34.17%, 致病力较弱。从不同菌株群的个体致病力角度分析, 针对中国鉴别品种、日本清泽鉴别品种、水稻单基因系品种和当地水稻品种等4个鉴定体系, 致病力最强的菌株类群分别为源自空育131的菌株、源自哈9811的菌株、源自垦稻12的菌株和源自垦稻12的菌株。从强毒力菌株致病力角度分析, 体系不同, 强毒力菌株的类型大多不同, 仅菌株A-11、B-9和B-10对4个鉴定体系的水稻品种表现出较强的整体致病力, 成为超级毒力小种。从菌株的整体致病性分化角度分析, 在水稻单基因系品种体系下, 源自空育131的菌株致病性相似系数介于0.20~0.87, 差值为0.67, 源自垦稻12、上育397和哈9811的菌株致病性相似系数差值分别为0.65、0.75和0.57, 侧面说明各菌株群的致病性分化在程度上有一定差别, 但不显著。
从水稻品种的整体抗性角度分析, 当地水稻品种对全部供试菌株的抗性频率平均值为65.83%, 表现出较高的抗性, 中国鉴别品种和日本鉴别品种的抗性居中, 水稻单基因系品种抗性频率平均值为40.90%, 表现出较低的抗性。这可能与不同鉴别水稻品种含有抗瘟基因多寡有一定关系。针对不同菌株群, 中国鉴别品种对源自垦稻12菌株抗性最高, 当地水稻品种对源自空育131、上育397和哈9811菌株抗性均最高。
在联合抗病性方式下, 选择推广品种进行搭配分析, 主要原因是该群体品种综合性状及产量较好, 操作性强。2个水稻品种搭配后, 对源自空育131、垦稻12、上育397和哈9811的菌株的联合抗病性系数平均值均在0.70以上, 联合致病性系数平均值均在0.10以下, 说明品种搭配后抗性提升效果明显, 可以实行品种替换, 这一研究结论与马辉刚等[15]的研究结论类似。但是, 从黑龙江省生产现状分析, 有2个问题需要商榷: (1)在进行搭配的品种中, 存在籼稻品种, 黑龙江省的水稻生产一直以粳稻品种为主, 其适应性可能偏差; (2)黑龙江省存在不同的积温区, 搭配品种的成熟期不一定适合当地生产, 需要通过特殊的栽培方式调节, 生产成本可能增加。
在基因聚合方式下, 选择水稻单基因系品种进行聚合分析, 主要原因是该群体品种携带基因类型明确, 后期检测迅捷, 利于加速改良进程。在聚合1个基因前提下, 各类群90%以上菌株失去侵染能力(表4), IRBLz5-CA (Pi-z5)和IRBL9-W (Pi-9)利用频率最高。在聚合2个基因前提下, 各类群菌株全部失去侵染能力(表7)。就抗性提升效果而言, 2个单抗性最高的基因聚合后其综合抗性并不一定最佳, 这可能跟抗瘟基因与菌株的互作反应型。此外, 由于基因聚合方式涉及育种程序, 周期偏长, 是其不足之处。
从抗瘟基因的利用方面分析, 如果能进一步引进优质抗源, 黑龙江省水稻的抗性改良及抗性育种工作将获得更多的选择性, 整体抗性也将进一步提升。截至目前, 国内外共发现各类抗瘟基因101个[21, 22, 23, 24, 25, 26, 27, 28, 29, 30], 但明确获得水稻单基因系载体的仅30个左右, 大多数基因的抗性由于缺乏载体而难以评价, 客观上制约了相关工作的深入开展。
在应用的中国鉴别品种、日本清泽鉴别品种、水稻单基因系品种和当地水稻品种4套鉴定体系中水稻单基因系品种体系对稻瘟病菌株致病性划分更为细致, 各抗瘟基因的抗性利用价值更为明确, 可将当地病菌的致病性分析由品种水平提升至基因水平, 效果较好; 应用的联合抗病性和基因聚合抗性改良方式效果都较好, 但具体应用条件不同, 在病害可能大规模、急速发生的前提下, 建议应用品种搭配种植方式, 否则建议应用基因聚合方式。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|