第一作者联系方式: E-mail: cyahui616@163.com, Tel: 13675121345
酸性土壤中的铝毒害是限制作物生长和产量的主要因素之一。拟南芥中的AtSTOP1 ( Arabidopsis thaliana sensitive to proton rhizotoxicity 1)是一个调控多种铝毒耐受机制相关基因表达的转录因子, 在拟南芥耐铝毒中发挥重要作用。为研究大豆中 STOP1-like基因的表达特性, 本研究利用RT-PCR从耐铝毒大豆品种科丰1号中克隆了一个位于第16染色体的 STOP1-like基因, 命名为 GmSTOP1。该基因的编码区(coding DNA sequence, CDS)序列长度为1566 bp, 编码521个氨基酸。在 GmSTOP1起始密码子上游1500 bp的核苷酸序列区间预测到多种顺式作用元件, 包括与激素、热、逆境响应等相关的应答元件, 如ABRE、HSE、TC-rich重复序列等。蛋白质结构预测表明GmSTOP1不具有跨膜结构和信号肽, 含有4个保守的Cys-2-His-2锌指蛋白结构域。系统进化分析显示GmSTOP1与菜豆( Phaseolus vulgaris)中的STOP1-like蛋白亲缘关系较近。亚细胞定位结果显示GmSTOP1定位于细胞核, 说明GmSTOP1蛋白可能在细胞核中发挥其功能。 GmSTOP1基因在种子中的相对表达量最高, 在根、茎尖分生组织、茎、叶、花、荚等多种组织中也均有表达。用25 μmol L-1 AlCl3溶液处理大豆幼苗, GmSTOP1基因在根中上调表达, 24 h达到最高相对表达量, 约为对照(0 μmol L-1 AlCl3)的9.2倍, 表明该基因的表达受铝离子的诱导。此外, ABA、NaCl和PEG等胁迫也能诱导大豆根和叶中 GmSTOP1基因的上调表达。由此推测 GmSTOP1基因可能参与大豆对铝毒、高盐和渗透等非生物胁迫的应答过程。
Aluminum toxicity is one of the major factors that limits the growth and production of crops in acid soils. AtSTOP1 transcription factor can regulate the expression of genes related to aluminum-toxicity tolerance mechanisms, which plays an important role in aluminum-toxicity tolerance in Arabidopsis. To study the expression features of the STOP1-like gene in soybean, we cloned a STOP1 gene located on chromosome 16 from the aluminum-toxicity tolerant soybean cultivar (Kefeng-1) using RT-PCR, and designated as GmSTOP1. The length of GmSTOP1coding DNA sequence was 1566 bp, which encoded 521 amino acid residues. Diverse cis-acting promoter elements involved in hormone, heat and stress responses were discovered in the 1500 bp upstream region of GmSTOP1, such as ABRE, HSE, TC-rich repeats, and other elements. Protein structure prediction showed that it did not have any signal-peptide or transmembrane region, but contained four conservative Cys-2-His-2 zinc-finger domains. Phylogenetic analysis demonstrated that GmSTOP1 was similar to the putative STOP1-like protein from Phaseolus vulgaris. Results of subcellular localization showed that GmSTOP1 protein is located in the cell nucleus. The transcripts of GmSTOP1 were detected in all organs tested including root, shoot apical meristem, stem, leaf, flower, pod and seed, with the highest level in seed. GmSTOP1 was up-regulated in soybean roots by 25 μmol L-1 AlCl3 treatment, and reached the highest relative expression level at 24 hours, which was about 9.2 times of the level in control (0 μmol L-1 AlCl3). In addition, Real-time PCR analysis showed that the expression of GmSTOP1 in soybean leaf and root was also up-regulated by ABA, NaCl, and PEG, respectively. These results indicated that GmSTOP1 might participate in soybean response to abiotic stresses including aluminum-toxicity, high salinity and osmosis stress, which provides the basis for further studying the functions of GmSTOP1.
大豆作为优质蛋白质食品和植物油的重要来源, 一直是世界各国不容忽视的作物之一[1]。中国是大豆的发源地, 我国南方大豆产区地域辽阔, 自然条件优越, 是我国大豆的主要产区之一。我国长江以南热带、亚热带地区主要为红色或黄色的酸性土壤, 总面积达1.28亿公顷, 占全国土地总面积的22.7%, 占全国耕地面积的28%[2]。酸性土壤中活性A13+产生的铝毒害会显著抑制植物的根系生长, 进而抑制地上部分的生长, 是限制作物生长和产量的主要因素之一[3, 4]。近年来随着酸雨发生频率变高及酸性和生理酸性肥料的大量施用, 使得土壤酸度进一步加剧[5], 铝毒害已经成为南方酸性土壤中大豆生长发育的重要限制因素[6, 7]。因此, 在降低土壤酸度的同时, 挖掘大豆自身的耐铝毒潜力和耐铝毒基因, 获得耐铝毒能力强的大豆品种是解决酸性土壤中铝毒害最有效的方法[4]。
随着基因组学、蛋白质组学和生物信息学的发展, 人们进行了大量关于植物抵御铝毒害的生理机制研究, 并且逐渐向分子水平深入。Iuchi等[8, 9]发现对根际H+毒害敏感的拟南芥stop1突变体对Al3+也极敏感, 这一现象是一个含有4个锌指蛋白结构域的C2H2型锌指蛋白转录因子STOP1 (sensitive to proton rhizotoxicity 1)的功能受到抑制所致。在拟南芥stop1突变体中, 编码铝诱导的苹果酸通道蛋白AtALMT1 (aluminum-activated malate transporter 1)[10]的基因表达及苹果酸分泌受到抑制[8]。在拟南芥STOP1-KO突变体中, 不仅与耐铝毒相关的柠檬酸分泌通道蛋白AtMATE (multidrug and toxic compound extrusion)[11]基因和ABC通道蛋白ALS3[12](aluminum sensitive 3)基因的表达受到抑制, 而且与H+毒害耐受机制相关基因的表达和柠檬酸的分泌也会被抑制[13, 14]。由此可见, STOP1基因是通过调控铝毒耐受机制和H+毒害耐受机制相关基因的表达, 使植物具有对铝毒和H+毒害的耐性。随后, Yamaji等[15]通过突变体分析在水稻中发现一个与STOP1类似的锌指蛋白基因OsART1(Oryza sativa aluminum resistance transcription factor 1), 它可调控30多种耐铝毒基因的表达, 增强水稻对铝毒的抗性。Ohyama等[16]利用RNAi技术沉默NtSTOP1基因后发现烟草(Nicotiana tabacum)根对铝毒和H+毒害的耐性、铝胁迫下的根部柠檬酸分泌量、ALS3等耐铝毒相关基因的表达均受到抑制; 将百脉根(Lotus japonicas)、小立碗藓(Physcomitrella patens)、野茶树(Camellia sinensis)、黑杨(Populus nigra)中的STOP1-like基因分别转入拟南芥突变体stop1中过表达, 都能激活AtALMT1、AtMATE和ALS3等基因恢复表达, 但不同物种STOP1同源基因的激活能力有很大差别。Sawaki等[17]在桉树(Eucalyptus robusta)中也克隆了调控耐铝相关基因的STOP1-like蛋白基因。
综上所述, 多个物种中与AtSTOP1同源的基因都可通过调控耐铝毒基因的表达提高植物对铝毒害的耐性, 而在大豆中还未见有关STOP1-like基因的克隆和表达分析的报道。本研究根据已经报道的拟南芥AtSTOP1序列, 通过RT-PCR从耐铝毒大豆品种科丰1号中克隆到一个位于第16染色体的STOP1- like基因(Glyma16g27280), 命名为GmSTOP1。利用生物信息学分析该基因及其上游启动子序列, 并通过实时定量PCR分析其在不同组织、铝胁迫及几种常见的非生物胁迫下的表达特性, 以期为进一步揭示GmSTOP1基因的功能、利用大豆耐铝毒基因来提高大豆耐铝毒的能力提供参考依据。
耐铝毒大豆品种科丰1号由南京农业大学国家大豆改良中心种质库提供。将种子播于洁净河沙内, 置于人工气候箱(16 h光/8 h暗, 28℃白天/25℃夜间, 相对湿度为70%)内, 待萌发后子叶刚刚变绿(4 d), 移栽至1/2 Hoagland营养液(pH 5.8)的水培体系中, 10 d后将幼苗转移至添加100 μ mol L-1 ABA、200 mmol L-1 NaCl或20% PEG-6000的营养液中进行处理。分别于0、3、6、12、24、48和72 h对叶和根取样。将沙培3 d后幼苗转移至0.5 mmol L-1 CaCl2溶液(pH 4.3)适应24 h, 以25 μ mol L-1 AlCl3 (pH 4.3)处理6、12、24、48和72 h, 取根尖作为样品。以未经处理正常生长的幼苗作为对照。样品迅速保存于液氮备用。每个处理3次生物学重复。
参照离心柱型植物总RNA快速提取试剂盒(TIANGEN, 北京)说明书提取叶片和根的总RNA。使用TaKaRa公司的PrimeScript 1st Strand cDNA Synthesis Kit试剂盒, 参照说明书反转录合成cDNA第1链。
1.3.1 大豆GmSTOP1基因的克隆
利用已报道的拟南芥AtSTOP1蛋白序列, 在Phytozome大豆基因组数据库中进行BlastP搜索, 获得大豆同源基因Glyma16g27280的cDNA及氨基酸序列。根据cDNA序列用Premier 5.0设计引物(表1)并合成。用高保真酶PrimeSRAR HS DNA Polymerase进行基因扩增, 切胶回收目的条带(琼脂糖凝胶回收试剂盒购自Axygen公司), 与pMD19-T Vector连接, 转化大肠杆菌感受态细胞, 挑取阳性克隆由上海英潍捷基生物技术公司测序。
| 表1 试验所用引物 Table 1 Primers used in this study |
1.3.2 GmSTOP1生物信息学分析
用ProtParam (http://web.expasy.org/protparam/)预测蛋白质分子量和理论等电点; 用TMHMM (http://www.cbs.dtu. dk/services/TMHMM-2.0/)分析蛋白跨膜结构域; 运用SignalP (http://www.cbs.dtu.dk/services/SignalP/)进行信号肽分析; 利用SOPMA软件预测其二级结构; 利用SoyKB搜索GmSTOP1基因的启动子序列, 并通过PlantCARE (http://bioinformatics.psb.ugent. be/webtools/plantcare/html/)在线网站进行启动子元件分析; 用SMART (http://smart.embl-heidelberg.de/ smart/show_motifs.pl/)进行保守域分析; 用DNAMAN进行多序列氨基酸比对; 用MEGA 5.0软件中的邻近相连法构建系统进化树; 用WOLF PSORT (http://wolfpsort.org/)进行亚细胞定位预测。
1.4.1 载体的构建
以GmSTOP1-GFP-F/GmSTOP1- GFP-R为引物(表1), 扩增GmSTOP1基因, 切胶回收扩增产物, 用Sal I和BamH I酶切扩增产物和pJIT166-GFP质粒(国家大豆改良中心保存); 最后, 把酶切回收的PCR产物和质粒酶切片段连接, 构建载体pJIT166-GmSTOP1-GFP, 转入大肠杆菌DH5α , 然后进行菌液PCR、酶切筛选阳性克隆, 并对阳性克隆进行测序验证。
1.4.2 拟南芥原生质体制备和pJIT166-GmSTOP1- GFP转化
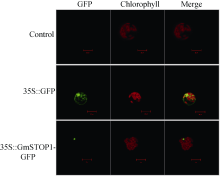
根据Yoo等[18]方法制备和转化拟南芥原生质体。使用Axygen无内毒素大提质粒试剂盒制备质粒。在23℃培养转化后原生质体15 h, 用激光共聚焦显微镜(Leica TCS SP2)检测GFP信号。GFP的激发波长488 nm。为观测叶绿体荧光, 同时使用488 nm激发波长进行双通道观测, 检测的发射波长分别为514 nm和633 nm。
2.1.1 GmSTOP1全长cDNA克隆与序列分析
克隆得到的GmSTOP1序列与数据库中Glyma16 g27280的CDS序列完全一致。序列分析表明, GmSTOP1基因的ORF (open reading frame)全长1566 bp, 编码521个氨基酸残基, 预测分子量为57.5 kD, 理论等电点为5.82。以TMHMM软件预测GmSTOP1不具有跨膜结构, SignalP预测结果显示GmSTOP1没有信号肽。二级结构预测结果显示α -螺旋占18.04%, β -转角占9.98%, 延伸链占15.36%, 无规则卷曲占56.62%。
2.1.2 GmSTOP1基因的上游启动子分析
对位于GmSTOP1基因起始密码子ATG的5° 区上游1500 bp的启动子核苷酸序列进行分析, 预测到多种顺式作用元件(表2), 包括与光响应、激素响应、热响应、逆境响应、细胞周期、代谢调节及器官发育等相关的元件。
2.1.3 GmSTOP1蛋白的结构域分析和系统进化分析
将GmSTOP1蛋白序列与已报道的几个物种的STOP1-like蛋白进行多重序列比对, 发现含有4个与AtSTOP1等STOP-like蛋白高度同源的Cys-2-His-2锌指蛋白结构域(图1), 说明STOP1蛋白在进化中具有保守性。系统进化树(图2)表明, GmSTOP1与菜豆中预测的STOP1-like蛋白(Pv:XP_ 007151889.1)亲缘关系最近, 同源性达到87%。
 | 图1 GmSTOP1与其他植物STOP1的锌指结构域序列比对 Fig. 1 Alignment of zinc finger domains of GmSTOP1 and STOP1-like proteins from other plant species |
用WoLF PSORT软件进行亚细胞定位预测显示, GmSTOP1主要定位在细胞核内。利用拟南芥原生质体瞬时表达体系对GmSTOP1进行亚细胞定位试验的结果也显示融合蛋白的绿色荧光信号都集中在细胞核内(图3), 因此, 该蛋白可能在细胞核内发挥作用。
以耐铝毒大豆品种科丰1号萌发3 d后的根尖、14 d苗龄(V2)的茎尖分生组织、18 d苗龄(V2)的茎和第一复叶、盛花期(R2)的花、鼓粒盛期(R6)的荚和成熟种子[21]的RNA反转录的cDNA为模板, 分析GmSTOP1基因的组织表达特异性。荧光定量PCR结果表明(图4), GmSTOP1基因在上述生育期均有表达, 但表达量存在差异, 以根中的表达量作对照, GmSTOP1在种子(SE)中表达量最高, 其次是第一复叶(L)、荚(P)、花(F)、茎(S)、茎尖分生组织(SAM)和根(R)。
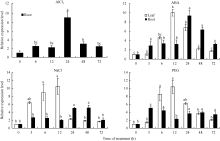
从图5可以看出, 分别以各时间点的未处理样品为对照, GmSTOP1基因对4种胁迫均有不同程度的响应。在AlCl3溶液处理的根中, GmSTOP1基因的表达量在24 h时出现峰值(AlCl3溶液处理根尖中的相对表达量约是对照的9.2倍), 48 h和72 h的表达量又恢复到6 h和12 h的表达水平。在ABA溶液处理的叶和根中, GmSTOP1基因的表达量分别在12 h和24 h达到高峰。在NaCl溶液胁迫的根中, GmSTOP1基因表达量在3 h出现一个小高峰后在24~48 h达到最大值; 在NaCl溶液胁迫的叶中, GmSTOP1基因的表达模式是先快速上升后急剧下降并保持在较低的表达水平。GmSTOP1基因在PEG溶液处理的根中表达模式与NaCl溶液胁迫比较相似, 而在叶中受PEG诱导后的相对表达量在3~12 h快速增加并达到最大值。上述结果表明GmSTOP1受铝毒、ABA、高盐、PEG等多种非生物胁迫的诱导表达。
| 表2 GmSTOP1基因上游调控区顺式作用元件 Table 2 cis-elements in the upstream regulation region of GmSTOP1 gene |
酸性(pH< 5)土壤中的铝主要以可溶性铝(Al3+)形式存在, 对大多数植物产生毒害作用。铝毒首先抑制植物根的正常生长和发育, 影响植物根系对水分和养分的吸收, 最终影响植物的生长和作物产量。因此酸性土壤中的铝毒害是限制农业生产中作物生长和产量的主要因素之一。挖掘耐铝毒基因、提高作物自身的耐铝毒能力, 是解决酸性土壤地区铝毒害最有效的方法。STOP1-like蛋白是一类含有C2H2型锌指结构域的转录因子, 在多种植物中可调控耐铝毒基因的表达提高植物对铝毒的耐性。拟南芥中与铝毒耐受机制相关的基因AtALMT1、ALS3和AtMATE均受到锌指蛋白转录因子AtSTOP1的调控[8, 13, 14]。水稻中的OsART1 (STOP1同源基因)也可调控OsSTAR1/2、OsMATE、Nrat1等30多种耐铝毒基因的表达[15]; 在烟草[16]、桉树[17]中STOP1-like蛋白也可以调控各自物种相应的耐铝毒基因MATE和ALS3。这些研究为我们探究大豆STOP1-like基因提供了参考依据和理论基础。
本研究克隆获得了大豆中一个STOP1-like基因, 命名为GmSTOP1。氨基酸序列分析表明, GmSTOP1含有4个与AtSTOP1和其他已报道的STOP-like蛋白高度同源的Cys-2-His-2锌指蛋白结构域。进化分 析表明大豆GmSTOP1与菜豆STOP1-like蛋白亲缘关系最近, 同源性达到87%, 与已有文献报道中的LjSTOP1 (百脉根)、PnSTOP1 (黑杨)、CsSTOP1 (野茶树)、EguSTOP1 (桉树)等STOP-like蛋白在进化上属于同一个分支, 与亲缘关系较远的PpSTOP1的同源性也有65%, 说明STOP1在不同物种间具有较高的保守性。拟南芥原生质体亚细胞定位试验结果显示GmSTOP1定位在细胞核, 说明GmSTOP1可能在细胞核中发挥作用, 与AtSTOP1[14]、OsART1[15]、EguSTOP1[17]的亚细胞定位结果相一致。由于铝毒首先抑制植物根尖的生长, 因此, 本研究选取铝处理后的大豆根尖进行荧光定量分析, 研究GmSTOP1基因在铝胁迫后的表达变化。结果表明GmSTOP1基因在AlCl3 (pH 4.3)处理后上调表达, 在24 h表达量达到最大值(铝处理的相对表达量约是对照的9.2倍), 与AtSTOP1的表达模式相似。Iuchi等[8]研究表明, H+和Al3+处理可以激活拟南芥根中AtSTOP1基因的表达。水稻中与AtSTOP1同源的OsART1基因的表达模式有所不同, Yamaji等[15]试验发现Al3+处理后水稻的根尖(0~10 mm)、根基部(10~20 mm)和茎中OsART1基因的相对表达量没有显著(Tukey’ s test P < 0.05)变化, 说明该基因的表达不受铝离子调节, 呈组成型表达的模式。AtSTOP1、OsART1、NtSTOP1、EguSTOP1等基因都是通过调控各自物种中相应耐铝毒基因的上调表达提高植物对铝毒害的耐性。本文结果表明AlCl3处理可以激活GmSTOP1基因的表达, 但GmSTOP1基因是否能提高大豆的耐铝毒能力还需进一步分析, 如构建植物表达载体转化拟南芥和大豆, 获得过表达或沉默GmSTOP1基因的植物并进行耐铝毒的表型鉴定, 以及铝处理下与耐铝毒相关基因(如ALMT1、MATE、ALS3等)的表达分析。
虽然目前还没有关于其他逆境胁迫下STOP1- like基因表达模式的研究报道, 但在GmSTOP1基因上游启动子区域发现多种与响应逆境胁迫和代谢调节等相关的顺式作用元件, 据此我们推测GmSTOP1基因可能不仅与大豆耐铝毒相关, 还可能参与大豆对其他逆境胁迫的应答反应。为验证此观点, 我们进一步对GmSTOP1基因在其他非生物胁迫下的表达模式进行分析。结果表明在ABA、NaCl和PEG等3种胁迫处理下, 大豆叶和根中的GmSTOP1基因都上调表达, 叶中GmSTOP1基因在12 h的相对表达量达到最大值(相对表达量均大于对照的10倍), 根中GmSTOP1基因的表达量峰值出现在24 h或48 h (相对表达量是对照的4~9倍), 推测GmSTOP1基因很可能与大豆响应高盐和渗透胁迫相关。
在耐铝毒大豆品种科丰1号中克隆了耐铝毒候选基因GmSTOP1, 该基因编码521个氨基酸, 预测分子量为57.5 kD, 理论等电点为5.82, 含有4个高度同源保守的Cys-2-His-2锌指蛋白结构域。GmSTOP1与菜豆中的STOP1-like蛋白亲缘关系较近。GmSTOP1蛋白被定位在细胞核。GmSTOP1在大豆多种组织中均有表达, 在AlCl3、ABA、NaCl和PEG等4种胁迫处理后大豆根和叶中的GmSTOP1基因均上调表达。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|