果皮厚度是影响甜玉米口感的一个重要因素。发掘果皮厚度的基因资源、了解玉米果皮厚度的遗传机制, 是指导其育种的基础。本研究以日超-1 (薄果皮, 56.57 μm) × 1021 (厚果皮, 100.23 μm)的190个BC1F2家系为作图群体, 分别采用2种遗传模型检测QTL。基于复合区间作图(CIM)共检测到3个影响果皮厚度的QTL, 位于3.01、6.01、8.05区段, 分别解释8.6%、16.0%和7.2%的表型变异, 其中3.01和8.05处QTL以加性效应为主; 基于混合线性CIM模型(MCIM)共检测到5个影响果皮厚度的QTL, 其中除8.05处QTL为加性QTL外, 另有2对加×加上位性互作QTL, 1对是2.01和6.05处QTL之间的互作, 另1对则是5.06和6.01处QTL间的互作。这2对互作QTL分别解释了6.63%和12.48%的表型变异率。本结果表明, 加性效应和上位性互作效应等都在果皮厚度的形成和遗传中起重要作用。能够检测QTL上位互作的MCIM模型更适用于果皮厚度QTL定位。本研究还在其中4个QTL的区域内分别检索到胚乳中色素合成以及细胞转变的相关候选基因, 这些基因的表达是否与果皮厚度的变异有关值得进一步研究。
Pericarp thickness is of great importance to the sensory quality of sweet corn. Mining the gene for pericarp thickness and understanding its genetic mechanism can provide a base for instructing breeding. Quantitative trait locus (QTL) for pericarp thickness was detected based on two genetic models using a population comprising 190 BC1F2 families derived from the cross of Richao-1 (thin pericarp, 56.57 μm) ×1021 (thick pericarp, 100.23 μm) in the present study. Three QTLs for pericarp thickness were identified on bin 3.01, 6.01, and 8.05 using the Composite interval mapping (CIM) method, explained 8.6%, 16.0%, and 7.2% of phenotypic variation, respectively. Based on the MCIM (mixed-model based CIM) method, we identified five QTLs for pericarp thickness, comprising one additive QTL and two pairs of epistatic QTLs. The additive QTL was located on bin 8.05. Additive × additive epistatic effects for pericarp thickness were showed between QTL in 2.01 and QTL in 6.05 with estimated 6.63% of the phenotypic variation and between QTL in 5.06 and QTL in 6.01 with the estimated phenotypic variation of 12.48%. The results indicated that epistasis and additive effects play an important role in the genetic basis of pericarp thickness. The MCIM model with the ability to detect epistatic QTLs is more suitable for pericarp thickness QTL mapping. In addition, candidate genes encoding proteins that play important role for pigment biosynthesis and cell transformation in endosperm were contained in four QTL regions of all, suggesting the likely relations between the expressions of these candidate genes and pericarp thickness variation.
甜玉米的籽粒柔嫩度、爽脆性、皮渣率等是其食用品质的重要评价指标, 是影响鲜食玉米食用品质的主要因素之一; 而果皮厚薄和结构与上述3个品质性状密切相关。果皮薄, 则柔嫩度高, 爽脆度高, 皮渣率低, 且口感好[1, 2]。降低果皮厚度也因此成为育种家提高甜玉米食用品质的重要育种目标。
玉米籽粒的厚果皮在抵御某些病害对籽粒内部的侵入时也能发挥重要作用[3]。普通玉米籽粒果皮厚度(57~182 μ m)远远高于其野生近缘种大刍草(25~30 μ m), 也是现代人工育种和自然抗性选择的结果[4]。因此在普通玉米中果皮厚度也是籽粒抗病性的一个重要指标。
玉米遗传学家们利用经典遗传学方法分析了玉米果皮厚度的遗传特征, 发现其属于数量性状, 且具有相当高的狭义遗传力(55%~82%)[5, 6, 7, 8], 受环境变化影响小[9]。遗传方式涉及加性效应、显性效应及显著的上位性效应[5, 6, 7, 10], 以主基因遗传效应为主[11]。控制玉米果皮厚度的基因位点在1.4~5.9个之间[7]。因此, 相对于其他数量性状而言, 控制果皮厚度的基因位点及其遗传效应可能更容易通过分子手段鉴定和分析。
有关玉米果皮厚度分子QTL定位和遗传方式的研究报道较少。Wang等[12]利用RFLP标记曾对1个甜玉米RIL群体进行过果皮厚度QTL定位, 分别在第1、第2和第6染色体上检测到相应QTL, 但多年来一直未有后续研究报道。近年来Choe等[8]利用韩国糯玉米种质对果皮厚度也进行了QTL检测, 然而这2项研究获得的QTL区域互不相同, 且但没有检测到QTL间上位性互作效应。
本研究利用SSR标记方法检测果皮厚度性状QTL, 期望能获得新的影响果皮厚度的QTL, 并在分子水平上检测到上位性互作等遗传效应的存在, 为玉米果皮厚度分子标记辅助育种(MAS)提供基因源, 同时也为解析果皮厚度的遗传机制提供一些新的资料。
日超-1是本课题组利用从日本引进的商业杂交种选育的优良甜玉米自交系, 果皮薄(56.565 μ m), 爽脆度高, 皮渣率低, 甜度高, 适口性好。1021为利用甜玉米和普通玉米杂交并回交选育得到的甜玉米自交系, 果皮较厚(100.234 μ m)。以日超-1作母本, 1021作父本, 配制杂交组合F1, 以日超为轮回亲本回交1次, 然后自交1次, 构建成包含190个家系的BC1F2作图群体。亲本和家系材料均种植在广东省农业科学院白云试验基地。
在人工授粉后25 d取鲜苞, 置-3~ -4℃冰柜, 冷冻备用。参照李余良等[13]的方法, 取冷冻后的鲜苞, 剥去苞叶, 选取果穗中部籽粒, 在解冻之前用刀片切下一小条籽粒顶部的果皮。用镊子选取双皮层、不粘糊粉层的果皮切片, 蘸水侧放, 紧贴在载玻片上, 用显微测微尺读取观测值并换算成果皮厚度值。以每个家系材料10个籽粒重复测定, 取其平均值。利用SPSS v11.5软件包(SPSS Inc., Chicago, IL, USA)分析基本统计量, 符合正态分布则可用于QTL检测。
在幼苗期剪取幼嫩叶片, 利用CTAB法提取基因组DNA[14]。从MaizeGDB数据库选取均匀分布在玉米基因组中的SSR标记鉴定基因型。通过PCR筛选家系间有清晰多态性差异的标记以检测基因型。PCR产物经6%非变性聚丙烯酰胺凝胶电泳, 银染[15], 带型与日超-1相同的记为A, 与1021相同记为B, 杂合的记为H。在统计每个SSR标记多态性带型的基础上, 排除偏分离严重及无法连锁的标记, 用MAPMAKER/EXP v3.0软件[16, 17]构建遗传连锁图谱, 用MapChart v2.1软件[18]绘图。
根据性状遗传效应的不同, 适用的统计遗传模型也不同[19]。由于果皮厚度性状的遗传特征仍不明确, 因此本研究先后采用2种不同的遗传模型来检测QTL。
采用PlabQTL v1.2软件[20]进行复合区间作图(CIM), LOD阈值为3.0。根据Edwards等[21]的建议, 用DR比值(即显性效应与加性效应的比值的绝对值)评估QTL的基因作用方式。如果DR≤ 0.2, 则基因效应为加性; 如果0.2< DR≤ 0.8, 则基因效应为部分显性; 如果0.8< DR≤ 1.2, 则基因效应为显性; 如果DR> 1.2, 则基因效应为超显性。用PlabQTL Version 1.2软件分析得到每个QTL所解释的表型变异率(R2)。
采用QTLNetwork v2.1软件进行基于混合线性模型的复合区间作图(MCIM), 分析QTL之间的互作效应[22, 23]。Permutation次数设置为1000次, 用于计算F值。用Monte Carlo Markov Chain (MCMC)算法估测QTL效应, Gibbs取样规模设置为20 000。以1 cM的步长对全基因组进行QTL扫描。
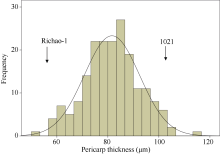
190个BC1F2家系的变异范围为53.144~114.731 μ m, 平均值为81.589 μ m。群体峰度为-0.0435, 偏度为-0.0022, 整体上呈正态分布(图1), 因此可以直接用于QTL检测。
累计合成627对SSR引物用于引物筛选, 共得到亲本间具有清晰差异且在家系中符合1∶ 2∶ 1分离的引物129对用以构建遗传连锁图。去掉一些无
法连锁的标记, 最终得到的覆盖玉米基因组的连锁图谱含有102个SSR标记。总遗传距离1917.6 cM, 标记间的平均距离为19.0 cM (图2)。
利用PlabQTL软件共检测到3个影响果皮厚度的QTL, 分别位于染色体3.01、6.01、8.05区段上。这3个QTL解释的果皮厚度变异率在7.2%~16.0%之间, 共解释了总变异的31.8%。另外, 从QTL的遗传效应和作用方式上看, 3.01和8.05处QTL以加性效应为主, 3个QTL分别表现为加性、显性及部分显性(表1)。
基于MCIM模型, 采用QTLNetwork软件共检测到1个加性QTL和2对上位性互作QTL, 其中染色体8.05上的QTL表现加性效应, 表型贡献率为8.22%。染色体2.01处的QTL与染色体6.05处的QTL之间存在上位互作, 能够解释6.63%的果皮厚度变异; 而第6染色体上的另一个位于6.01处的QTL则与染色体5.06处的QTL间存在上位互作, 能够解释12.48%的果皮厚度变异(表2、表3和图3)。这些QTL总的表型变异贡献率为27.33%, 略低于用PlabQTL软件估测到的31.8%。
| 表1 用PlabQTL软件检测到的果皮厚度QTL及相关遗传参数 Table 1 QTL and estimates of genetic effects for pericarp thickness by PlabQTL software |
| 表2 用QTLNetwork软件检测到的果皮厚度性状加性QTL Table 2 Additive QTL for pericarp thickness by QTLNetwork software |
| 表3 用QTLNetwork软件检测到的果皮厚度性状QTL上位性互作 Table 3 Epistatic interaction between QTLs for pericarp thickness by QTLNetwork software |
与通过PlabQTL软件检测到的QTL结果相比较, 发现8.05处的QTL用2个方法均被检测到, 主要表现加性效应, 且QTL峰值与区域均高度吻合, 应为同一个QTL, 表型贡献率也相当, 均在7%~8%左右, 只是由于统计算法的不同, 其加性效应值存在差异。另一个用2种方法均检测到的是位于6.01处的QTL, 用PlabQTL分析其作用方式为显性, 但在上位性互作检测中却显示为一个非加性的与5.06处QTL互作的QTL, 推测该QTL的主效应为显性效应, 同时也受5.06处基因位点的上位性互作。该QTL解释的表型变异用PlabQTL软件估测为16%, 而其与5.06处QTL互作效应贡献率则为12.48%, 显示该位点及其互作效应对果皮厚度变异具有较大的贡献率。与之互作的5.06处QTL及另外一对QTL (2.01处QTL和6.05处QTL)则没有在PlabQTL软件中被检测到, 暗示这3个非加性QTL可能只在上位性互作中发挥作用。
综合2种定位软件的结果, 本研究中共检测到6个QTL, 其中3.01和8.05处为加性QTL, 而另外4个QTL则分别表现为上位性互作而成对存在, 其中6.01处QTL还具有显著的显性效应。
准确的表型数据是果皮厚度遗传研究的前提和基础。尽管前人的研究已经表明, 果皮厚度是一个具有相当高遗传力的性状[5, 6, 7], 不同季节、果穗采收期等环境因素的影响也很小[9, 24], 然而, 在授粉后灌浆过程中, 籽粒果皮仍然会呈现先逐渐变厚, 成熟后期又因籽粒脱水而逐渐变薄的曲线变化规律[25, 26, 27]。因此, 为了最大限度地减少由于灌浆时间不同而可能带来的环境误差, 本研究全部取人工授粉25 d后的果穗来测定果皮厚度。
籽粒不同部位的果皮厚度也有差异。在早期的多项研究中测量了成熟籽粒中不同部位的果皮厚度, 并发现其间也存在显著差异[9, 12, 28]。如胚外表面的果皮要比另一面的果皮薄[28], 侧面基部的果皮则比籽粒顶部的厚[12]等。然而, 近年来的一项研究中显示, 尽管籽粒不同部位的果皮厚度值之间存在显著差异, 但这些值之间却是高度正相关, 且绝大部分变异都可归于同一个主成分因子, 而且也受共同的具有多效性的基因控制[8]。由此, 已无必要对籽粒各个部位进行测定, 所以本研究中只选测籽粒顶部的果皮厚度用于QTL检测。
本研究检测到6个果皮厚度相关QTL, 分别位于第2、第3、第5、第6和第8染色体上, 这也支持了前人研究中关于果皮厚度性状基因在1.4~5.9个之间的结论[7], 其中除2.01和5.06处QTL外, 其他4个QTL均与之前糯玉米研究中报道的一个或多个籽粒部位的果皮厚度QTL处于相同或相近区域[8], 其中3.00/01处的QTL更是在该研究中全部5个部位果皮厚度变异中均被检测到。显然, 这些不同玉米种质中共有的QTL在未来的分子标记辅助选择(MAS)中将优先被考虑, 利用其薄果皮等位基因来改良骨干种质的品质性状。2.01和5.06处QTL则可能没有独立的主效应, 而只通过分别对第6染色体上的相应QTL施加上位性作用来最终影响果皮厚度表型, 这也可能是这2个位点在本研究及Choe等[8]的研究中利用CIM作图法都没有被检测到的原因。
在果皮厚度的遗传效应方面, 早期研究中依据不同试验材料和试验设计得出的结论也有所不同。一项在爆裂玉米中的研究发现, 薄果皮主要由1个显性基因控制, 并伴随一些微效的修饰基因作用[29]。而在另外的几项研究中加性效应则是最重要的遗传效应, 此外也检测到显性效应及(加× 加)上位性效应[5, 6, 7, 10]。本研究中6个QTL分别表现加性、显性、部分显性及上位性互作效应, 其中2个位点同时具有主效应和上位性互作, 这也从分子角度证实了前人利用经典遗传学方法的结论, 同时表明果皮厚度性状涉及到的基因数目虽然不多, 但基因的遗传和调控机制比较复杂。
QTL上位性互作可分为2个主效应QTL之间互作(type I)、1个主效应QTL与1个“ 背景” 位点之间互作(type II)、2个互补位点之间互作(type III) 3类[30]。本研究检测到的2对互作QTL均显示为无单独个体效应的QTL, 因此均可视为type III上位性互作。然而, 其中6.01处QTL又另外用CIM法检测到显性主效应存在, 因此这对6.01与5.06处QTL之间的互作又有些类似于type II型互作模式。
与表型性状的遗传作用模式相对应的是基因的调控网络, 这3种QTL间的上位性互作模式反映的可能正是QTL所在基因位点间的正向诱导表达或者负向反馈抑制等调控机制[31]。我们根据检测到的QTL的基因组位置检索MaizeGDB数据库中每个QTL附近的功能基因位点后发现, 6个QTL中有4个都与影响玉米籽粒胚乳性状的基因位点位于同一区域(表4), 其中3个位点是与色素合成及调控相关的基因。而这3个位点相应的QTL均为上位性互作QTL, 如其中5.06处QTL和6.01处QTL存在上位性互作, 而6.01处的y1位点编码胚乳色素合成途径中的八氢番茄红素合成酶, 同时5.06处的pac1位点编码的则是可以调控色素合成关键酶基因表达的调控因子。我们自然会产生这样一个假设, 是否这2个基因位点就是这对互作QTL的分子基础?是否pac1和y1之间真的存在表达调控机制?而QTL间的上位性互作就是这种调控机制的反映?然而, 这些在胚乳细胞中色素合成途径中发挥作用的位点又怎么影响到果皮厚度的差异呢?这些疑问都要依靠更深入的研究才能够得到答案。
| 表4 本研究中检测到的部分果皮厚度QTL及QTL区域内的候选基因 Table 4 Part of QTLs for pericarp thickness in this study and candidate genes in these QTL regions |
另外一个8.05处QTL区域内的mrp1位点则编码一个能将表皮细胞转变成传递细胞的Myb相关蛋白[32]。细胞层数和细胞壁的厚度是决定不同种质间籽粒果皮厚度差异的主要因素[7]。这个mrp1编码蛋白的功能显然与果皮厚度密切相关, 可能就是通过将表皮细胞转变成传递细胞导致细胞层数减少, 进而影响果皮厚度。这也与8.05处QTL表现出的加性效应相一致。因此这个mrp1基因很可能就是8.05处QTL的分子基础, 当然这也需要在后续研究中加以验证。
发掘基因源并通过MAS改良种质是QTL研究的主要目标之一。在本研究检测到的6个QTL中, 3.01、6.01和8.05处的QTL均为与前人研究吻合的共有QTL, 其中3.01和8.05处为加性QTL, 而6.01处QTL贡献率高达16%, 且表现为显性, 它们应可被用作分子标记辅助选择和聚合育种的重要标记, 对于分子辅助育种具有较高的应用价值。而其他3个QTL主要通过上位性互作发挥作用, 可以作为进一步解析果皮厚度遗传机制及分子调控网络的突破口。
应该指出的是, 由于群体大小和图谱标记密度的限制, 上述QTL定位结果还不够精细。进一步对果皮厚度QTL精细作图, 并着重跟踪上述6个QTL区域, 开发功能标记, 发掘控制果皮厚度的功能基因, 是下一步的研究方向。另外, 在甜玉米育种和实际应用中, 果皮厚度也并不是越薄越好, 维持适度果皮厚度对于保证种子的生活力和抗性仍是必要的。因此在分子标记辅助选择过程中还要结合其他农艺性状综合评价和考量。
共检测到6个QTL, 其中位于3.01、6.05和8.05的为共性位点, 位于3.01和8.05的为加性QTL, 位于6.05的QTL除了上位性以外主要为加性遗传效应, 它们应被用作甜玉米果皮厚度分子辅助选择的重要标记; 而另外4个QTL则分别表现上位性互作而成对存在, 表明加性效应和上位性互作效应在果皮厚度的形成和遗传中也发挥着重要作用。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|