利用RT-PCR和RACE技术从飞机草中克隆得到1628 bp的类黄酮3’-羟化酶cDNA的全长序列, 命名为 CoF3’ H, GenBank登录号为HQ268505.1。 CoF3’H基因的编码区长度为1524 bp, 编码507个氨基酸。氨基酸序列含P450蛋白结构域和半胱氨酸亚铁血红素结合域保守区(F××G×R×C×G), 利用DNAMAN软件比对显示, CoF3’H与其他植物的F3’H蛋白的同源性很高。通过农杆菌介导成功地将 CoF3’ H基因导入烟草, T2代的转 CoF3’ H基因烟草植株的黄酮含量显著高于野生型。说明 CoF3’ H在黄酮的生物合成中起重要作用, 为后续研究飞机草的化感作用及综合利用提供基础。
A flavonoid 3’-hydroxylase gene cDNA sequence was cloned by RACE and RT-PCR techniques from Chromolaena odorata. The obtained full-length cDNA was named as CoF3’ H with GenBank accession number HQ268505.1. It is 1628 bp in length, containing a 1524 bp open reading frame, encoding 507 amino acid residues. The amino acid sequence of CoF3’ H contains cytochrome P450 domain and cysteine heme binding region (F××G×R×C×G). Homology analysis by DNAMAN software showed that the deduced CoF3’ H protein was highly homologous to F3’H proteins from different species. CoF3’ H gene was transferred into tobacco by Agrobacterium-mediated genetic transformation. There was higher content of flavonvoids in T2 transgenic tobacco than in the wild type. This result shows that CoF3’ H plays an important role in flavonoid biosynthesis, and provides a basis for researches on allelopathy and comprehensive utilization of C. odorata in the future.
飞机草[Chromolaena odorata(L.) R. M. King and H. Robinson]属菊科多年生植物, 又名暹罗草、香泽兰, 原产地中南美洲, 广泛分布于美国与阿根廷之间的热带地区, 包括西印度群岛[1, 2, 3], 第二次世界大战后, 传播到东南亚、非洲和太平洋群岛等地[4, 5, 6]。在中国云南、广西、广东、湖南和贵州等地均发现飞机草的入侵[6, 7]。飞机草被认为是世界上最严重的外来入侵种之一[8], 它主要是依靠其强化感作用以及旺盛的繁殖、生长能力与草原或作物竞争, 破坏当地的生态环境。研究表明, 飞机草中含有大量的黄酮类物质, 这些黄酮类次生代谢物是飞机草的主要化感物质及药用成分, 但目前, 对这些黄酮类物质的合成及调控过程知之甚少。深入了解黄酮类物质合成的分子机制, 将有助于我们进一步研究飞机草的入侵性以及综合利用。
类黄酮3’ -羟化酶(flavonoid 3’ -hydroxylase, F3’ H, EC: 1.14.13.21)是一种细胞色素P450单加氧酶[9], 属于CYP75亚族的成员。它是合成黄酮类物质过程中的一个关键酶, 以芹黄素(apigenin)、柚皮素(naringenin)、山奈酚(kaempferol)以及二氢山奈酚(dihydrokaempferol)等多种物质为底物, 催化单加氧反应, 合成类黄酮、黄酮及黄酮醇等。自1999年从矮牵牛中克隆到第1个F3’ H基因以来, 已从多种植物中克隆得到编码F3’ H酶的基因, 并进行表达研究[10, 11, 12, 13, 14, 15]。由于F3’ H催化生成的圣草酚(eriodictyol)和二氢栎皮黄酮(dihydroquercetin)是花青素和原花青素生物合成的重要中间产物[9], 目前对F3’ H基因功能表达的研究大多集中在花色改变等方面[16, 17, 18, 19, 20]。对飞机草F3’ H基因克隆及合成黄酮功能研究尚未见报告。
本研究以同属植物紫茎泽兰的F3’ H基因序列为基础, 设计特异引物, 通过RT-PCR及RACE技术克隆飞机草的类黄酮3’ -羟化酶基因的全长, 并将其导入烟草, 测定转基因烟草中的总黄酮含量, 以期为进一步研究飞机草的强入侵性及综合利用提供基础。
飞机草样本采自广西隆安县, 盆栽种植于广西大学温室内。
参考何海旺等[21]的方法提取RNA, 用1%琼脂糖凝胶电泳检测RNA的完整性和纯度。选择条带清晰、无降解、无蛋白质及DNA污染的高质量RNA样品进行后续的反转录分析。
使用Thermo公司的RevertAid First Strand cDNA Synthesis Kit试剂盒参照其说明书对提取的RNA进行反转录获得第1链cDNA。将反转录产物保存于-20℃备用。反转录所用的引物见表1。
| 表1 基因克隆和荧光定量PCR分析所用引物 Table 1 Primers used for gene cloning and real-time PCR analyses |
根据GenBank上查到的紫茎泽兰的F3’ H基因的序列(GenBank登录号为EF137714.1)设计内外侧2对特异引物(表1), 对第1链cDNA进行巢式PCR扩增, 获得的目的片段, 经回收、连接、转化和测序后, 得到中间片段序列。根据中间片段序列设计2条上游引物以及根据反转录引物序列设计下游引物(表1), 对第1链cDNA进行巢式PCR扩增, 获得3° 末端片段。根据中间片段序列设计一条特异反转录引物(表1), 合成第1链cDNA用于5° 末端片段的克隆。再设计一条上游引物用于PCR扩增。5° 端片段的克隆利用Invitrogen公司的5° RACE快速扩增试剂盒来完成, 根据5° RACE System for Rapid Amplification of cDNA Ends, Version 2.0手册操作。
利用DNAMAN软件拼接上述3个片段, 得到CoF3’ H基因序列的全长序列, 以该全长序列为模板, 在启动密码子ATG及终止密码子TAA外设计1对引物(表1), 扩增出ORF全长序列并校正。
PCR体系25 μ L, 包含2.5 μ L的10× 缓冲液(15 mmol L-1 MgCl2)、0.5 μ L的dNTPs 混合物(各10 mmol L-1)、1 μ L的cDNA第1链、1 μ L的上游引物(10 μ mol L-1)、1 μ L的下游引物(10 μ mol L-1)及0.2 μ L的rTaq DNA聚合酶(1 U μ L-1)。PCR程序先用95℃变性5 min, 接下来进行30个循环: 95℃变性30 s、50℃退火45 s、72℃延伸45 s, 最后用72℃延伸10 min, 产物于4℃保存。PCR获得的目的片段经1%琼脂糖凝胶电泳检测鉴定后回收, 并连接到pUCm-T载体, 转化到DH5α , 再经PCR鉴定后测序。
由于克隆ORF全长的上下游引物ORF-F和ORF-R的5° 端分别有BamH I酶切位点(GGATCC)和Xba I酶切位点(TCTAGA), 可以直接用于构建植物表达载体。先将ORF全长连接到pUCm-T载体, 并转化到DH5α 中。提取质粒, 用BamH I和Xba I酶进行双酶切, 回收并连接到经同样的酶双酶切过的PBI121载体上, 将构建好的载体转化到DH5α 中, 双酶切验证后提取质粒, 并通过冻融法[22]将质粒转化到致癌农杆菌EHA105中, 于-80℃保存得到的转化农杆菌备用。
利用叶盘法通过农杆菌介导[23]进行遗传转化, 把CoF3’ H基因导入烟草品种K346 (Nicotiana tabacumcv.K346)。移栽通过抗生素筛选获得的阳性植株及野生型烟草, 待其长出新叶后, 取幼嫩叶片提取DNA, 用NPTII-F及NPTII-F引物进行PCR验证。再以克隆到的中间片段为探针, 对通过PCR验证为阳性的转基因植株进行DNA印迹杂交检测拷贝数, 方法参照Roche公司DIG High Prime DNA Labeling and Detection Starter Kit II说明书。拷贝数为1的植株自花授粉后收获并种植, 直到获得T2代植株, 用于后续的检测。
采取T2代烟草嫩叶提取RNA, 反转录得到cDNA, 稀释20倍后上机检测; 配制PCR反应液(总体积为20 μ L): 10 μ L 2× SYBR Green I Master Mix、1 μ L上游引物(5 μ mol L-1)、1 μ L下游引物(5 μ mol L-1)、1 μ L cDNA模板、7 μ L ddH2O; PCR条件为95℃变性10 min, 95℃变性10 s, 60℃变性和延伸60 s, 50个循环; 将上好样品的96孔板放在Roche LightCycler 480荧光定量PCR仪中进行反应, 根据绘制的曲线计算结果。
转基因烟草中导入的CoF3’ H基因, 采用PBI121载体上带有的组成形启动子CaMV35S, 因此, 取T2代烟草植株的倒数第5张叶片, 转基因和野生型烟草各取5株, 参照李增富等[24]的方法, 精密称取无水芦丁对照品适量, 加75%乙醇配成0.2 mg mL-1的芦丁溶液。分别吸取该溶液2、4、6、8和10 mL, 置5只25 mL容量瓶中, 加蒸馏水至6 mL, 加5% NaNO2溶液1 mL, 摇匀放置6 min, 再加10% Al(NO3)3溶液1 mL, 摇匀放置6 min, 再加4.3% NaOH溶液10 mL, 并加水稀释至刻度, 摇匀放置15 min。将不同浓度的芦丁标准溶液在波长510 nm处, 以蒸馏水为空白参比, 测定吸光度, 获得标准曲线。将T2代烟草的叶片于105℃杀青30 min, 55℃烘干, 用液氮磨成粉末, 过60~ 120目筛, 称取过筛后的粉末1 g, 按1︰25加入80%乙醇溶液, 浸15 min, 然后在300 W、50℃下, 超声波作用20 min, 过滤。取2 mL提取液于25 mL容量瓶中, 加蒸馏水稀释至6 mL, 加5% NaNO2溶液1 mL, 摇匀放置6 min, 再加10% Al(NO3)3溶液1 mL, 摇匀放置6 min, 再加4.3% NaOH溶液10 mL, 并加水稀释至刻度, 摇匀放置15 min。在波长510 nm处测定吸光度。按照标准曲线换算样品中总黄酮含量。荧光定量PCR及总黄酮含量测定均设置3个重复。
用飞机草嫩叶提取RNA的反转录产物为模板, 进行巢式PCR, 得到1059 bp长的中间片段(图1-A)。再以这个片段为模板设计引物, 通过RACE技术分别扩增得到354 bp (图1-B)和724 bp (图1-C)的3° 末端及5° 末端。通过DNAMAN软件拼接3个片段, 得到基因cDNA全长序列, 为1628 bp。在该基因编码区的起始密码子ATG及终止物码子TAA的外侧设计一对特异引物, 扩增出它的ORF全长(图1-D)。通过DNAMAN对扩增得到的ORF全长及拼接得到的全长进行比对, 这2条序列的同源性为100%, 说明拼接得到的全长是正确的。用BlastN比对, 该基因序列与菊科其他植物的F3’ H基因均具有80%以上的同源性, 将其命名为CoF3’ H(GenBank登录号为HQ268505.1)。
在NCBI网站上用ORF Finder软件(http://www.ncbi. nlm.nih.gov/gorf/orfig.cgi)分析发现, CoF3’ H的起码密码子ATG位于29 bp, 终止密码子TAA位于1552 bp, 整个编码区(ORF)长度为1524 bp, 共编码507个氨基酸(图2)。使用频率最多的氨基酸是亮氨酸(14.20%), 其次为缬氨酸(7.50%), 最少的为半胱氨酸, 仅占1.18%。
 | 图2 CoF3’ H编码区核苷酸序列及推导出的氨基酸序列 下画线部分为P450蛋白的特征序列。Fig. 2 Nucleotide and predicted amino acid sequences of CoF3’ H The characteristic sequence of P450 is underlined. |
用DNAMAN软件比对表明, 与CoF3’ H同源性最高的是紫茎泽兰(88.24%), 跟其他的菊科植物如万寿菊等也具有极高的同源性(80.00%以上)。系统进化树显示, 飞机草与紫茎泽兰聚为一小类, 再与其他菊科植物如菊花、万寿菊等聚在一起, 说明它们的亲缘关系比较近; 而其他植物基本上按所属的目聚类, 如管状花目的烟草与牵牛花、杜娟花目的茶树与蓝莓、蔷薇目的苹果与草莓等分别聚为一类(图3)。说明F3’ H在系统发生上密切相关, 与植物亲缘关系相一致。
 | 图3 CoF3’ H与其他植物F3’ H氨基酸序列的系统进化树Fig. 3 Phylogentic relationship of amino acid sequences between CoF3’ H and other F3’ H |
为进一步了解CoF3’ H基因编码蛋白的物理性质, 用protparam软件(http://expasy.org/tools/protparam.html)进行预测。CoF3’ H基因编码蛋白的分子式为C2538H4040N690O718S16; 相对分子质量为56 221.1 Da; 等电点为6.79; 不稳定系数34.96, 为稳定蛋白(不稳定系数小于40则为稳定蛋白, 大于40为不稳定蛋白); 总平均疏水值-0.002, 属亲水性蛋白质(总平均疏水值小于0为亲水蛋白, 而大于0则为疏水蛋白)。
利用SMART软件(http://smart.embl-heidelberg.de/)对CoF3’ H的结构域分析可知, 其含有一段信号肽, 这个肽的起始位置在第1位氨基酸, 终止于第28位氨基酸。而32~494氨基酸的片段则属于细胞色素P450的结构域。用PROSITE软件(http://prosite.expasy.org/)再对编码的氨基酸序列搜索, 在434~443氨基酸的位置上发现FGAGRRICVG序列, 该序列推定为细胞色素P450的半胱氨酸亚铁血红素结合域保守区(F× × G× R× C× G), 这是鉴定P450蛋白的一个重要特征(图2中的下画线部分)。
利用Psipred软件(http://bioinf.cs.ucl.ac.uk/psipred/)分析CoF3’ H蛋白的二级结构, 在二级构象中, 各种结构元件所占的比例不同, 其中包含15个α 螺旋, 占氨基酸总量的47.47%, 无规则卷曲分散在整个蛋白质中, 占51.48%, 而延伸链比较少, 仅占5.72%, 在整个蛋白质中没有发现β 转角。
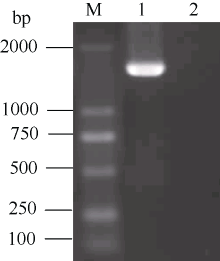
将克隆到的CoF3’ H基因连接到T载体上, 用Xba I、BamH I双酶切并回收后, 与同样经过双酶切回收的PBI121载体连接, 得到CoF3’ H基因的植物表达载体, 转化到大杆菌DH5α 中。从转化的大肠杆菌中提取质粒, 用Xba I、BamH I对质粒双酶切验证, 图4显示可以从质粒上酶切出目的片段, 说明CoF3’ H基因已经成功地连接到PBI121载体上。
 | 图4 CoF3’ H基因的植物表达载体酶切验证Fig. 4 Restriction enzyme digestion analyses of CoF3’ H plant expression vector |
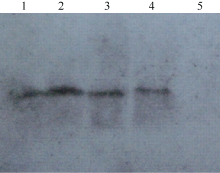
将从大肠杆菌中提取的植物表达载体质粒用冻融法转化到根癌农杆菌EHA105中, 用PCR检测转化的EHA105菌液, 所用的引物为ORF-F及ORF-R, 从琼脂糖凝胶电泳的结果(图5)可以看出, 以转化过的EHA105菌液为模板的泳道有目的条带(泳道1), 而非转化对照的EHA105菌液没有目的条带(泳道2), 说明CoF3’ H基因的植物表达载体已成功地转化到根癌农杆菌中。
 | 图5 转化后的农杆菌PCR验证 1: 转基因植株; 2: 野生型非转基因植株。Fig. 5 PCR analyses of Agrobacterium 1: Transgenic line; 2: Wild type plant. |
用转化的农杆菌液感染烟草的叶盘, 放在含有卡那霉素的培养基上筛选培养, 经过芽分化及生根阶段, 得到阳性的烟草植株。将这些抗生素筛选为阳性的植株移栽, 待其长出新叶后, 提取其幼嫩叶片的DNA, 用NPT II-F和NPT II-R引物进行PCR检测, 转基因烟草植物样本均能扩增出目的条带(泳道1~4), 而对照的野生型烟草没有目的条带(泳道5)(图6), 说明CoF3’ H基因已成功地被导入这些烟草植株。
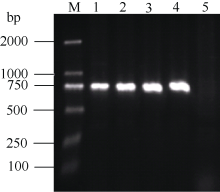 | 图6 转基因烟草的PCR验证 1~4: 转基因植株; 2: 野生型非转基因植株。Fig. 6 PCR analyses of transgenic tobacco 1-4: Transgenic lines; 5: Wild type plant. |
为进一步观察CoF3’ H基因在烟草中的拷贝数, 对这些转基因烟草植株进行DNA印迹杂交。提取烟草叶片的总DNA, 用EcoR V酶切, 电泳分离后通过毛细管转移到带正电荷的尼龙膜上后, 用克隆的中间片段作为探针进行印迹杂交。结果表明(图7), 在所检测的转基因植株中均只检测到一个条带信号(泳道1~4), 而非转基因野生型烟草中没有杂交信号(泳道5), 说明CoF3’ H基因在这些转基因植株中均为单拷贝。
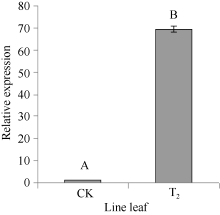
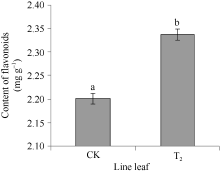
实时定量PCR检测结果表明, 在非转基因的野生型烟草中也检测到F3’ H基因表达。以2-(∆ ∆ Ct)表示试验组目的基因的表达相对于对照组的变化倍数。相对定量的结果显示, 将对照样品的2-(∆ ∆ Ct)定为1.00, 转基因的2-(∆ ∆ Ct)则为69.3 (图8), 表明CoF3’ H基因在转基因烟草中的表达量显著提高, 是非转基因的野生型烟草表达量的69倍多, 差异达极显著水平, 说明CoF3’ H基因导入到烟草基因组中, 能够正确地转录成RNA, 并在烟草体内大量地表达。总黄酮含量的测定分析表明(图9), 在转有CoF3’ H基因的烟草植株中的总黄酮含量为2.34 mg g-1, 比野生型烟草的高0.13 mg g-1, 差异达显著水平。表明CoF3’ H能在转基因烟草中翻译成蛋白质, 使得烟草中合成黄酮的量显著增加。
黄酮是飞机草的主要成分之一, 目前已从飞机草体内分离鉴定出47种黄酮类化合物, 包括黄酮、黄酮醇、二氢黄酮、二氢黄酮醇、查尔酮等[25]。黄酮是生物体内的一大类活性物质, 在飞机草体内可能具有多种活性。有研究指出, 多种植物中的黄酮成份均有化感物质的作用[26, 27], 飞机草可以通过释放黄酮类物质抑制其他植物的生长, 从而破坏生态环境[28]。虽然飞机草是一种危害严重的外来入侵种, 但从飞机草中提取的黄酮成分具有极强的抗氧化作用, 在医学上广泛应用[29, 30, 31]。因此, 研究飞机草中的黄酮的生物合成, 对进一步了解飞机草的强入侵性及综合利用具有积极意义。
类黄酮3’ -羟化酶属P450单加氧酶, 能够催化多种物质氧化反应, 在黄酮的生物合成过程中起着重要作用。生物信息学分析表明, 在CoF3’ H编码的氨基酸序列中, 34~494氨基酸为P450蛋白的结构域, 434~443氨基酸有半胱氨酸亚铁血红素结合域保守区(F× × G× R× C× G), 表明它是一个典型的P450蛋白。另外, CoF3’ H与其他植物的F3’ H的氨基酸同源性都很高, 所以, CoF3’ H在进化上是一个比较保守的基因。在系统进行上, 参与聚类的植物的F3’ H蛋白都能按各自物种所属的目聚类, 亲缘较近的植物聚为一类。
张松焕等[32]认为, 由于紫茎泽兰的F3’ H基因跟烟草的同源性很高, 所以将其转化到烟草中后, 与烟草内源的F3’ H产生共抑制现象, 导致F3’ H基因的表达量降低, 使烟草中的花青素积累减少, 花色变淡。在本研究中克隆到的CoF3’ H基因虽然与烟草的F3’ H基因具有较高的同源性, 但它能够在烟草中大量表达, 并且影响烟草植株中的黄酮合成, 使总黄酮的总量有所增加, 可能CoF3’ H基因与烟草内源的F3’ H基因并未发生共抑制现象, 具体原因有待进一步研究。Nakatsula等[33]研究也认为外源F3’ H基因可以在烟草中表达, 并且能够增加花青素的积累, 加深花的颜色。
据报道, F3’ H基因在黄酮的合成过程中起重要作用, 它可以以柚皮素为底物, 催化生成圣草素, 还可以以二氢山萘酚为底物, 催化生成二氢槲皮素[34]。在本研究中, 与对照相比, 转CoF3’ H基因烟草总黄酮的含量显著增加, 说明CoF3’ H促进了黄酮合成, 为黄酮合成过程中的关键基因之一。因此, 在今后的研究中, 揭示该基因的表达调控机制, 将进一步了解飞机草的强入侵机制, 对飞机草的防控及综合利用具有重要意义。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|