利用RT-PCR技术从甘蓝型油菜耐淹品系WR-4中克隆获得 BnADH3基因, 其完整开放阅读框为1137 bp 。该基因编码379个氨基酸, 与甘蓝 BoADH3基因和拟南芥 AtADH3基因高度同源, 同源性分别达到96%和91%。利用定量RT-PCR检测 BnADH3基因在油菜耐淹系WR-4和不耐淹系WR-24中的表达表明, 在淹水处理下该基因表达受到一定的诱导, 淹水处理6 h后表达开始上调, 说明 BnADH3基因在油菜耐淹机制中发挥作用; 将其转化到模式生物拟南芥中, 采用幼苗淹水3 d后去水处理, 测定表明转基因株系叶片和根系中乙醇脱氢酶活性均高于野生型; 生长4周和6周的拟南芥植株淹水3 d后的表型显示, BnADH3的表达可增强拟南芥对淹水胁迫的耐性, 处理的T2代转基因幼苗大部分恢复, 但野生型幼苗枯死; 调查表明, 淹水5 d后野生型植株的存活率为26.7%, 转基因株系ADH33和ADH44的存活率分别为80.0%和66.7%。
BnADH3 gene was cloned from submergence-tolerant line WR-4 of Brassica napus L. using RT-PCR technique. The full-length open reading frame is 1137 bp, encoding 379 amino acids. Homology analysis showed that BnADH3gene was highly homologous to BoADH3 from Brassica oleracea and AtADH3 from Arabidopsis, with the 96% and 91% similarity, respectively. Quantitative RT-PCR assay was carried out to compare BnADH3 expression between the submergence-tolerant line WR-4 and the submergence-susceptible line WR-24. The result showed that the BnADH3 expression was induced by submergence and the up-regulation occurred since 6-hour post treatment. The BnADH3 transgenic Arabidopsis was obtained and the transgenic seedlings were exposed to three-day submergence stress. Overexpression of BnADH3 resulted in higher ADH activity in leaf and root of transgenic Arabidopsis compared to that of the wild type. The four- and six-week seedlings of T2 generation showed higher tolerance to submergence stress after three-day submergence treatment and most T2 seedlings were recovered with normal growth when the stress was relieved for three days. However, the wild-type seedlings withered until death. After five-day submergence, the survival ratios were 26.7% for the wild type, 80.0% for transgenic line ADH33, and 66.7% for transgenic line ADH44.
我国是油菜生产大国, 种植面积和产量约占世界的30%左右。长江流域种植面积占我国油菜总面积的70%左右, 我国长江中下游地区油菜生长期间, 尤其在苗前期处于多雨季节, 加上特有的水稻-油菜轮作方式导致油菜苗期产生严重湿害[1]。
在湿害导致的缺氧或无氧环境下, 植物主要通过无氧呼吸产生能量来进行生理代谢, 以度过缺氧逆境, 而无氧呼吸主要是通过乙醇发酵途径来进行[2]。该途径主要由2种酶参与催化过程, 首先是在丙酮酸脱羧酶的作用下将丙酮酸脱羧生成乙醛, 然后乙醛在乙醇脱氢酶(ADH)的催化下还原生成乙醇, 同时产生氧化型NAD+ [3]。其中乙醇脱氢酶催化的反应是可逆反应, ADH可以作为分子开关在乙醛浓度过高的情况下将其还原为乙醇, 进而避免了对细胞的伤害; 另一方面ADH也可以重新将乙醇氧化为乙醛, 同时生成还原性NADPH, 为植物的代谢提供中间产物。因此, 在湿害胁迫下, 植株体内ADH的活性对植物在湿害逆境下的防御起着重要的作用。目前, 已经在多种植物中研究了缺氧或无氧环境下ADH基因及酶活性的变化[4]。淹水处理下玉米[5]和花生[6]的ADH活性显著增加; 水稻中ADH2基因的表达在淹水胁迫8 h后达到最大[7]。Xie和Wu[8]早期研究发现, 缺氧环境下水稻的ADH基因在根系、新叶、老叶以及发育的胚胎中活性均增强, 并且ADH活性还受到植物生长素的诱导。但是, 不同植物中研究结果不同, Andrews等[9]在对玉米的研究中发现, 幼嫩植株的根系ADH活性较高, Adh1基因的转录水平受缺氧的诱导较明显, 但是在成熟的植株中, ADH的活性及Adh1基因的表达受缺氧诱导并不明显。
本研究从甘蓝型油菜中克隆BnADH3基因, 转化拟南芥, 通过淹水处理, 旨在了解BnADH3在耐淹胁迫下的作用, 以证明转基因拟南芥是否通过过量表达BnADH3基因而增强了其耐淹性。
甘蓝型油菜(Brassica napus L.)耐淹品系WR-4和不耐淹品系WR-24由本实验室留存; 拟南芥哥伦比亚野生型(Arabidopsis thaliana Colombia)种子由南京农业大学生命科学学院植物营养生理实验室提供, 购于ARBC (拟南芥种植资源中心); 农杆菌菌株EHA105、植物表达载体pBI121 (携带CaMV35S启动子)由本实验室留存, 购于上海迈其生物科技有限公司。
将WR-4和WR-24的种子置培养皿中湿润的滤纸上催芽(25℃, 36 h)。种子露白后播于盛有营养土和蛭石(1∶ 1)的盆钵(高8 cm, 直径12 cm)中, 于16 h光照/8 h黑暗的光周期下生长, 将其光照时温度调至25℃, 黑暗时温度为22℃。待植株生长至三叶期时, 进行淹水处理。分单钵置水桶(高21 cm, 直径22 cm)中淹水处理, 水面距幼苗顶部2 cm。
设对照(不进行淹水处理, 于淹水处理当天取样)、淹水1 h、淹水3 h、淹水6 h、淹水12 h、淹水24 h, 共6个处理, 每个处理设3个重复。取各个处理的植株叶片, 迅速置液氮中保存。
利用定量RT-PCR试剂盒PrimeScript RT reagent kit (TaKaRa, 日本)分析淹水处理下BnADH3在油菜耐淹品系(WR-4)和不耐淹品系(WR-24)以及在转基因拟南芥中的表达。引物P3 (5′ -GATGAACGACC GTAAGAGC-3′ )和P4 (5′ -ACACCGCACCCAAGAA GG-3′ )用于扩增BnADH3, P5 (5′ -CTGGTGATGGTG TGTCTCACAC-3′ )和P6 (5′ -GTTGTCTCATGGATT CCAGGAG-3′ )用于扩增油菜的内参基因, P7 (5′ -GAGTAACTCAGGCAAACCG-3′ )和P8 (5′ -GATT TCCTGCCTTGACTAAG-3′ )用于扩增拟南芥的内参基因。
利用引物P1 (5′ -ATGGCGACTCAAGGTCAG-3′ )和P2 (5′ -ATCGCTGGTACTGAGGAC-3′ )克隆获得油菜BnADH3基因的完整开放阅读框。利用纯化试剂盒(天根, 中国北京)将PCR产物纯化, 连接到pMD18-T (TaKaRa, 日本)中测序。利用Pfu聚合酶扩增BnADH3基因的开放阅读框, 用带有Xba I和Sma I酶切位点的引物P1和P2, 将克隆得到的BnADH3基因片段连到pMD18-T载体上, 利用BnADH3基因与载体pBI121上共有的Xba I和Sma I双酶切位点, 将目的基因从pMD18-T质粒中双酶切后, 利用胶回收试剂盒回收, 用T4 DNA连接酶连接到经过Xba I和Sma I双酶切过的pBI121植物表达载体上, 构建成重组植物表达载体pBI121- BnADH3, 用以转化大肠杆菌Top10感受态细胞。通过PCR扩增、酶切及序列测定鉴定阳性克隆。提取阳性菌株质粒, 以冻融法转化农杆菌EHA105, 在含有50 mg L-1卡那霉素的YEB培养基上筛选, 鉴定阳性克隆, 并保存于-80℃冰箱备用。
利用农杆菌转化法转化拟南芥[10]。转化前一天将拟南芥苗浇足水, 转化时将荚果及已开的花朵剪去; 将花序于农杆菌菌液中浸泡50 s, 用保鲜膜包裹植株, 在弱光、23℃条件下培养24 h; 之后除去保鲜膜, 一周后可进行第2次转化。种荚成熟时收获, 将种子于室温干燥, 保存于4℃冰箱。
将T1代拟南芥的种子于4℃春化36~48 h, 经75%的乙醇消毒1 min, 5%的次氯酸钠消毒5 min, 用无菌水冲洗4~6次, 播于含有50 mg L-1卡那霉素的MS培养基中, 将Kan抗性植株转移至盆钵中, 取抗性植株的叶片提取总RNA, 以野生型为对照, 利用半定量RT-PCR和定量RT-PCR检测BnADH3基因在不同转基因植株中的表达。
利用GUS染色法验证转基因拟南芥[11]。1 mL X-Gluc染色缓冲液含50 µ L N、N-二甲基甲酰胺、0.5 mg X-Gluc、930 µ L磷酸缓冲液(100 mmol L-1 pH 7.0)、10 µ L铁氰化钾(5 mmol L-1)、10 µ L亚铁氰化钾(5 mmol L-1)、1 µ L Triton X-100。在无菌超净台上, 将要检测的植物材料放入X-Gluc染色缓冲液, 于37℃恒温箱温浴12~16 h; 待X-Gluc染液渗入材料后, 将材料转入95%的乙醇脱去叶绿素。将材料置载玻片上, 显微镜下观察染色的结果, 表达GUS的组织和器官呈蓝色。野生型和转基因拟南芥的处理同步进行。
野生型和2个转基因拟南芥(ADH33和ADH44)株系的种子(T2代)经75%的乙醇消毒1 min和5%次氯酸钠消毒5 min后, 用无菌水冲洗4~6次, 分别播于MS和MS+Kan (50 mg L-1)的培养基中发芽(22℃, 36 h)。植株生长1周后, 将抗性的转基因拟南芥植株转移至MS培养基中生长1周。之后分别将野生型和转基因拟南芥植株转移至盛有营养土和蛭石(1∶ 1)的盆钵(高8 cm, 直径12 cm)中, 每钵15株, 在12 h光照(23℃)/12 h黑暗(19℃)的光周期条件下生长2周和4周。然后分单钵于水桶中(高21 cm, 直径22 cm)淹水处理, 水面距幼苗顶部2 cm。
观察淹水后植株形态的淹水处理为淹水3 d; 淹水3 d+去水3 d。
统计植株存活率的淹水处理为淹水3 d+去水3 d (T1); 淹水5 d+去水3 d (T2); 淹水7 d+去水3 d (T3); 淹水9 d+去水3 d (T4)。
测定乙醇脱氢酶活性参考Andrews [9]方法。反应混合液含50 mmol L-1 TES缓冲液(pH 7.5, 0.17 mmol L-1 NAD) 940 μ L, 50 μ L酶提取液, 用10 μ L乙醇(40%)启动反应, 利用SHIMADZU UV-2450分光光度计在340 nm处检测吸光值(OD值)的变化, 以每分钟OD值变化0.01为一个酶活力单位。
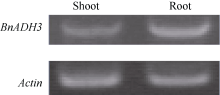
本研究克隆获得的BnADH3基因的完整开放阅读框为1137 bp (图1), 编码379个氨基酸。通过RT-PCR分析发现, BnADH3基因在植株的地上部和根系中均有表达, 如图2所示。将BnADH3的氨基酸序列分别与甘蓝BoAHD3 (JX104828.1)和拟南芥AtADH3 (BT010169.1)的氨基酸序列比对, 比对效率分别为96%和91%, 具有高度同源性(图3)。由此可知, 本研究克隆获得的BnADH基因属于乙醇脱氢酶ADH3基因, 因此将其命名为BnADH3。
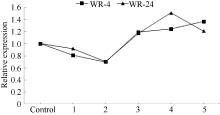
对生长3周的甘蓝型油菜耐淹品系WR-4和不耐淹品系WR-24淹水处理后, 定量RT-PCR检测BnADH3基因的表达结果见图4。BnADH3在2个品系中的表达变化趋势是一致的。在淹水后, BnADH3的表达下降, 淹水3 h时, BnADH3的表达降到最低; 随着淹水时间的延长, BnADH3的表达逐渐上调。淹水12 h时, 耐淹品系WR-4中BnADH3的表达量是对照的1.2倍, 不耐淹品系WR-24中BnADH3的表达为对照的1.4倍。可见, 相对于耐淹品系, 不耐淹品系受到的淹水伤害更大。乙醇脱氢酶可能在不耐淹品系中发挥着更重要的作用。
通过农杆菌转化法获得转基因拟南芥T1代植株, 经Kan筛选后, 首先利用P1和P2引物进行半定量RT-PCR验证(图5), 同时利用BnADH3基因的定量引物P3和P4进行定量RT-PCR验证, 获得阳性转基因植株, 对BnADH3在不同转基因株系中的定量表达分析结果见图6, 经验证最终利用ADH33和ADH44 2个转基因株系的T2代进行后续的实验。GUS染色分析结果显示转基因株系的叶片和根系中均检测到GUS的表达, 而野生型拟南芥植株中没有检测到GUS的表达(图7)。
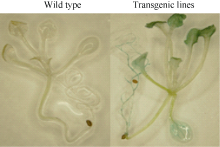
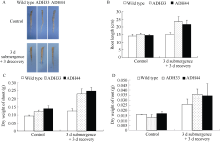
无论是生长4周还是生长6周的拟南芥植株, 在未进行淹水处理的情况下, 野生型和转基因株系在表型上没有明显的差异。生长4周的野生型拟南芥淹水3 d后, 大部分植株出现叶片透明状的伤害
表型, 在淹水3 d+去水后3 d时, 野生型拟南芥植株死亡, 但是转基因植株已开始恢复生长(图8-A); 生长6周的拟南芥淹水3 d后, 野生型叶片失绿变黄, 而转基因株系叶片呈深绿色。但在淹水3 d+去水后3 d时, 野生型拟南芥部分叶片枯萎死亡, 仅少数植株恢复生长; 而转基因株系大部分植株恢复生长(图8-B)。淹水胁迫严重抑制了根系的生长(图9-A, B)但是转基因拟南芥根系受到的伤害明显小于野生型。通过对植株地上部和根系的干重统计(图9-C) 得出, 淹水胁迫下, 野生型的生长缓慢, 而转基因株系的生物量增加明显。由此可以看出, 淹水胁迫明显抑制了野生型植株的生长, 对野生型植株的伤害明显大于对转基因株系的影响。
从图10可知, 在未进行淹水处理时, 转基因拟南芥地上部和根系的乙醇脱氢酶的本底活性高于野生型。淹水3 d处理后, 野生型和转基因拟南芥地上部和根系的乙醇脱氢酶活性都明显增强, 野生型叶片中为5.2 U mg-1蛋白, 而2个转基因株系叶片中分别为8.9 U mg-1蛋白和8.6 U mg-1蛋白, 显著高于野生型。在淹水3 d+去水后3 d处理中, 野生型和转基因株系叶片中乙醇脱氢酶的活性都逐渐降低, 且没有明显差异。根系中乙醇脱氢酶的活性变化与叶片中的趋势一致, 只是在淹水3 d处理后, 野生型根系中的乙醇脱氢酶活性比对照显著增强, 且高于2个转基因株系。
 | 图10 淹水胁迫下野生型和转基因拟南芥中乙醇脱氢酶的活性 Wild type: 野生型; ADH33和ADH44: 转基因株系; Shoot: 地上部; Root: 根系。Fig. 10 ADH activity in wild-type and transgenic Arabidopsis seedlings under submergence treatments ADH33 and ADH 44: transgenic lines. |
对生长4周的野生型和转基因株系不同淹水处理后植株存活率的调查表明(图11), 淹水3 d+去水后3 d处理后, 野生型植株存活率为35.6%, 2个转基因株系ADH33和ADH44的存活率分别为77.8%和84%。在淹水5 d+去水后3 d处理后, 野生型植株的存活率为26.7%, 转基因株系ADH33和ADH44的存活率分别为80%和66.7%。但是在淹水7 d+去水后3 d处理下, 野生型植株的存活率为33.3%, 而转基因株系ADH33和ADH44的存活率也出现明显的下降, 分别为44%和46%。在淹水9 d+去水后3 d处理下, 野生型和转基因植株的存活率均降低到10%以下。说明短时间的淹水处理下转BnADH3基因株系的耐淹性高于野生型。但是当淹水时间超过7 d时野生型和转基因植株均受到了严重的伤害, 转基因材料并未表现出比野生型强的耐淹性。
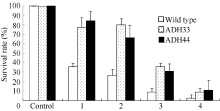 | 图11 不同时间淹水处理下野生型和转基因拟南芥的存活率 Wild type: 野生型; ADH33和ADH44: 转基因株系; Control: 对照; 1: 淹水3 d+去水3 d; 2: 淹水5 d+去水3 d; 3: 淹水7 d+去水3 d; 4: 淹水9 d+去水3 d。Fig. 11 Survival rate of wild-type and transgenic Arabidopsis seedlings under different submergence treatments ADH33 and ADH 44: transgenic lines; 1: 3 d submergence + 3 d recovery; 2: 5 d submergence + 3 d recovery; 3: 7 d submergence + 3 d recovery; 4: 9 d submergence + 3 d recovery. |
目前关于作物耐淹相关基因的研究主要包括两大类, 其中一类是代谢功能基因, 包括碳代谢、乙醇发酵、细胞分裂素合成等相关过程中的基因[12, 13, 14, 15]; 另一类是转录因子基因, 包括乙烯响应因子(ERF)等调控基因[16, 17, 18, 19]。乙醇脱氢酶在乙醇发酵过程中催化乙醛和乙醇之间相互转化, 进而使植物在缺氧或无氧环境下对能量的获取及物质代谢得到一定的保障。
不同ADH基因的表达具有组织特异性。Kü rsteiner等[20]分析了拟南芥ADH基因的表达情况, 发现ADH在拟南芥所有器官中都表达; 而水稻ADH1主要在叶片和花粉中表达, ADH2主要在根系中表达[21], 本研究中BnADH3基因在根系和叶片中均有表达。很多研究表明, ADH基因的表达受缺氧或无氧环境的诱导, 通过微阵列技术对水稻的胚芽鞘分析发现, 无氧条件下ADH1的表达上调约4倍, 而ADH2的表达上调20多倍[21]。Komatsu等[22]研究发现, 湿害胁迫2 d后大豆ADH基因表达增强, 其中GmADH2基因的上调幅度最为明显, 该基因在淹水6 h后表达量达到最大, 在去水24 h后表达开始下降。除此之外, ADH基因还可以被其他多种胁迫因素诱导, 如在水稻、玉米和拟南芥中研究发现ADH基因能被冷害、机械伤害以及ABA等植物激素诱导[20, 23, 24, 25]。窗体顶端本研究中, 在不同淹水时间处理下, BnADH3的表达也受到一定的诱导, 而且该基因的表达在2个甘蓝型油菜品系中的变化趋势是一致的, 淹水3 h后, BnADH3的表达首先呈下降的趋势, 合理的解释是, 淹水初期植物对逆境的应激反应导致植物整个生命活动的减弱, 基因表达下调, 随着淹水时间的延长, BnADH3的表达逐渐上调, 其中在淹水12 h时耐淹品系WR-4中BnADH3的表达增至原来的1.2倍, 而不耐淹品系WR-24中BnADH3的表达为淹水前的1.4倍。另外, 我们对淹水前耐淹和不耐淹油菜品系BnADH3基因表达的定量研究发现, BnADH3在耐淹油菜品系中的本底表达量高于不耐淹品系, 约是不耐淹品系的2倍。淹水胁迫下, 耐淹和不耐淹油菜品系中BnADH3基因都受到诱导表达, 而且趋势相似, 只是在不耐淹油菜品系中表达增加的幅度更大一些。因为植物的耐淹机制有很多, 例如有机调节物质的增加[26], 抗氧化酶活性的增强等[27], 耐淹植物因为具有较强的耐淹机制, 可能植物本身受到的淹水伤害较小, 而不耐淹品系对缺氧更加敏感, 同样在缺氧环境下, 不耐淹品系可能需要更多的ADH表达来增强无氧呼吸途径以获取能量, 所以ADH表达量可能会高于耐淹品系。但是无论是耐淹品系还是不耐淹品系, 淹水后BnADH3基因的表达都受到了诱导。
ADH的突变会使植物的缺氧耐受力降低, 如拟南芥[28]、玉米[29]以及水稻[30]的adh突变体都表现出对缺氧的敏感。同时, 互补实验表明过量表达拟南芥的ADH基因能增强拟南芥根系对低氧环境的耐性[4, 31]。但是也有相关研究发现, 虽然adh突变体对缺氧更加敏感, 存活率下降, 但是过量表达ADH的拟南芥对缺氧胁迫的耐性并没有增强反而降低[32], 同样的研究在棉花中也得到类似的结果, 过量表达ADH基因的棉花虽然增强了乙醇发酵途径, 但是并没有增强植株对缺氧的耐性[33]。可能植物本身的ADH活性足以维持催化乙醇发酵途径的需要, 虽然短时间内乙醇脱氢酶活性的增强能促进植株在淹水胁迫下的无氧呼吸途径, 为植株代谢提供能量, 但是, 长时间的淹水使乙醛和乙醇在植株体内大量积累, 会对植株造成一定的伤害。本研究中, 在短时间淹水处理下(淹水3 d+去水后3 d), 转基因拟南芥在去水后植株的存活率明显高于野生型, 但是在淹水7 d+去水后3 d以及淹水9 d+去水后3 d, 转基因植株的存活率也逐渐下降, 说明过量表达BnADH3后, 能在短时间淹水处理下增强转基因植株的耐性, 但是, 在长时间淹水处理下, 转基因拟南芥并未表现出高于野生型的耐性。对于BnADH3过量表达的植株来说, 虽然能在缺氧或无氧条件下维持较长时间的乙醇发酵途径来保证能量的供应, 但是乙醇发酵产生的乙醛和乙醇仍然会对植物产生不利的影响。
乙醇脱氢酶在多种植物生理代谢活动和发育过程中都发挥着重要的作用, 因此乙醇发酵途径已经不仅仅局限于缺氧逆境下植物产生能量的反应。本研究表明, 过量表达BnADH3能增强转基因植株在短期淹水胁迫下的缺氧耐受性, 但是在较长时间的淹水处理下, 转基因拟南芥的耐淹性并没有增强。另外, 不同的乙醇脱氢酶在不同植物应对湿害逆境过程中所起到的作用也不同, 因此我们将进一步对甘蓝型油菜其他ADH基因的功能进行发掘和研究, 这将为以后利用基因工程改善植物抗逆性提供一定的科学依据。
克隆获得甘蓝型油菜BnADH3基因, 其完整开放阅读框为1137 bp, 编码379个氨基酸, 与甘蓝BoADH3和拟南芥AtADH3氨基酸序列的比对效率分别为96%和91%, 具有高度同源性。BnADH3基因在甘蓝型油菜的根系和地上部均有表达, 且均受淹水的诱导。短时间淹水处理下, 无论是生长4周还是6周的拟南芥植株, 过量表达BnADH3均增强对淹水胁迫的耐性, 在淹水后恢复生长的过程中, 转基因植株的存活率明显高于野生型。但是, 在淹水7 d或更长时间淹水处理后, 转基因植株的耐淹性和存活率都明显降低。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|