WRKY蛋白属于锌指型转录调控因子, 参与植物生长发育及耐逆响应。以陆地棉遗传标准系TM-1为材料, 克隆 GhWRKY64(KF031101)基因上游1064 bp的启动子序列, 并对其调控元件及功能进行分析。生物信息学分析表明, 该区域含18个组织器官表达及诱导表达关键元件, 分别为6个ROOTMOTIFTAPOX1根特异调控元件, 4个CACTFTPPCA1叶肉特异性调控元件、4个OSE2ROOTNODULE病菌诱导元件、2个GTIGMSCAM4盐调控元件和2个W-box胁迫应答响应元件。将该启动子与 GUS基因融合, 构建pBIW64:GUS植物表达载体, 通过农杆菌介导叶盘转化法获得12个转基因烟草株系。选择 GUS表达量最高的pBIW64-5进行转基因不同组织器官表达及诱导表达分析。GUS组织化学染色显示, 苗期的转基因烟草植株在叶和根部均具有GUS活性, 开花期在转基因烟草植株根、叶及叶柄均检测到GUS活性, 特别在转基因烟草的根及根尖部分染色更深, 在茎和花组织上未检测到GUS活性。对该转基因烟草幼苗进行黄萎病菌诱导处理, 诱导48 h后, 转基因烟草幼苗根和叶片的GUS染色比未诱导处理的对照明显加深。结果表明, GhWRKY64上游1064 bp长度的DNA序列,具有启动子的相关顺式作用元件,且为病原菌诱导型启动子。该启动子可为开展棉花抗黄萎病转基因研究提供调控元件。
WRKY proteins are members of a transcription factor family with Zinc-finger structure in higher plant, which participate in various physiological processes and responses to multiple stresses. In this study we isolated a 1064 bp promoter sequence of GhWRKY64 (KF031101) from Gossypium hirsutum acc. TM-1 and analyzed its regulatory elements and functional characterization. Bioinformatics analysis revealed 18 putative tissue-specific or stress-induced regulatory motifs corresponding to known cis-elements in eukaryotic genes, including six ROOTMOTIFTAPOX1 of root-specific regulatory elements, two W-boxes, four CACTFTPPCA1 mesophyll-specific regulatory elements, four OSE2ROOTNODULE of pathogen-induced elements, and two GTIGMSCAM4 of salt-induced regulatory elements. The vector pBIW64:GUS was constructed by cloning the p GhWRKY64promoter region into a pBI121 plasmid upstream of the β-glucuronidase (GUS) reporter gene. Twelve transgenic tobacco plants were obtained by means of Agrobacterium-mediated leaf-disc transformation. Transgenic line pBIW64-5 with the highest GUS expression was selected for tissue-specific expression and induced-expression analyses. Histochemical analyses indicated that the full-length promoter directed efficient expressions of the reporter gene in root and leaf of pBIW64-5 seedlings, and root, leaf and petiole of pBIW64-5 plants at flowering stage, especially in root and root tip; however, no GUS activity was detected in stem and flower in the transgenic tobacco plants. The pBIW64-5 seedlings were also inoculated with Verticillium dahliae for 48 hours and the GUS activities in root and leaf showed the increased expressions compared to that of the untreated transgenic tobacco plants. Our results suggest that the upstream region of GhWRKY64 with 1064 bp contains cis-elements of the promoter, and is also a pathogen-induced promoter. This promoter is an efficient regulatory element in cotton transgenic research aiming at resistance to Verticillium dahliae.
植物生长环境经常受复杂多变的逆境胁迫影响。在长期进化过程中, 植物对各种不良环境产生胁迫应答反应, 并调控自身代谢过程中转录水平与转录后水平基因的表达, 形成一套完整的耐胁迫机制。植物各种诱导型基因的表达主要受大多以家族形式出现的转录因子调控, 进而参与植物对生物和非生物胁迫的应答反应[1]。启动子作为具有调控作用的反式作用因子, 通过与转录蛋白结合有效控制基因转录的起始时间, 表达部位和表达程度。
组织特异性启动子不仅可以有效驱动外源基因发挥其功能, 而且使外源基因的表达更具有针对性, 实现定时、定点、定量在植物中表达[2, 3]。杨学文等[4]从玉米自交系综31基因组中分离茎特异表达启动子ZmSSP, 通过转化烟草检测其融合基因GUS活性, 证明ZmSSP是茎组织特异性启动子, 可启动目标基因在茎中专化表达, 有效改良玉米地上性状营养器官。颜彦等[5]用电子克隆法从水稻明恢63基因组中获得鞘叶特异表达启动子GSP, 构建GSP:GUS转化水稻受体中花11, 对转基因后代的GUS活性分析证明GSP是一个叶鞘和叶片特异表达启动子, 对改良水稻叶型具有很好的应用价值。
WRKY转录因子是一个大基因家族, 参与植物的生长、发育、衰老等进程, 对各种生物和非生物胁迫都有一定响应。当受到病原菌、损伤、水杨酸(salicylic acid)等因子诱导时, WRKY基因的特异性识别序列(T)(T)TGAC(C/T) (W-box)将调控基因表达, 参与抗逆生理过程, 促进植物生长发育, 有效应对各种逆境胁迫[6]。郝中娜等[7]利用GUS报告基因分析OsWRKY19基因启动子受多种胁迫处理后的表达情况和表达的组织特异性, 明确其受多胁迫诱导后优势表达。棉花是世界性重要经济作物, 前期我们根据雷蒙德氏棉基因组序列信息[8, 9]完成了棉花全基因组WRKY转录因子家族的发掘、鉴定和分类研究, 并对其表达特征进行初步分析[10]。其中GhWRKY64在陆地棉根和叶中优势表达, 且在根中表达量最高。对不同逆境胁迫分析表明, GhWRKY64受黄萎病菌及干旱、高盐胁迫诱导显著上调表达。为了进一步揭示GhWRKY64的功能作用特征, 本研究用陆地棉遗传标准系TM-1克隆其启动子序列, 分析其调控元件及功能, 以进一步明确GhWRKY64的作用机制, 为棉花抗逆育种利用提供参考。
陆地棉遗传标准系TM-1 (Gossypium hirsutum acc. TM-1)、烟草(Nicotiana tabacum)品种三生烟NC98, 均由本实验室保存并繁殖。大肠杆菌(Escherichia coli)菌株DH5α 、根癌农杆菌(Agrobacterium tumefaciens) 菌株LBA4404、黄萎病菌株VD8及植物表达载体pBI121:GUS质粒等均由本实验室保存。DNase (RNase Free)、Taq DNA聚合酶、pMD19-T simple vector、T4-DNA连接酶、限制性内切酶及修饰酶均购自TaKaRa公司(Japan); DNA胶回收、质粒提取试剂盒均购自Axygen公司(USA); M-MLV反转录酶购自Progema公司(USA); 其他常规试剂均为国产分析纯。
采用CTAB法[11]从陆地棉TM-1新鲜幼嫩的叶片中提取DNA。根据公布的二倍体棉花雷蒙德氏棉基因组序列(http://www.phytozome.net/), 搜寻GhWRKY64同源基因在基因组的位置, 预测其上游启动子序列并设计PCR引物。将PCR产物连接到克隆载体pMD19-T simple vector上, 测序验证产物大小及准确性。分别采用PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/), BDGP (http://www.fruitfly.org/seq_tools/promoter.html)和Place (http://www.dna.affrc.go.jp/htdocs/PLACE/)等软件对启动子序列的相关作用元件进行分析。用Primer 5.0 (http://www.premierbiosoft.com/)设计引物(表1), 由南京金斯瑞生物科技有限公司合成和测序。
| 表1 本研究所用引物 Table 1 Primers used in this study |
在GhWRKY64启动子序列两侧设计构建植物表达载体的引物, 其中正向引物末端加入XbaI酶切位点, 反向引物末端加入Hind III酶切位点。将PCR扩增获得的目标片段连接pMD-19 T simple载体, 获得pMD19-T-GhWRKY64启动子质粒, 经酶切与测序分析验证序列准确性。分别用Hind III和Xba I双酶切pMD19-T-GhWRKY64与植物表达载体pBI121:GUS质粒, 用GhWRKY64启动子替换35S启动子。将构建的含有目的片段启动子与GUS融合的植物表达载体, 命名为pBIW64:GUS。
将构建好的表达载体转化农杆菌菌株LBA4404, 采用农杆菌介导叶盘转化法导入野生型烟草, 利用改良的组织培养技术获得烟草转基因植株[12]。利用50 µ g mL-1卡那霉素抗性筛选并继代生根, 获得再生转化幼苗, 移栽温室培养。
取长势相同的野生型WT和转基因T1代种子以75%酒精处理45 s, 无菌ddH2O清洗2~3次; 继续用15%次氯酸钠浸泡10~15 min, 无菌ddH2O清洗5~6次。将消毒种子点播于含100 µ g mL-1卡那霉素的1/2MS培养基上, 置温室(30℃左右)光照培养, 约30 d后观察长势, 将经卡那霉素选择标记抗性筛选的阳性幼苗移栽到正常生长环境, 取样和留种。
分别以植物表达载体pBIW64:GUS质粒和未转化烟草植株WT作阳性和阴性对照, 提取其基因组DNA, 进行GUS和GhWRKY64基因启动子序列PCR检测分析。
采用RNA提取试剂盒(Bioer Technology, 北京)提取转基因烟草根和叶总RNA。采用微量分光光度计(Nanodrop, USA)和1%琼脂糖凝胶检测RNA的浓度和质量。取2 μ g总RNA用于cDNA第1链合成, 研究方法参照试剂盒说明书(Vazyme Biotech, 南京)。以烟草持家基因β -actin作为内参基因, 利用实时荧光定量PCR仪(ABI 7500型, USA)进行GUS基因实时荧光定量PCR分析。从每个株系选3个单株, 每个样品设2次重复。采用2-Δ Δ Ct法进行数据的相对定量分析[13]。
选取卡那霉素抗性筛选和PCR检测均为阳性, 且长势一致的转基因烟草T1代幼苗, 进行GUS组织化学染色[14]。将T1代转基因烟草植株培育到开花期, 取其根、茎、叶、花等组织分别置1.5 mL的Eppendorf管染色液中, 37℃避光24 h, 直接观察样品染色情况。去除样品染色液, 用70%乙醇︰冰乙酸(9∶ 1)脱色液脱去叶绿素至阳性对照为白色, 观察并照相记录结果。利用转基因烟草T1代阳性植株及野生型对照长至3片真叶期幼苗, 接种黄萎病菌VD8进行诱导处理。将VD8菌液均匀涂抹于PDA培养基表面, 并覆盖一层滤纸, 将待测烟草小苗轻轻置滤纸培养基上, 封口于光照培养箱培养48 h, 进行GUS组织化学染色鉴定。
根据公开释放的二倍体雷蒙德氏棉基因组序列信息(http://www.phytozome.net/), 预测GhWRKY64同源基因的启动子序列, 设计PCR引物扩增四倍体陆地棉TM-1叶片DNA, 获得一条长1064 bp的目的条带。序列分析表明来自陆地棉TM-1中的GhWRKY64启动子序列与二倍体雷蒙德氏棉基因组中同源序列同源性为98%。
运用BDGP、Place和Plant CARE等软件对GhWRKY64启动子区域调控元件, 发现该区域含有许多高等植物重要的顺式调控元件, 以及组织器官表达及诱导表达专化元件。这些元件主要包括顺式作用元件CAAT-box 8个和TATA-box 1个; 植物根特异性表达调控元件ROOTMOTIFTA POX1(ATATT) 6个; 叶肉组织特异表达启动元件CACTFTPPCA1 (TACT) 4个; 与病原菌诱导相关元件OSE2ROOTN ODULE(CTCTT) 4个; 盐诱导响应相关元件GT1 GMSCAM4(GAAAAA) 2个; 参与植物胁迫应答响应元件W-box(TGACC) 2个(图1)。
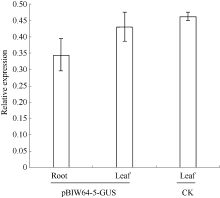
利用PCR技术检测转基因烟草植株(T0代)中GhWRKY64基因启动子序列及GUS基因, 在12个转基因烟草株系中扩增出目标产物, 而非转基因对照无扩增产物, 表明pBIW64: GUS已整合到这12个转基因烟草株系基因组中。表达特征分析表明, GhWRKY64基因启动子驱动GUS基因均可在12个转基因株系的根和叶组织中表达, 尤其在pBIW64-5转基因系中表达量最高(图2)。与pBI121-35S:GUS转基因阳性对照相比, pBIW64-5转基因株系叶和根中GUS表达量分别为阳性对照pBI121-GUS转基因株系叶中GUS表达量的92.9%和74.5%。表明GhWRKY64启动子可启动目标基因在根和叶中优势表达。
以pBIW64-5转基因株系为研究材料, 将生长3周后的幼苗进行GUS组织化学染色分析表明, 在转pBIW64:GUS基因T1代烟草幼苗的叶片和根部均检测到GUS活性的蓝色信号, 而在非转基因烟草植株的各个部位均未检测到GUS活性, 各组织未见染色, 呈黄白色(图3)。
选取pBIW64-5开花期植株的根、茎、叶、叶柄及花器官进行GUS活性分析表明, 成株期的转基因植株其根尖、叶及叶柄均有GUS活性, 染成蓝绿色, 特别是烟草根及根尖部分染色极深, 表现出GUS基因在根中表达量很高, 在茎和花中未检测到GUS活性(图4)。综合上述结果, 棉花GhWRKY64启动子可启动GUS基因在根和叶中高表达, 是在根和叶组织中优势表达的启动子。
将pBIW64-5转基因烟草幼苗进行黄萎病菌诱导处理, GUS组织化学染色表明, 非转基因的野生型烟草在病菌诱导前后均不能被染色, 而转基因烟草株系表现出GUS活性, 在诱导前后表现出明显蓝色深浅变化。黄萎病菌诱导后能增强pBIW64:GUS启动子的转录活性, 根尖和叶片组织均染成深蓝色, 特别是根尖部位染色更深, 近褐色(图5)。说明棉花GhWRKY64启动子含有黄萎病菌胁迫诱导的顺式调控元件, 黄萎病菌诱导后可驱动目标基因优势表达, 参与胁迫抗性应答反应。
真核基因表达是非常复杂的调控过程, 研究基因的启动子调控元件及启动子活性对分析转录起始水平上基因调控具有重要意义。利用基因工程手段挖掘组织特异性强、表达模式与强度适当的启动子, 使外源基因在作物的特定部位或发育阶段产生目标蛋白或其他代谢产物, 可避免组成型启动子表达对作物生长造成的不良影响。组织器官特异性启动子调控的基因只在作物的某些特定器官或组织部位表达, 例如通过克隆大豆β -伴球蛋白α 亚基基因启动子序列, 并构建GUS融合蛋白载体转化烟草, 成功证明该启动子在大豆种子中特异启动GUS基因表达[15]。马铃薯SGT3启动子的组织特异性实验表明, GUS组织化学染色主要集中在烟草叶片的叶脉部分, 在茎中的表皮、韧皮部及木质部, 在根冠, 及分生区以及维管束组织中低表达, 髓部几乎不表达[16]。柑橘启动子GRP具有较强的韧皮部组织特异性, 有望在抗病基因工程育种中发挥重要作用[17]。水稻基因OsESG1上游启动子序列OsESP1是水稻种胚特异性启动子, 是影响种胚中特异基因表达的关键调控顺式作用元件[18]。棉花是重要的纤维作物, 也是世界第六大油料作物。多个研究已对棉花不同组织、器官优势表达启动子进行系统分析。棉花GhGDRP85与泛素结合酶E2家族基因具有很高同源性, 其在不同组织器官中均优势表达, 在根中表达水平最高; 含该基因启动子和5'UTR区的uceA1.7表达特征显示, 其在大部分组织器官中表达水平与组成型表达的CaMV35S启动活性相当, 但在花中uceA1.7:GUS活性是CaMV35S:GUS的7倍, 在根中是CaMV35S: GUS的2倍; 表明uceA1.7是一个强启动活性的调控序列, 可用于驱动目标基因在不同组织器官, 尤其是花和根中优势表达[19]。编码富含脯氨酸蛋白的GhPRP3和编码查尔酮合酶的GhCHS1均在铃壳中优势表达, 其启动子驱动目标基因在铃壳中专化表达, 可有效避免应用CaMV35S等组成型表达的启动子在转基因作物中呈现组织器官表达广谱性, 进而导致目标基因产物承受强选择压[20]。棉花胁迫相关基因GHSP26编码热激蛋白, 启动子特征分析表明含启动子上游716 bp及更长的片段, 在ABA、重金属、干旱等胁迫下, 其诱导表达活性是对照的2倍以上, 是一个干旱等逆境诱导型启动子[21]。GhCesA4编码棉花纤维素合酶, 启动子分析表明其不仅参与次生壁形态形成, 而且受多逆境胁迫诱导, 可启动目标基因在维管束组织或逆境胁迫诱导下优势表达[22]。本文中, 我们克隆了一个受多逆境胁迫诱导上调表达的棉花GhWRKY64启动子, 该启动子有效启动目标基因在烟草根和叶组织中优势表达, 且受黄萎病菌诱导上调表达, 可为棉花抗黄萎病转基因研究提供调控元件。
研究发现, WRKY蛋白在病原体的防卫反应, 植物的生长发育以及非生物胁迫等多种生理生化反应中均发挥重要作用[23]。WRKY基因易受外界环境刺激而诱导表达。在水稻中, 热激会使OsWRKY11过量表达, 从而诱导HSP101的启动子启动, 增强水稻对高温和干旱的耐受性[24]。而OsWRKY45的过量表达可提高水稻对盐和干旱的耐受能力, 进而提高疾病抵抗力[25]。拟南芥AtWRKY25或AtWRKY33的过量表达可以提高耐盐性[26]。上述研究表明WRKY转录因子的启动子区含有与不同逆境胁迫相关的诱导调控元件。研究表明, WRKY转录因子也能特异结合(T)TGACC(A/T)序列(W-box)结构域, 调节含有W-box元件的启动子基因或功能基因的表达, 进而调控对生物及非生物逆境胁迫的响应[27]。W-box主要位于抗病或抗逆相关基因的启动子区域, 其数量有一个到多个不等, 它们位置相近, 呈同向或者回文结构排列, 利于与WRKY蛋白结合[28]。对大白菜BrWRKY33启动子上游的调控元件分析, 进一步构建不同长度缺失突变体载体转化拟南芥植株, 结果表明, BrWRKY33基因启动子上游存在多个W-box元件, 参与该基因负调控表达, 对软腐病抗性起重要作用[29]。本文克隆的棉花GhWRKY64启动子区域含有2个W-box调控元件, 其位置相近, 提高了其他WRKY蛋白与其结合能力。同时, 生物信息学预测表明该启动子区共有4个与病原菌诱导相关元件OSE2 ROOTNODULE(CTCTT), 暗示该启动子受病原菌诱导后表达量增强。我们的研究表明在黄萎病菌诱导下, pBIW64:GUS转基因烟草中GUS表达明显增强。表明该启动子可启动植物病菌胁迫应答相关基因高表达, 有望用于棉花黄萎病抗病分子育种研究。
在已报道的植物启动子中, 大多数均富含AT序列。高含量的AT意味着DNA双链结构更易解螺旋, 从而提高基因的转录效率[30]。本研究克隆的GhWRKY64基因启动子序列中, GC含量占27%, AT含量占73%, 获得的pBIW64:GUS转基因后代其GUS均表现较强活性, 特别在pBIW64-5转基因系中转录活性最高。根据GhWRKY64基因启动子中调控元件的分布, 我们进一步设计了含不同调控元件的缺失启动子。其中, -1 ~ -273 bp区间预测发现含有转录起始位点的核心启动子区, 同时该区域存在一个对基因转录有激活作用的核心启动元件CAAT-box, 2个叶肉组织特异表达启动元件CACT FTPPCA1, 和2个病原菌相关元件OSE2 ROOTN ODULE。-1 ~ -477 bp区间新增1个病原菌相关元件OSE2ROOTNODULE; 1个GT1GMSC AM4盐胁迫诱导相关元件, 和2个W-box元件。-1 ~ -740 bp区间除含有上述元件外, 又新增2个ROOTMOTIFT APOX1植物根特异表达启动元件。分析-740 ~ -1064 bp区域之间的325 bp区段相关调控元件表明, 该区段其GC含量为11.5%, AT含量高达88.5%, 有3个5′ -TATTAAT-3′ 元件, 2个5′ -TTATTT-3′ 元件, 1个5′ -TTTATATA-3′ 元件, 4个ROOTMOTIFTAPOX1元件和3个CAAT-box增强转录元件。因此, 通过启动子不同缺失突变体启动活性分析, 有望进一步深入阐明GhWRKY64基因启动子中各调控元件的作用机制。
克隆了棉花GhWRKY64基因上游长1064 bp的启动子序列。该启动子区含18个组织器官专化表达及诱导表达关键元件, 分别为6个ROOTMOTIF TAPOX1根特异调控元件、2个W-box框、4个CACTFTPPCA1叶肉特异调控元件、4个OSE2ROO TNODULE病原菌诱导元件和2个GTIGMSCAM4盐调控元件。通过构建棉花GhWRKY64启动子与GUS基因植物表达载体获得转基因烟草, GhWRKY64启动子在叶和根组织中启动GUS优势表达。受黄萎病菌诱导后, GUS基因表达水平显著提高。GhWRKY64启动子可启动目标基因在叶和根组织或逆境胁迫诱导下优势表达。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|