为揭示铝离子诱导大豆根尖分泌有机酸的特点及介导有机酸分泌的信号途径, 采用溶液培养试验方法调查AlCl3对大豆品种(广州本地2号)根尖有机酸分泌及 SGA1基因表达的影响。结果表明, AlCl3胁迫下大豆活体根尖分泌柠檬酸, 且分泌量随着铝浓度(25、50 µmol L-1AlCl3)和处理时间(2~12 h)的增加而增加; 大豆根尖以模式II分泌柠檬酸, 处理后的前4 h, 分泌速率很低, 其后显著提升; 有机酸明显分泌的诱导期长达6 h; 在50 µmol L-1AlCl3的溶液中添加异三聚体G蛋白抑制剂百日咳毒素(200 ng mL-1), 柠檬酸分泌减少38.7%。RT-PCR分析结果显示, AlCl3溶液诱导大豆根尖 SGA1基因的表达, 其表达水平随着铝处理时间(0.5~12.0 h)的延长有提升的趋势, 而诱导的 SGA1基因表达明显早于有机酸开始分泌时间(6 h)。这些结果表明, 铝离子诱导大豆根尖分泌柠檬酸及 SGA1基因的表达, 异三聚体G蛋白可能作为铝胁迫信号开关器参与有机酸分泌的调控。
The effects of Al3+ on the secretion of organic acids from root apices and the expression of SGAIgene were investigated by hydroponics to elucidate the characteritics of organic acid secretion and Al3+ stress signal transduction pathway which mediates the secretion of organic acids in soybean Guangzhou bendi 2. The results showed that soybean root apices (in vivo) secreted citrate under Al3+ stress. The secretion of citrate increased with the increase of Al3+ concentrations (25, 50 µmol L-1AlCl3) and the prolongation (2-12 hours) of treatment with Al3+. Citrate was secreted from root apices by pattern II in soybean. The secretion rate was very low within initial four hours after Al3+ treatment but remarkably elevated thereafter. A gap of time between the secretion and Al3+ treatment reached to about six hours. On the other hand, when cholera toxin, an inhibitor of heterotrimeric G-protein, was added to Al3+solution, the amount of citrate secreted decreased by 38.7%. RT-PCR analysis results indicated that Al3+ induced SGA1 expression. In general, the expression level was elevated with the prolongation of treatment with Al3+ (0.5 to 12 hours). Moreover, Al3+ induced expression of SGA1 sooner than the secretion of citrate. These results imply that Al3+ induces the secretion of citrate from root apices and SGA1 expression in the soybean, and heterotrimeric G proteins may act as a switch of Al3+ stress signal to be involved in the regulation of citrate secretion from root apices under Al3+ stress.
酸性土壤占世界可耕地的40%, 而过多的铝离子是酸性土壤中限制植物生长的主要因子。铝(Al3+)抑制根系生长, 阻碍根系对养分和水分的吸收, 进而导致地上部生长不良, 产量下降[1]。耐铝植物可通过外排机制或内部耐性机制抵御铝的伤害[2]。铝诱导根系分泌有机酸被认为是植物抵御铝毒害的重要外排机制[2, 3]。在不同种类植物中可能存在不同的机制调控铝诱导根系分泌有机酸, 细胞信号的跨膜传导可能作为重要的因子参与有机酸分泌的调控[4]。另一方面, 异三聚体G蛋白是位于原生质膜上的信号开关, 广泛参与生物细胞跨膜信号传导[5, 6]。异三聚体G蛋白高度保守, 多数物种的G蛋白α 亚基由单基因(GPA1)编码[7]。异三聚体G蛋白在信号转导过程中发挥主导作用[8]。然而, 到目前为止鲜有异三聚体G蛋白介导的细胞信号在调控有机酸分泌方面作用的报道。
大豆是我国重要的油料作物, 东北是我国大豆的传统产区。然而, 近年来由于大豆进口量的剧增, 东北地区大豆生产面积大幅度减少, 我国食用油安全面临前所未有的严峻挑战。在南方酸性土壤地区扩大大豆生产成为保障我国食用油安全的重要措施。然而, 鲜有报道在华南酸性土壤地区种植的大豆品种对铝毒害的抗性机制的研究。国际上虽有报道涉及大豆根系分泌有机酸的研究[9], 但是, 铝诱导大豆根尖分泌有机酸特性的研究并不充分, 更无异三聚体G蛋白介导的细胞信号调控大豆根尖分泌有机酸的相关报道。本研究拟通过铝胁迫下大豆根尖有机酸的分泌及异三聚体G蛋白α 亚基基因(SGA1, 大豆GPA1)的表达, 分析异三聚体G蛋白对有机酸分泌的调控作用, 旨在为揭示铝诱导大豆根尖分泌有机酸的特点及调控有机酸分泌的信号途径提供科学依据。
供试大豆(Glycine max)为广州本地2号, 种子浸种后均匀撒在湿润珍珠岩上, 28℃下遮光催芽48 h。萌发种子置塑料网筛, 胚根向下插入塑料筛网筛眼中, 筛网置含0.5 mmol L-1CaCl2(pH 4.5)溶液的塑料盆上, 液面接触筛网底部。植株培养于控温的人工光照培养室中, 光照强度87.5~100.0 μ mol m-2 s-1, 光照(14 h)/黑暗(10 h), 温度25℃。每小时通气15 min, 每天更换CaCl2溶液。
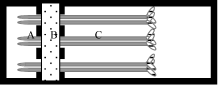
有机酸收集装置由聚甲基丙烯酸甲酯板组成, 分A、B、C 3个部分(图1)分别为根尖室、隔离室和支持室。大豆幼苗经室间隔板的缺口平置于底板上, 根尖(5 mm)置根尖室。大豆幼苗置收集装置后, 在隔离室中加入2%琼脂40℃溶液以防止根尖室中的溶液渗漏。琼脂冷却凝固(厚约8 mm)后立即加入处理溶液于根尖室并使处理溶液淹没根尖。支持室中加入氯化钙溶液和红墨水以保持老根区湿润并指示隔离室的隔离效果。
分别将3日龄的大豆根尖置根尖室, 并在室内分别加入1、0、25和50 µ mol L-1 AlCl3溶液(含0.5 mmol L-1 CaCl2, pH 4.5, 下同)。处理12 h后, 收集处理溶液, 分析其中的有机酸含量。另以0、50 µ mol L-1 AlCl3处理大豆根尖, 处理后每2 h收集处理液, 并重新加入1 mL新的处理液, 连续收集12 h。
最近本实验室的研究发现, 100、200和400 ng L-1的百日咳毒素(PTX)抑制黑麦根系分泌有机酸[10]。为调查异三聚体G蛋白抑制剂对有机酸分泌的影响, 分别以含0 (AlCl3)、200 ng mL-1(AlCl3+PTX)百日咳毒素的50 µ mol L-1 AlCl3溶液处理根尖, 并以氯化钙处理的为对照(不加AlCl3)。处理10 h后收集处理溶液并参照Li等[11]方法测定处理溶液中根尖分泌的有机酸。
3日龄的大豆幼苗经50 µ mol L-1AlCl3溶液处理0、0.5、1、2、4、6、8和12 h后按RNApre Pure植物总RNA提取试剂盒说明书提取根尖(1 cm) RNA, RNA提取物保存于-80℃, 用核酸/蛋白分析仪(DU Series 700, Beckman公司)测定其260 nm和280 nm下OD值。以1.2%琼脂糖凝胶电泳(Powerpac Universal, Bio-Rad)检测所提RNA完整性, 电泳15 min, 电压250 V。
参考M-MLV反转录酶说明书合成cDNA第1条链。反应体系(20 µ L)中含2 µ g RNA模板、5 µ L Oligo-dT (100 mg L-1), 70℃水浴5 min, 冰浴5 min后加入反应液(由4 µ L 5× buffer、2 µ L dNTPs、1 µ L RNasin、1 µ L M-MLV反转录酶组成), 加水到总体系20 µ L, 37℃水浴1 h, 95℃水浴5 min终止反应, -20℃保存。
大豆G蛋白α 亚基基因SGA1 (L27418.1)和微管蛋白基因β -Tublulin (内参基因, CA936138)由上海生工生物工程技术服务有限公司合成, 分别为SGA1-f: 5'-ATTGAGC GTCCCACCTAC-3'; SGA1-r: 5'-GCAACAGCAGCGTTTA CAT-3'; β T-f: 5'-CGAGGTTGCTTTCTAGTTT-3'; β T-r: 5'-A GCATCCTCCCACATAGTC-3'。
SGA1和β T基因扩增体系(20 µ L)中含0.5 µ L cDNA模板、2 µ L 10× buffer、0.4 µ L dNTPs、1.0 U Taq DNA聚合酶、引物(SGA1-f、SGA1-r或β T-f、β T-r; 10 µ mol L-1)各1 µ L, 灭菌水补足20 µ L。PCR程序为95℃ 4 min, 95℃ 40 s, 59℃ 40 s, 72℃ 1 min, 14~36个循环, 72℃ 10 min, 10℃ 10 min。
PCR扩增产物用2%琼脂糖电泳检测, 电泳条件为80 V, 1 h。电泳结束后用10 mg L-1溴化乙锭染液染色5 min, 用凝胶成像系统(AITM-26, Alpha innotech corporation)观察并照相, 用Gel-Pro Analyzer 4.0扫描分析光密度。以SGA1扩增产物的光密度/β t基因扩增产物的光密度表示SGA1基因的相对表达水平。
采用SPSS16.0统计分析数据, 新复极差法进行差异性分析。
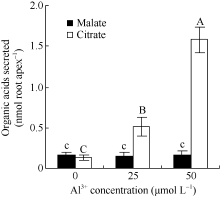
大豆根尖经25和50 µ mol L-1 AlCl3处理12 h后, 柠檬酸的分泌量达到0.51± 0.12 nmol Root apex-1、1.59± 0.16 nmol Root apex-1, 分别为对照的3.9倍和12.0倍, 经检验铝对大豆根尖分泌苹果酸的影响不显著。25 µ mol L-1和50 µ mol L-1 AlCl3处理后苹果酸分泌量分别为0.15 nmol Root apex-1和0.17 nmol Root apex-1, 与对照处理(0.16 nmol Root apex-1)的差异不显著(图2)。
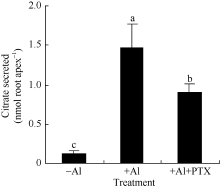
百日咳毒素(PTX)为异三聚体G蛋白活性抑制剂, 修饰异三聚体G蛋白α 亚基使异三聚体G蛋白无法被活化。在铝胁迫下200 ng L-1 PTX处理的大豆根尖柠檬酸分泌量为0.90 ± 0.12 nmol root apex-1, 仅为对照处理的61.3% (图4)。
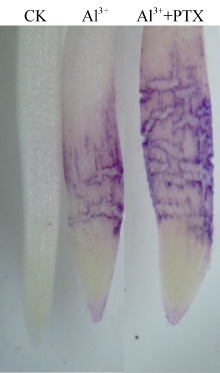
Al3+处理的根尖经铬天青R染色后被染成明显的紫色(图5), 表明根尖细胞受到明显的伤害。在AlCl3溶液中添加PTX后, 根尖染色程度明显加强。
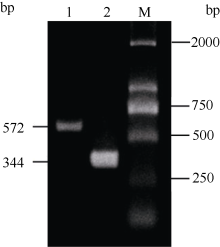
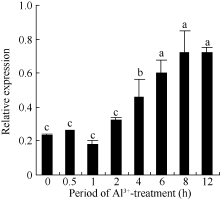
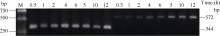
以AlCl3处理4 h后提取大豆根尖RNA反转录的cDNA为模板, 分别对SGA1和β T进行PCR扩增, 扩增产物分别为572 bp和344 bp (图6), 结果与预期片段大小一致。SGA1和β T的PCR扩增经14、16、18、20、22、24、26、28、30、32、34和36循环后, 扩增产物随循环数的增加而增加(图7和图8)。β T在16个循环时进入指数增长期, 26个循环时进入平台期(图8)。SGA1在22个循环时进入指数增长期, 32个循环时进入平台期。为保证SGA1与β T均处于扩增指数增长期, AlCl3处理后SGA1的半定量RT-PCR体系采用同批异管扩增, SGA1扩增26个循环而β T扩增20个循环(图8)。50 µ mol L-1 AlCl3处理0、0.5、1、2、4、6、8和12 h提取得根尖总RNA的半定量RT-PCR的扩增产量随着处理时间的延长呈上升趋势(图9和图10)。处理后0.5、1.0和2.0 h内, SGA1的表达量总体呈上升趋势。处理4 h后, SGA1的表达水平显著提高。处理8 h后, SGA1表达量趋于稳定。说明铝离子诱导大豆根尖G蛋白基因的表达。
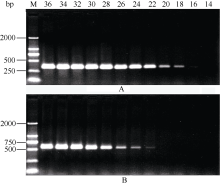 | 图7 同循环数下β T(A)和SGA1(B) PCR扩增产物电泳图Fig. 7 Electrophoregram of PCR products of β T and SGA1 at different cycles |
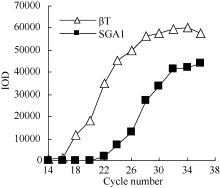 | 图8 同循环数下β T和SGA1 PCR产物的光密度Fig. 8 Integrated optical density (IOD) of PCR products of β T and SGA1 at different cycles |
 | 图9 AlCl3处理后根尖SGA1 PCR扩增产物的经时变化Fig. 9 Time course of SGA1PCR products of root apices treated with AlCl3 |
铝毒害的原初反应位于根尖[12]。采用离体培养技术对小麦、玉米、柱花草、荞麦等植物研究表明, 铝胁迫下根尖能够分泌较多的有机酸[4, 11, 13]。为了更准确地了解铝胁迫下植物正常的生理状态, 我们设计、制作了根尖培养和分泌物收集装置。该装置能维持根尖正常的生理状态, 满足根处于活体状态下方便收集有机酸的要求。采用该装置收集到根尖分泌物中的有机酸并发现铝诱导大豆根尖分泌柠檬酸(图1)。该研究结果与Yang等[9]、Dong等[14]的研究结果相似, 他们均发现铝诱导大豆根系分泌柠檬酸的现象。
据报道, 铝可诱导柱花草、荞麦、黑麦等植物根系分泌有机酸[11, 13, 15]。由于根系分泌的柠檬酸、苹果酸等低分子量有机酸与铝离子结合形成毒性较低的有机酸-铝复合物, 因此, 根系分泌有机酸被认为是植物抵御铝毒害的重要机制[2, 3, 4]。本研究结果显示, 铝胁迫下大豆根尖表皮细胞受ER染色程度因AlCl3处理溶液中加入PTX而加重, 而PTX显著抑制AlCl3诱导根尖分泌柠檬酸(图3), 说明根尖分泌柠檬酸是大豆抵御铝毒害的重要机制。
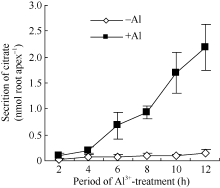
根据铝胁迫下根分泌有机酸的响应快慢程度, 植物有两种有机酸分泌的模式[4, 15]。模式I中植物有机酸的分
泌仅需要很短时间的铝胁迫诱导。而对于模式II, 有机酸的分泌需要较长时间的铝胁迫诱导。在本研究中, AlCl3处理后2、4 h, 大豆根尖分泌的柠檬酸与对照处理间的差异不显著(图2)。当AlCl3处理时间延长至6 h后, 柠檬酸分泌显著加快、分泌量极显著高于对照, 说明大豆属于模式II植物。
调控模式I、模式II植物根系分泌有机酸的机制可能不同。模式II植物有明显的诱导期暗示相关的分泌可能涉及基因、细胞信号转导等复杂的调控过程[4]。PTX能催化GDP结合异三聚体G蛋白的ADP核糖基化使G蛋白及其受体解偶联而专一性地抑制GTPase活性。因此, PTX是异三聚体G蛋白信号研究的重要工具。PTX抑制蓝光下黄化豌豆幼苗原生质膜异三聚体G蛋白ADP核糖基化, 说明GTP结合蛋白参与光刺激的信号途径。PTX抑制保卫细胞K+流和异三聚体G蛋白活性, 也说明异三聚体G蛋白参与细胞K+流的调控[16]。本研究发现PTX显著抑制大豆根尖在铝离子胁迫下根尖分泌柠檬酸(图4), 初步说明异三聚体G蛋白参与有机酸分泌的调控。铝离子处理后大豆根尖SGA1基因表达水平显著提升(图9和图10), 随之根尖在铝离子胁迫下柠檬酸分泌量明显增加。并且, SGA1基因表达显著提升所需的铝处理时间(4 h)较有机酸分泌诱导期短(6 h)(图3和图10), 这些结果进一步说明异三聚体G蛋白及其基因参与铝离子胁迫下柠檬酸分泌的调控。
据报道, MATE是铝激活的柠檬酸分泌蛋白基因, 而铝激活的有机酸分泌蛋白基因受转录因子STOP1调控[17, 18]。细胞信号可能通过STOP1的磷酸化激活有机酸分泌蛋白从而导致根系在铝胁迫下分泌有机酸[18]。异三聚体G蛋白是位于原生质膜上的信号开关器, 使胞外信号跨膜传导进入细胞内[5, 6]。本研究发现异三聚体G蛋白介导的细胞信号可能参与铝胁迫下大豆根尖分泌柠檬酸的调控。最近本实验室的Li等[10]也发现, 异三聚体G蛋白可能介导铝离子胁迫信号的传导, 调控黑麦和拟南芥根在铝胁迫下分泌苹果酸。基于这些发现, 我们推测异三聚体G蛋白可能作为信号开关器, 将铝胁迫信号传导进入胞内并被胞内下游效应器接受。异三聚体G蛋白介导的细胞信号进一步激活大豆转录因子STOP1, 上调SGA1基因和柠檬酸通道蛋白MATE表达水平, 并导致柠檬酸的分泌。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|