第一作者联系方式: E-mail: xiangjia1120@163.com, Tel: 023-68251264
抽穗期是决定水稻品种种植地区和季节适应性的重要农艺性状, 鉴定抽穗期基因对水稻生产具有重要意义。本研究采用高代回交和SSR标记辅助选择相结合的方法获得了1个以日本晴为受体亲本、西恢18为供体亲本的含有1个控制晚抽穗表型的主效单基因的水稻染色体片段代换系Z315。 Z315携带来自西恢18的5个代换片段, 分布于第1、第3、第6和第7染色体上, 平均代换片段长度为7.39 Mb。Z315的叶绿素含量、株高、穗长、倒一节间长、倒二叶长、倒三叶长、有效穗数、每穗实粒数和总粒数均显著高于受体日本晴, 暗示其代换片段可能携带这些性状的QTL。进一步利用日本晴与Z315杂交产生的F1和F2群体对晚抽穗基因进行遗传分析和分子定位。该晚抽穗表型受1对隐性核基因控制, 最终将该基因定位于第3染色体RM14283和RM6349之间, 物理距离为233 kb。对该区间进行候选基因预测和测序, 发现1个与抽穗相关的编码锌指蛋白的基因LOC_Os03g02160在日本晴和Z315间存在差异, 该基因可能与 Ehd4等位, 称作 Ehd4-2。由于染色体片段代换系除代换片段外与受体亲本一致, 因此本研究无论对进一步分离其他QTL还是进行基因聚合育种均具有较大利用价值。
Heading date is an important agronomic trait deciding planting area and seasonal adaptability of rice varieties. Identification of genes for heading date is important for rice production. In this study, a novel chromosome segment substitution line (CSSL) named Z315, carrying a single gene for late heading date, was identified by advanced backcrosses between the recipient Nipponbare and donor Xihui 18 and SSR marker-assisted selection. Z315 carried five substitution segments from Xihui 18. They were distributed on chromosomes 1, 3, 6, and 7. The average length of these substitution segments is 7.39 Mb. The chlorophyll content, plant height, panicle length, length of the 1st internode, length of the 2nd and 3rd upper leaf, number of efficient panicles, number of spikilets per panicle and number of grains per panicle in Z315 were significantly higher than those in Nipponbare, suggesting that QTLs (quantitative trait locus) for these traits might be carried on the chromosome substitution segments. Furthermore, F1 and F2 populations from cross of Nipponbare and Z315 were used for genetic analysis and gene mapping for the late heading date. Genetic analysis showed that the late heading date phenotype was controlled by a single recessive nuclear gene, which was mapped between SSR markers RM14283 and RM6349 on chromosome 3, with a physical distance of 233 kb. By gene prediction and candidate gene sequencing, a gene (LOC_Os03g02160) related to heading date was found existing differences between Nipponbare and Z315. The gene encoded zinc finger protein, which might be an allele of Ehd4, named Ehd4-2. The results in the paper have important applications for further dissection of other QTLs in Z315 and breeding for gene pyramiding because chromosome segment substitution lines have the same genetic background besides substitution segments compared with the recipient parent.
水稻是世界上最重要的粮食作物之一, 大约有50%以上的人口以大米为主食, 因此提高水稻的产量和品质具有重要意义[1, 2]。然而, 水稻的生育期、产量和品质等重要农艺性状都是数量性状[3]。这类性状的遗传基础复杂, 且极易受到环境条件的影响[4]。剖析这些性状的遗传机制对于水稻品种的定向改良具有重要意义。抽穗期是水稻的重要农艺性状之一, 其早晚直接反映生育期的长短, 从而影响品种的种植地区和季节适应性, 在水稻高产稳产中扮演着重要角色, 长期以来受到育种家的极大重视[5]。水稻抽穗期的早晚由外在环境因素和内在遗传发育机制共同决定, 其遗传机制异常复杂。
近年来, 水稻抽穗期基因的定位和克隆取得了较大的成就。到目前为止, 以F2、RIL、BIL等初级作图群体为材料已定位并克隆了16个控制水稻抽穗期的基因。分别为Hd1[6]、Hd6[7, 8]、Hd3a[9]、Ehd1[10]、Ehd2[11]、Ehd3[12]、Ehd4[13]、DTH2[14]、HGW[15]、RFT1[16]、OsMADS51[17]、OsMADS50[18]、Ghd7[19]、DTH8/ Ghd8[20, 21]、Hd16[22]和Hd17/Ef7[23, 24]。这些研究为揭示水稻抽穗期基因的调控网络奠定了良好基础。然而, 利用初级作图群体定位和克隆QTL往往费时费力, 尤其定位结果不易直接应用于育种实践[25]。次级作图群体有利于解决上述问题, 是目前应用最广泛的群体[26, 27]。染色体片段代换系(chromosome segment substitution lines, CSSL)是利用高代回交与分子标记辅助选择相结合而创建的次级作图群体。CSSL作为永久性作图群体, 与受体亲本仅存在代换片段的差异, 可以将数量性状基因座(quantitative trait locus, QTL)剖分为单个孟德尔因子, 是用于QTL定位和分析的良好材料[28, 29]。
本研究鉴定了1个具有主效晚抽穗基因的水稻染色体片段代换系Z315, 本文全面分析Z315, 并对其晚抽穗基因进行定位和候选基因分析, 这对其所携带QTL的定位、克隆及基因聚合育种具有重要意义。
Z315是以日本晴为受体亲本、西恢18为供体亲本, 经连续回交和自交并定向表型选择和分子标记选择, 在BC3F6获得的遗传稳定的晚抽穗染色体片段代换系。
2013年在重庆以日本晴与Z315杂交, 收获杂交种并分成2份。一份于同年秋季在海南种植F1群体, 并收获F2种子。2014年在重庆西南大学水稻研究所实验基地种植另一份F1种子连同亲本(日本晴和Z315)及F2, 用于晚抽穗基因的遗传分析和基因定位。
1.2.1 Z315代换片段鉴定 利用本实验室覆盖水稻全基因组的429对SSR标记对2个亲本进行多态性筛选, 然后用筛选出来的263个多态性标记中的182个对晚抽穗稳定的2010Z198株系(BC3F4)的20株进行分子选择, 选杂合片段和代换片段最少且表型接近日本晴的株系自交, 再取20株用杂合片段的标记进行分子标记选择和表型双重鉴定, 最终在BC3F6选出了纯合的染色体片段代换系Z315。代换片段检测时, 当某一标记的检测结果与受体亲本的带型一致时, 则认为该段DNA来自于日本晴基因组; 当某一标记的检测结果与供体亲本带型一致时, 则认为该段DNA来自于西恢18基因组。连续几个相同供体基因型标记间的区段表示代换片段[30]。按Paterson等[31]的方法计算代换片段长度。
1.2.2 Z315表型调查 以单株第一穗抽出叶鞘2 cm为抽穗标准, 记录日本晴、Z315、F1群体和F2群体中每一单株的抽穗日期, 每2天记录一次。在成熟期, 测量10株日本晴和10株Z315的株高、穗长、节间长度、功能叶长度和宽度。
1.2.3 叶绿素含量的测定 在抽穗期, 取日本晴和Z315各10株的3片功能叶进行叶绿素含量的测定。采样部位为叶片中部, 去除叶片中脉。具体参照Lichtenthaler[32]的方法进行。
1.2.4 农艺性状调查 成熟后, 取日本晴和Z315各10株考查单株有效穗数、每穗总粒数、每穗实粒数、结实率以及千粒重等性状。
1.2.5 DNA的提取 采用CTAB法参照McCouch等[33]方法稍加改进提取用于代换片段检测的3株Z315单株、日本晴及供体亲本西恢18的DNA。采用简易碱煮法[34]提取用于连锁分析和基因定位的F2分离群体的DNA。
1.2.6 分子定位 以日本晴/Z315的1778株F2群体中的419株隐性晚抽穗单株作为定位群体。首先选用5个代换片段中效果较好的标记对F2群体中的20个隐性晚抽穗单株进行基因连锁分析, 当发现某一标记与晚抽穗基因可能连锁时, 用F2群体中的10株早抽穗单株和10株晚抽穗单株进一步验证。当证明确实存在连锁时, 扩大群体, 用这个代换片段上的所有标记进行定位。利用MAPMAKER (EXP3.0b)软件进行数据分析和作图。
PCR反应总体积12.5 μ L, 包括1.25 μ L的10× PCR buffer, 0.65 μ L的25 mmol L-1 MgC12, 0.5 μ L的2.5 mmol L-1 dNTPs, 8.0 μ L的ddH2O, 1.0 μ L的10 μ mol L-1引物, 1.0 μ L的模板DNA和0.1 μ L的5 U μ L-1Taq DNA聚合酶。PCR反应程序为94℃预变性5 min后, 94℃ 30 s、56℃ 30 s、72℃ 30 s, 35个循环, 最后72℃延伸10 min。对PCR产物经10%非变性聚丙烯酰胺凝胶电泳和快速银染后进行观察[35]。
1.2.7 基因预测与测序 在水稻自动释义数据库(RAD)(http://ricegaas.dna.affrc.go.jp/rgadb/)和水稻释义计划数据库(RAP-DB)中(http://rapdb.dna.affrc.go.jp/), 查询精细定位区间内所有基因信息。与Gramene (http://www.gramene.org/rice_mutant/)中查询的基因信息进行比对, 结合基因预测功能, 筛选候选基因。
根据候选基因的DNA序列设计引物, 测序区域包括基因的外显子和内含子区。以日本晴和Z315的DNA作为模板, 用引物分段扩增目的基因, PCR产物经琼脂糖凝胶电泳分离后, 切胶回收并连接到pMD 19-T载体, 连接产物转化大肠杆菌感受态DH5α , 筛选鉴定的阳性克隆子送上海英潍捷基贸易有限公司测序, 然后分析测序结果。
在前期研究的基础上, 本文用103对SSR标记对3株Z315进行了代换片段鉴定和遗传背景检测。结果发现它们的所有代换片段一致, 且没有检出供体的其他残余片段, 从而确定Z315已纯合。Z315共含有来自西恢18的5个代换片段, 分布于第1、第3、第6和第7染色体上。其中第1染色体的代换区间为RM7449-RM3475, 代换片段估计长度为12.4 Mb。第3染色体的代换区间为RM14245- RM218, 代换片段估计长度为10.4 Mb。第6染色体中含有2个代换片段, 代换区间分别为RM3370- RM549和RM3207-RM7551, 估计长度分别为2.5 Mb和7.6 Mb。第7染色体的代换区间为RM445- RM3826, 代换片段估计长度为4.05 Mb (图1)。
2.2.1 Z315的形态特征 与受体亲本日本晴相比, Z315的抽穗期明显延迟。在重庆, 日本晴约60 d抽穗, 而Z315约104 d抽穗(图2)。此外, Z315的株高、穗长和倒一节间长显著增加, 但倒二节间和倒三节间长无差异(表1)。可见, Z315的株高增加是穗长和倒一节间长共同增加的结果。Z315的倒二叶长和倒三叶长显著增加, 分别为日本晴的1.10倍和1.14倍。但剑叶长、剑叶宽、倒二叶宽和倒三叶宽没有显著差异(表2)。这些结果暗示, 在Z315的代换片段上, 除携带晚抽穗基因外, 还携带控制株高、穗长、倒一节间长、倒二叶长和倒三叶长的QTL。
| 表1 日本晴与Z315的株高、穗长和节间长 Table 1 Plant height, length of panicle, and internode of Nipponbare and Z315 |
| 表2 成熟期日本晴与Z315的叶片形态 Table 2 Leaf morphology of Nipponbare and Z315 at maturity stage |
2.2.2 Z315的产量相关性状分析 与日本晴相比, Z315的有效穗数、每穗总粒数、每穗实粒数均显著增加, 而结实率和千粒重无差异(表3)。暗示Z315的代换片段上可能携带多穗和多粒QTL。
| 表3 日本晴与Z315的产量相关性状分析 Table 3 Yield-related traits of Nipponbare and Z315 |
2.2.3 Z315的叶绿素含量分析 在抽穗期, 除倒三叶的叶绿素b含量没有显著增加外, Z315的叶绿素a、叶绿素b及总叶绿素含量均显著高于日本晴, 暗示Z315还携带高叶绿素含量的QTL。其功能叶的高叶绿素含量为高光效奠定了光合基础, 为有机物的积累创造了条件, 可能是导致Z315多穗、多粒和株高增加的重要生理原因(图3)。
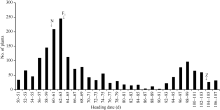
以日本晴为母本与晚抽穗代换系Z315杂交, F1植株的抽穗期与日本晴抽穗期基本一致, 说明控制该晚抽穗性状的基因为隐性遗传。在1778株的F2群体中, 群体的抽穗天数表现为双峰分布, 早抽穗峰值主要集中在50~85 d, 合计1343株。晚抽穗峰值主要集中在92~107 d, 合计419株(图4)。经卡平方测验, 早抽穗(1343)∶ 晚抽穗(419)符合3∶ 1分离比(χ 2 = 1.33 < χ 20.05, 1= 3.84), 进一步表明该晚抽穗表型受一对主效隐性核基因控制。
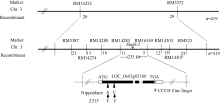
由于Z315仅含有5个染色体代换片段, 故本研究可直接用代换片段上效果较好的多态性标记, 对20株晚抽穗隐性单株进行初步连锁分析。结果发现, 位于第3染色体代换片段上的SSR标记RM14252可能与该晚抽穗基因连锁(图5), 而其他4个染色体代换片段上的标记均不表现连锁。然后, 用F2中10株早抽穗株和10株晚抽穗株对该标记进一步验证表明, 该标记确实与晚抽穗基因连锁。最后, 用419株晚抽穗隐性单株将该基因初步定位于第3染色体RM14252和RM3372之间, 物理距离为1.24 Mb。
为了对该晚抽穗基因进行精细定位, 根据已经公布的位于RM14252和RM3372之间的17对SSR标记, 最终将该基因定位在SSR标记RM14283和RM6349之间, 物理距离为233 kb (图6)。
在http://www.gramene.org/Oryza_sativa/Location/中输入第3染色体RM14283和RM6349的物理位置, 发现该区间内有一个编码CCCH类锌指蛋白的基因(LOC_Os03g02160)可能与抽穗期调控有关。
以日本晴和Z315的DNA作为模板, 用引物2160-1和2160-2分段扩增该基因(表4), 连接转化后送上海英潍捷基贸易有限公司测序。经比对, Z315中的LOC_Os03g02160与日本晴在第一外显子存在2处碱基的差异, 分别为第810个碱基由A变为T, 使得天门冬酰胺变为酪氨酸; 第924个碱基由C变为T, 使得精氨酸变为半胱氨酸(图6和图7)。该基因可能与Ehd4等位, 但变异位点不同。因此, 我们初步将LOC_Os03g02160命名为Ehd4-2。
| 表4 用于候选基因扩增的引物 Table 4 Primers used in candidate gene amplification |
抽穗期是决定水稻品种的种植地区和季节适应性的重要农艺性状。已有研究证明, 在同一温光型品种中, 生育期长的比短的具有更高的产量。随着全球气候变暖, 各地原有的主栽品种将会存在浪费积温的情况。生育期偏长、抽穗偏晚的优良品种更能够充分利用积温, 从而提高水稻的产量和品质[36]。因而晚抽穗基因在生育期改良中具有较大的应用价值。
水稻抽穗期的分子遗传机制异常复杂。随着与水稻抽穗相关的基因被陆续克隆, 控制水稻抽穗的部分机制已被揭开。近年来, 已克隆了16个与水稻抽穗期相关的基因, 分布于第1染色体(OsMADS51[17])、第2染色体(DTH2[14])、第3染色体(Hd6[7, 8]、Ehd4[13]、OsMADS50[18]、Hd16[22])、第6染色体(Hd1[6]、Hd3a[9]、HGW[15]、RFT1[16]、Hd17/Ef7[23, 24])、第7染色体(Ghd7[19])、第8染色体(Ehd3[12]、DTH8/Ghd8[20, 21])和第10染色体(Ehd1[10]、Ehd2[11])。在这些基因中, 以Hd3a、RFT1、Hd1和Ehd1为中心的分子调控途径已渐渐清晰。Hd3a编码蛋白与拟南芥的FT (Flowering Locus T)蛋白高度同源, 已经被证明就是水稻的成花素, 直接控制水稻开花。RFT1是Hd3a在水稻中最相似的同源基因[9, 37]。Hd1和Ehd1则是水稻光周期调控的2个关键基因, 一系列光信号通过作用于这2个基因来发挥效应。短日照下, 水稻通过Hd1(拟南芥CONSTANS直系同源基因)和Ehd1激活下游的水稻成花素途径基因Hd3a或RFT1促进水稻抽穗; 长日照下, Hd1基因抑制Hd3a和RFT1延迟水稻抽穗[38]。目前, 参与Hd1调控的主要基因有3个, 分别为OsGI、OsMADS50和Hd6。OsGI是维持水稻昼夜节律变化幅度的必需基因, 无论在短日照还是长日照条件下, 都是Hd1的上游主要调控基因[39]。Hd1的下游基因是OsMADS50, 其T-DNA插入突变导致Hd3a不表达, 引起水稻晚抽穗, 过量表达OsMADS50则引起水稻提早抽穗[18]。Hd6调控水稻开花时间需要有功能的Hd1基因参与, 突变体表现长日照下延迟水稻抽穗, 而在短日照下则不能延迟水稻抽穗[8, 9, 40], 但与Hd1的具体调控关系尚不清楚。能够调控Ehd1基因的主要有Ehd2、OsMADS51、Ghd7、Hd17/Ef7、Hd16、DTH8/Ghd8、Ehd3和Ehd4等。长日照条件下, DTH8/Ghd8通过调节Ehd1和Hd3a延迟水稻开花, 但短日照条件下促进水稻开花[20, 21]。Ehd2, 编码具有锌指域的转录因子, 通过上调Ehd1以及Hd3a、RFT1等下游基因的表达而促进水稻开花[11]。开花抑制子Ghd7在长日照下诱导Ehd1表达下调, 导致水稻延迟抽穗[19]。Hd17/Ef7在长日照和短日照条件下都通过负向调节Ghd7促进水稻开花[23, 24]。Hd16在长日照条件下通过磷酸化Ghd7增强其功能来下调Ehd1和其下游基因如Hd3a和RFT1的转录水平, 最终延迟开花[22]。Ehd3编码PHD锌指蛋白, 在长日照下通过抑制Ghd7诱导水稻抽穗, 同时, Ehd3又能通过一个不依赖Ghd7的方式上调Ehd1的表达[12]。Ehd4编码CCCH类锌指蛋白, 通过Ehd1上调Hd3a和RFT1的表达促进开花, 但独立于已知的其他Ehd1调控因子[13]。与上述调控网络关系尚不明确的还有2个基因, 分别为DTH2和HGW。DTH2是在长日照下促进水稻抽穗的微效QTL, 编码一个CONSTANS类似蛋白, 其表达受时钟节律调控[14]。有趣的是, Hd1是拟南芥CONSTANS的直系同源基因, DTH2是否参与Hd1调控网络, 目前尚不清楚。HGW编码植物特异的泛素相关结构域蛋白, 该蛋白作为一个重要的上游调控蛋白促进水稻抽穗和粒重相关基因的表达[15], 是否参与上述调控网络或具有新的调控机制, 都有待研究。
本研究定位了1个晚抽穗基因Ehd4-2, Ehd4-2位于第3染色体SSR标记RM14283和RM6349之间, 物理距离为233 kb。测序结果表明, Ehd4-2可能与Ehd4[13]等位, 但变异位点不同。Ehd4是T-DNA插入突变导致LOC_Os03g02160第1外显子初始端的碱基G突变为A, 使得色氨酸变为终止密码子, 导致该基因提前终止[13]。而Ehd4-2则是在其第1外显子发生了两处碱基的替换, 分别为第810个碱基由A变为T, 使天门冬酰胺变成酪氨酸; 第924个碱基由C变为T, 使得精氨酸变成半胱氨酸(图6和图7)。Ehd4和Ehd4-2突变位点不同, 可能导致相应突变体抽穗表型的差异。无论是突变体ehd4还是以日本晴为背景构建的近等基因系ehd4-NIP, 在自然长日照下均表现不抽穗[13], 而Z315则比受体亲本日本晴晚抽穗44 d。研究表明, 鉴定更多的等位基因差异与相应表型之间的联系, 进而挖掘优异等位基因和等位基因组合, 构建基因间的互作网络, 有利于使生物学家和遗传学家更深刻地认识生物表型多态性的遗传本质[41]。因而, Ehd4-2对进一步完善水稻抽穗的分子调控网络具有较大的利用价值。尤其值得关注的是, 本研究定位的Ehd4-2是利用水稻染色体片段代换系进行的。由于染色体片段代换系除代换片段外, 与受体具有相同的遗传背景[42], 因而, 与Ehd4-2紧密连锁的SSR标记RM6349可直接应用于以日本晴为遗传背景的水稻生育期改良育种中。而且该代换系的穗数、粒数和叶绿素含量均显著高于受体日本晴, 因而在其代换片段上可能还携带多穗、多粒和高叶绿素含量的优良QTL。因此, 以该染色体片段代换系为材料, 可以迅速地把不同的优良基因聚合到该代换系中, 选育符合需要的水稻新品种。该代换系无论对分离其他QTLs并进一步研究其功能, 还是对基因聚合育种, 均具有非常重要的利用价值。
鉴定了一个以日本晴为受体亲本、西恢18为供体亲本的水稻染色体片段代换系Z315。Z315共含有5个代换片段, 分布于第1、第3、第6、第7染色体。Z315抽穗延迟, 株高、穗长、倒一节间长、倒二叶长、倒三叶长、有效穗数、每穗粒数和叶绿素含量均显著增加。精细定位了1个隐性主效晚抽穗基因Ehd4-2, 位于RM14283和RM6349之间233 kb的范围。该基因编码CCCH类锌指蛋白, 在第一外显子有2处碱基发生了替换。由于该代换系可能还携带多个优良性状的QTL, 利用它改良生育期和分离其他QTL具有较大的应用价值。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|