第一作者联系方式: E-mail: qpchengwei@163.com, Tel: 13015748369
植物在受到低温、高盐、干旱等非生物逆境胁迫后, CBF结合因子(C-repeat/dehydration-responsive element binding factor)会诱导一系列非生物胁迫应答基因的表达, 在提高植物抗逆性方面具有重要作用。本研究利用生物信息学和RT-PCR (reverse transcription-polymerase chain reaction)方法从甘蔗中克隆到1个新的 CBF类基因, 命名为 ScCBF1。该基因的开放读码框(open reading frame, ORF)长度为603 bp, 编码200个氨基酸, 编码蛋白相对分子质量为22.80 kD, 理论等电点为10.31。氨基酸序列比对结果表明, ScCBF1与高粱( Sorghum bicolor)和玉米( Zea mays)中该蛋白相似度分别是96%和94%。进化分析表明ScCBF1与高粱的亲缘关系最近。qRT-PCR表达分析结果表明, ScCBF1在甘蔗根、茎、叶中均有表达, 在根中表达量最高。 ScCBF1在低温、干旱、脱落酸(ABA)胁迫下诱导表达, 而高盐抑制 ScCBF1的表达。成功构建了原核表达载体pGEX-6P-1-ScCBF1, 通过IPTG诱导, 实现了ScCBF1蛋白在大肠杆菌中的表达。
C-repeat/dehydration-responsive element binding factor (CBF) plays an important role in improving plant stress resistance. The CBF can induce a series of abiotic stress responsive gene expression when the plants are subjected to low temperature, high salt, drought or other abiotic stresses. In this paper, a new CBF-like gene, designed as ScCBF1, was cloned by bioinformatics and RT-PCR method from sugarcane. Sequence analysis showed that ScCBF1 contained a 603 bp open reading frame (ORF) and encoded a deduced protein of 200 amino acids. Its molecular weight and isoelectric point were predicted as 22.80 kD and 10.31, respectively. The amino acid sequence alignment results showed that ScCBF1 shared the similarity of 96% and 94% with the CBF1 protein from Sorghum bicolor and Zea mays, respectively. Phylogenetic tree analysis revealed that ScCBF1 had closer relationships with Sorghum bicolor. qRT-PCR showed that ScCBF1 expressed in root, stem and leaf in sugarcane with the highest expression level in roots. ScCBF1 gene was induced by low temperature, drought or abscisic acid (ABA), but was downregulated under high salinity. The protokaryotic expression vector pGEX-6P-1-ScCBF1 was successfully constructed and transformed into E. coli. Under the induction of IPTG, ScCBF1was successfully expressed in E. coli. This study sheds light on the understanding of the function of ScCBF1.
低温、干旱及高盐等非生物逆境是影响植物生长发育的重要限制因素, 严重时甚至导致植物死亡, 在农业生产中危害极大。低温冻害可能造成植物细胞机械损伤, 引起细胞膜的膜脂相变。干旱和盐害都属于渗透胁迫, 干旱会引起细胞失水, 严重时会导致死亡; 盐害会导致植物生长被抑制、光合作用下降以及活性氧积累等不利影响。研究植物对非生物逆境的应答机制, 提高植物对逆境的抗性一直是植物科学领域的研究热点[1]。植物中存在一个以CBF结合因子(C-repeat/dehydration-responsive element binding factor)为主导的低温和脱水响应通路, 在植物低温响应的基因调控网络中占有核心地位[2]。CBF类转录因子是一类在植物中特异存在的、在干旱或低温等非生物逆境胁迫中起重要作用的调控因子。该类转录因子能特异性识别DRE/CRT (dehydration responsive element/C-repeat)顺式元件, 并能与DRE/CRT顺式元件相结合, 从而激活下游一系列响应干旱、高盐和低温等抗逆基因的表达[3]。1985年Guy等[4]首次报道了菠菜(Spinacia oleracea)在冷驯化过程中相关基因表达的变化, 发现了在冷驯化过程中起关键作用的CRT/DRE结合因子家族。Fowler和Thomashow研究发现[5], 在拟南芥(Arabidopsis thaliana)中, CBF/DREB基因表达产物与CRT/DRE元件的特异性结合, 能够调节COR78、COR47和COR15a等将近40个低温响应基因协同表达, 从而对逆境作出响应, 激活一系列的抗逆基因的表达, 产生一系列生理生化反应, 如可溶性糖积累、甜菜碱、脯氨酸合成增加, 从而增加植物在逆境环境下的耐受力, 提高植株的抗逆性[6]。研究与逆境胁迫应答相关转录因子, 已经成为解析植物响应非生物逆境基因表达分子调控机制的重要手段之一。目前已从拟南芥、玉米(Zea mays)、水稻(Oryza sativa)、欧洲油菜(Brassica napus)等多种植物中分离并鉴定出CBF类基因[7, 8, 9, 10]。但是目前还未见到此类基因在甘蔗上的研究报道。
在我国, 甘蔗立地条件差, 80%以上甘蔗种植于坡地或者旱坡地。近年来, 灾害天气频发, 干旱和低温冻害已经成为影响甘蔗生产的主要因素。在甘蔗育种上, 耐旱、耐寒是除了甘蔗产量外最重要目标之一。发掘甘蔗逆境应答基因, 研究甘蔗抗逆机制, 对于甘蔗抗逆育种具有重要意义。本研究从甘蔗中克隆到一个CBF基因, 拟运用实时荧光定量PCR技术研究该基因在不同逆境胁迫下以及不同组织中的表达模式, 以期为进一步研究甘蔗CBF1基因的功能提供实验证据。
甘蔗品种福农40 (FN40), 由本实验室提供。取FN40腋芽, 采用腋芽快繁的方法获得无毒组培苗[11]。培养温度24℃, 湿度60%, 16 h光照(光照度为37.5 μ mol s-1 m-2)/8 h黑暗, 促根后移至穴盘中水培, 每天换水一次。待组培苗长到5片完全展开叶时, 选取长势一致的幼苗进行低温(4℃, 30 min、1、2、4和8 h)、高盐(250 mmol L-1 NaCl, 3、6、12、24和48 h)、干旱(30% PEG-8000, 3、6、12和24 h)、ABA (100 μ mol L-1 ABA, 6、12、24和48 h)胁迫处理, 每个处理3个重复, 每个重复3株, 并以正常生长条件下的甘蔗幼苗作为对照, 进行取样[12, 13, 14]。另外, 将甘蔗品种FN40种植于本实验室的温室内, 正常水肥管理, 白天最高温度为30℃, 夜晚最低温度为22℃, 湿度为60%, 待其长到成熟期, 有20个节间时, 随机选择3株长势一致的植株, 采集出现可见肥厚带的+1叶, 用酒精棉擦拭、消毒, 取第7节间茎, 及白色嫩根, 用清水漂洗干净, 用液氮速冻所有样品, 置-80℃冰箱保存备用。
采用TRIzol试剂提取总RNA。使用Nanodrop (Thermo Scientific, USA)测定RNA的浓度, 按照Prime Script RT-PCR Kit使用说明书, 将mRNA反转录成cDNA第1链, 用于后续基因扩增和作为实时荧光定量PCR的模板。
以玉米CBF1基因序列(EU975322.1)为模板序列, 利用Primer Premier 5软件根据玉米CBF1基因5'、3'端保守区域设计特异性引物, 以盐胁迫3 h的甘蔗组培苗叶片的cDNA作为模板, 利用ScCBF1特异性引物(表1)进行PCR扩增。反应体系为25 µ L, 含Ex Taq 0.125 µ L, 10× PCR buffer 2.5 µ L, dNTPs 2 µ L, 正反向引物各1 µ L, 模板1 µ L, ddH2O 17.375 µ L。反应条件为94℃ 4 min; 94℃ 30 s, 55℃ 30 s, 72℃ 1 min, 35个循环; 72℃ 10 min。PCR产物经1%琼脂糖凝胶电泳, 回收目的片段, 将其连接到pMD 19-T Vector中, 然后转化大肠杆菌DH5α 感受态细胞, 经过蓝白斑筛选以及菌液PCR验证后, 委托生工生物工程(上海)有限公司测序。
| 表1 ScCBF1基因克隆与表达所用引物 Table 1 Primers used in ScCBF1 gene cloning and expression analysis |
利用DNAMAN和ORF Finder软件, 对克隆获得的ScCBF1基因的核酸序列及其推测氨基酸序列进行分析; 利用ExPASy服务器(http://www.expasy.org/proteomics)的ProtParam、Compute pI/Mw和ProtScale工具预测ScCBF1蛋白的理化性质和亲疏水性; 利用TEPRED (http://embnet.vital-it.ch/software/TMPRED_form.html)和TMHMM (http://www.cbs.dtu.dk/services/TMHMM-2.0/)工具分析ScCBF1蛋白的跨膜结构域; 利用SignalP4.1 Server (http://www.cbs.dtu.dk/Services/SignalP/)预测ScCBF1蛋白的信号肽; 利用在线软件PSORT (http://psort.hge.jp/form.html)预测ScCBF1的亚细胞定位; 用SOPMA工具 (https://npsaprabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html), 对ScCBF1蛋白进行二级结构预测; 利用DNAMAN进行多序列比对; 利用ClustalX、MEGA5.1 (Neighbor-Joining)构建系统进化树。
根据测序获得的目的序列的ORF, 设计特异性引物(表1), 以CBF1质粒为模板, 扩增并回收目的基因片段。反应体系为25 µ L, 含Ex Taq 0.125 µ L, 10× PCR buffer 2.5 µ L, dNTPs 2 µ L, 上下引物各1 µ L, 模板1 µ L, ddH2O 17.375 µ L。反应条件为94℃ 4 min; 94℃ 30 s, 66℃ 30 s, 72℃ 1 min, 35个循环; 72℃ 10 min。利用1%琼脂糖凝胶电泳检测并回收纯化CBF1的目的片段, 利用T4连接酶, 16℃连接过夜, 连接到同样双酶切表达载体pGEX-6P-1, 转化大肠杆菌DH5α 感受态细胞, 经过蓝白斑筛选以及利用EcoR I 和 Xho I内切酶双酶切鉴定和质粒PCR鉴定, 命名为pGEX-6P-1-ScCBF1, 委托上海生物工程技术有限公司测序。
将空质粒和重组质粒转化入宿主菌E. coli Rosetta (DE3)中, 挑取单菌落。接种至含有50 mg L-1氨苄青霉素的LB液体培养基中, 37℃培养过夜。取1 mL培养物接种至10 mL LB液体培养基(含50 mg L-1 Amp)中培养至OD600为0.6时, 加入终浓度为1 mmol L-1的IPTG, 37℃诱导至12 h (每2 h取样1 mL), 分别收集菌液, 4℃, 8000 × g, 离心10 min后收集菌体, 加入25 µ L蛋白加样缓冲液, 沸水浴5 min, 常温下12 000 × g, 5 min, 吸取10 µ L上清液, 12% SDS-PAGE电泳检测融合蛋白的表达。
利用RT-PCR克隆技术克隆得到一个甘蔗ScCBF1基因(图1)。序列分析显示, 该基因cDNA全长708 bp, 其ORF长度为603 bp (41~643 bp), 共编码200个氨基酸(图2)。利用NCBI数据库(http://www.ncbi.nlm.nih.gov/)的BlastN工具比对得知, ScCBF1基因与高粱(Sorghum bicolor)、玉米(Zea mays)、水稻(Oryza sativa)、二穗短柄草(Brachypodium distachyon)等物种CBF基因高度同源, 相似性分别为96%、94%、78%和75%。
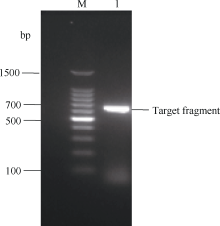 | 图1 甘蔗ScCBF1基因的PCR扩增结果. M: 100 bp分子量标记; 1: PCR扩增产物。Fig. 1 PCR amplified products of ScCBF1. M: 100 bp ladder marker; 1: PCR amplified product. |
 | 图2 甘蔗ScCBF1基因的cDNA序列及其推导的氨基酸序列(* 终止密码子). 下画线表示翻译起始位点。Fig. 2 The nucleotide acid sequence of ScCBF1 and its deduced amino acid sequence (* stop codon). Underline indicates translation initiation site. |
ProtParam、Compute PI/MW分析表明, ScCBF1的理论分子量为22.80 kD, 理论等电点为10.31, 不稳定系数预测为75.41, 表明其为不稳定蛋白。总平均疏水性是-1.699, 表明该蛋白可能是一种可溶性蛋白。利用ProtScale在线软件对ScCBF1氨基酸序列进行分析表明, 该蛋白N端有明显的亲水性, 是亲水蛋白。且整条多肽链没有明显的疏水区, 多表现为亲水性, 推断甘蔗ScCBF1是一种可溶性蛋白。利用TMpred和TMHMM在线分析, 均未发现明显跨膜结构域, 表明ScCBF1不是跨膜蛋白。利用SignalP4.1 Server对ScCBF1蛋白的信号肽预测表明, ScCBF1蛋白的N端不含信号肽, 是非分泌蛋白。利用PSORT在线软件分析得知ScCBF1定位于细胞质。利用在线软件SOPMA, 对ScCBF1蛋白的二级结构预测分析表明, ScCBF1蛋白主要存在4种次级结构, 所占比例从高到低依次是无规则卷曲56.55%、α 螺旋33.33%、延伸链5.99%、β 折叠4.12%。
以ScCBF1的氨基酸序列为查询探针, 利用NCBI中的BlastP程序来比对GenBank的非冗余蛋白序列数据库。在高粱、玉米、水稻、二穗短柄草(Brachypodium distachyon)等植物中比对出多个CBF蛋白, 表明CBF蛋白可普遍存在于植物中。将甘蔗与高粱(Sorghum bicolor, XP_002448114.1)、玉米(Zea mays, ACG47440.1)、水稻(Oryza sativa, EAY94703.1)、二穗短柄草(Brachypodium distachyon, XP_003580 064.1)的蛋白序列进行多序列比对, 结果表明, 甘蔗ScCBF1蛋白与其他物种CBF蛋白在N端有较大的保守性, C端保守性较差(图3)。甘蔗ScCBF1蛋白与高粱、玉米、水稻和二穗短柄草的蛋白相似度分别为96%、94%、78%和75%, 表明ScCBF1基因编码氨基酸序列与单子叶植物的同源性较高。
 | 图3 甘蔗ScCBF1氨基酸序列与其他植物同源性比对Fig. 3 Homologous comparison of ScCBF1 amino acid sequences among sugarcane and other plant species |
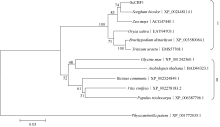
以小立碗藓(Physcomitrella patens, XP_ 001772035.1)的CBF蛋白序列用作外源序列, 使用MEGA 5.1, 采用NJ法(BootStrap 1000)构建进化树, 分析ScCBF1蛋白与其他物种CBF蛋白的进化关系(图4)。结果表明, ScCBF1与高粱、玉米等物种进化距离较近, 而与葡萄、蓖麻等物种进化距离较远。进化树可以划分为2个群。群I包括甘蔗、高粱、玉米、水稻、二穗短柄草、乌拉尔图小麦(Triticum urartu, EMS57768.1)等单子叶植物; 群II包括拟南芥(Arabidopsis thaliana, BAD44323.1)、大豆(Glycine max, NP_001242360.1)、葡萄(Vitis vinifera, XP_ 002278183.2)、蓖麻(Ricinus communis, XP_002524849.1)和杨树(Populus trichocarpa, XP_002319689.1)等双子叶植物。在群I中, C3和C4植物的CBF1形成2个分支。分析表明, CBF1在遗传进化上具有明显的种属差异。
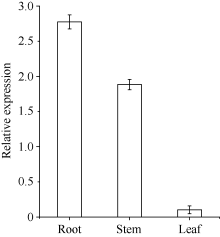
根据荧光定量的数据分析ScCBF1基因的相对表达量(采用2-Δ Δ Ct算法分析实验数据), 甘蔗幼苗叶片在不同胁迫处理下的定量结果显示(图5), ScCBF1基因能够被低温(4℃)、干旱(30% PEG-8000)、ABA (100 μ mol L-1 ABA)强烈诱导上调表达, 而在NaCl (250 mmol L-1 NaCl)胁迫下, 基因的表达量显著下调表达, 说明NaCl抑制ScCBF1的表达(图5-B)。ScCBF1明显受4℃低温强烈诱导表达, 胁迫处理30 min后即强烈上调表达, 于2 h达到最大值, 基因表达量是0 h的6倍, 随后降低(图5-A)。PEG胁迫处理6 h后, ScCBF1表达量达到最大值, 随着胁迫时间增加, 表达量逐渐降低, 胁迫处理48 h后, 基因表达量最低(图5-C)。ABA胁迫处理6 h后基因表达量最大, 6 h表达量约是0 h的3倍, 表明ScCBF1受ABA诱导表达, 进而说明该基因在逆境胁迫应答过程中, 可能是通过依赖ABA途径来进行(图5-D)。ScCBF1基因的组织差异特异性表达结果表明, ScCBF1在根中表达量最高, 其次是在茎中表达, 在叶中的表达量最小(图6)。
将重组质粒pGEX-6P-1-ScCBF1转化至大肠杆菌DH5α 感受态细胞, 经过蓝白斑筛选, 对构建的重组质粒用EcoR I、Xho I内切酶进行双酶切鉴定和质粒PCR验证, 酶切产物呈现清晰的两条泳带, 分别在600 bp (目的基因片段)和5000 bp (载体片段)左右; 质粒PCR结果显示只有一条单一的目的基因条带(600 bp左右)。对重组质粒测序显示, 序列与原克隆序列一致, 表明原核表达载体构建成功(图7), 命名为pGEX-6P-1-ScCBF1。重组质粒SDS-PAGE电泳结果显示, 在分子量50 kD左右处可见一条特异性条带, CBF1蛋白的大小理论约为22 kD, 加上pGEX- 6P-1载体上的GST标签蛋白大小约为26 kD, 因此与本文预测的蛋白大小基本相符, 可以确定该融合蛋白成功表达(图8)。为进一步开展ScCBF1基因的遗传转化工作奠定了有益基础。
本研究克隆得到的甘蔗CBF基因ScCBF1具完整ORF, 有物种特性, 在进化过程中选择压力大, 有很高的保守性, 其表达具组织特异性, 预测在正常生长条件下主要在根部执行功能。ScCBF1基因在低温、干旱或ABA胁迫下上调表达, 在NaCl胁迫处理下, 表达量明显下调。不同物种的CBF基因对非生物逆境的响应存在差异, 在拟南芥中, DREB/CBF基因在低温逆境下诱导表达, 但不被高盐和干旱逆境诱导表达[18]; 在玉米中, CBF基因在低温、干旱、高盐逆境下被诱导表达, 在ABA胁迫下不被诱导表达[5]; 在黑麦草中的DREB/CBF基因在低温逆境下被诱导表达, 但在高盐、干旱和脱落酸逆境下不被诱导表达[19]; 而大豆中, DREB/CBF基因在低温逆境下被诱导表达, 不被干旱、高盐和脱落酸诱导表达[20]。ABA作为逆境胁迫信号在提高植物抗逆性中的作用已成为共识[21, 22]。Liu等[23]研究表明, 拟南芥在低温或干旱情况下会产生ABA, 并通过CRT/DRE元件诱导COR (cold-regulated gene)基因表达, 从而提高植物抗冷性。本研究结果表明, ScCBF1基因表达与ABA相关, 说明ScCBF1基因可能是通过依赖ABA胁迫应答途径来参与胁迫应答过程。CBF1基因在不同物种中的差异表现, 说明该基因具有对非生物逆境应答的一般功能, 还具有物种特异性[24]。因此, 在不同的物种中, CBF1基因响应非生物逆境的表达分子调控机制可能会有所不同。甘蔗是复杂的非整倍体植物, 栽培种甘蔗染色体倍数为10, 存在很多等位基因, 其调控模式可能更加复杂。
ScCBF1在大肠杆菌中成功诱导表达, 证明了本研究获得的ScCBF1基因的编码框的正确性, 为进一步了解该基因在甘蔗逆境胁迫应答机制中的作用, 通过遗传转化手段进一步验证该基因的功能奠定了实验基础[25]。
从甘蔗中克隆得到ScCBF1基因, 其ORF长为603 bp, 编码200个氨基酸。ScCBF1与高粱和玉米的该基因同源性分别高达96%和94%。该基因在根、茎、叶中均有表达, 其中在根中的表达量最大。ScCBF1基因受低温胁迫诱导其表达量在短时间内迅速上调, 能在干旱、ABA胁迫下诱导表达, 而在高盐逆境下, 抑制ScCBF1基因的表达。推测该基因在逆境信号传导及植物抗逆过程中扮演重要作用。在大肠杆菌中成功表达ScCBF1蛋白, 证明该基因确实能够编码相应蛋白。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|