第一作者联系方式: E-mail: hzxm0316@163.com
植物防御素具有广谱抗菌活性, 不仅具有抗真菌、抗细菌、蛋白酶抑制和昆虫淀粉酶抑制等活性, 而且参与调节植物的生长和发育。本研究根据白菜防御素基因序列设计引物, 从甘蓝型油菜中克隆获得5个防御素基因, 其cDNA全长325~461 bp, 含有177~243 bp开放阅读框, 编码58~80个氨基酸, 含有8个保守Cys残基, 具备Knot1功能域。系统进化分析表明, BnPDF2.1、BnPDF2.3、BnPDF2.5与拟南芥PDF2亲缘关系较近, 可能具有蛋白酶抑制活性。荧光定量分析表明, 防御素基因具有组织表达特异性, 在花蕾和叶中表达量较高, 角果中次之; 经1 mmol L-1水杨酸处理开花期油菜2 h后, 防御素基因在茎、花蕾、角果中的表达量均有不同程度的上调, 但在叶中表达有所下调, 在根中表达无明显变化。
Plant defensins show a broad spectrum of antimicrobial activity, which not merely have antifungal activity, antibacterial activity, proteinase inhibitory activity and insect amylase inhibitory activity, but play roles in regulating plant growth and development as well. According to the sequences of B. rapa defensin genes, specific primers were designed to clone five B. napus defensin genes. The lengths of cDNA sequence were between 325 and 461 bp, with 177 to 243 bp of open reading frames (ORFs), encoding polypeptides of 58 to 80 amino acid residues. The amino acid sequences of plant defensins showed a big difference, but the six to eight conservative cysteine residues contained were stable. All the five cloned B. napus defensin genes contained a conservative Knot1 function domain. Phylogenetic analysis showed that BnPDF2.1, BnPDF2.3, BnPDF2.5 and Arabidopsis thaliana PDF2 were clustered into a group, which indicates they may have a protease inhibitory activity. RTFQ PCR analysis indicated that B. napus defensin genes were expressed in various organs, but the levels of expression were obviously different. The higher expression appeared in the bud and leaf, following silique. During the flowering stage, 1 mmol L-1SA was used to treat B. napus for 2 hours, which caused the expression levels of defensin genes to be increased in varying degrees in the stem, bud, and silique, but decreased in the leaf, and even no remarked change in the root.
植物防御素是一类分子量小(5 kD)、呈碱性、富含半胱氨酸的短肽, 在微摩尔浓度下就能表现出广谱抗菌活性[1]。植物防御素的抗微生物活性主要表现在抗真菌上, 而对一些革兰氏阳性菌也存在抑制作用, 不过其抑制作用较对真菌偏弱, 这些特性使植物防御素成为蛋白质工程和植物抗病虫害基因工程的优良候选材料[2]。植物防御素还能与其他抗菌化合物共同作用, 有助于增强植株抗性, 最终使植株获得对非生物胁迫的适应[3, 4], 除此之外, 植物防御素PsD1可与细胞周期蛋白结合, 这一发现开辟了人类肿瘤治疗的新思路[5, 6, 7]。植物防御素以其广泛的抗菌谱和高效性的特点, 有望成为一种新型抗菌药和抗肿瘤药物, 对农业生产和人类健康带来深远影响。研究发现, 拟南芥防御素基因的表达具有组织特异性, 有些防御素基因的表达受到感染菌的影响而上调或下调, 而另外一些基因的表达不受感染菌的诱导[8, 9]。水杨酸(SA)是一种简单的酚类化合物, 越来越多的研究表明, SA是能够激活植物过敏反应和系统获得性抗性的重要内源信号分子, 可影响许多生理生化过程, 如促进开花、抑制气孔关闭、离子吸收及植物防卫反应等, 然而, 目前关于SA诱导植物防御素相关基因表达方面的报道还比较少[10]。2001年从甘蓝(Brassica oleracea)中克隆到1个防御素基因(AJ311046); 2004年, 首次报道从油菜中克隆到防御素基因PDF1.2, 经油菜黑胫病病原接种后PDF1.2表达量增加了3倍以上[11]; 2008年从白菜(Brasica rapa)中克隆出防御素基因BcAF, 被霜霉菌(Peronospora parasitica)侵染12 h后, BcAF在白菜叶中的表达量升高到最大值[12]。
本研究利用白菜基因组数据库中白菜防御素基因为参比序列, 同源克隆了5个甘蓝型油菜防御素基因, 经PCR扩增和测序验证后对其序列进行了生物信息学分析, 利用荧光定量PCR技术分析了防御素基因的表达模式, 以及外源细胞信号分子SA对其表达的影响, 以期为进一步鉴定防御素基因的生物学功能和表达调控机制提供理论依据。
2013年11月, 将本课题组保存的甘蓝型油菜09B播种于重庆师范大学生命科学学院实验基地。植株长至蕾苔期时, 使用5 mL不同浓度的SA (0.1、0.5、1.0和2.0 mmol L-1)喷施花蕾, 2 h后, 取花蕾于液氮中速冻, -80℃保存备用。在开花期, 当植株长出幼嫩角果(约4 cm)时, 利用800 mL SA (1.0 mmol L-1)喷施植株, 并浇根部, 2 h后分别取植株的根、茎、叶、花蕾、角果于液氮中速冻, -80℃保存备用。以未经处理的植物材料作为对照。
使用植物基因组DNA快速抽提试剂盒(Sangon)提取油菜DNA。使用RNAiso Plus (TaKaRa)提取油菜RNA, 按照PrimeScript RT Reagent Kit with gDNA Eraser (TaKaRa)试剂盒操作说明使用gDNA Eraser去除基因组DNA后, 逆转录为cDNA, 于-20℃冰箱保存备用。
根据数据库BRAD (http://brassicadb.org/brad/)中白菜防御素基因(Bra008225、Bra016501、Bra017421、Bra026615和Bra029208), 利用Primer Premier 5.0软件设计特异性引物(表1), 分别以油菜DNA和cDNA为模板进行PCR扩增。PCR产物经1%琼脂糖凝胶电泳后, 将目标片段回收纯化、克隆和测序。
| 表1 PCR引物 Table 1 The primers used for PCR |
根据测序结果, 使用BioEdit软件分析甘蓝型油菜防御素基因序列, 寻找开放阅读框(ORF), 并将核苷酸序列翻译成氨基酸序列; 利用Clustal X软件对油菜防御素基因的核酸序列及蛋白质序列比对分析; 利用GSDS软件(http://gsds.cbi.pku.edu.cn/)分析防御素基因结构; 使用MEME (http://meme.nbcr.net/meme/)在线分析防御素基因的保守结构功能域; 根据生物信息学软件SignalP (http://www.cbs.dtu.dk/services/S-ignalP/)预测防御素蛋白的信号肽及剪切位点; 利用TargetP软件(http://www.cbs.dtu.dk/services/TargetP/)对甘蓝型油菜防御素蛋白进行亚细胞定位分析; 利用MEGA 4.0软件及Tamura等的NJ算法[13], 构建系统进化树。
根据克隆测序得到的甘蓝型油菜防御素cDNA序列, 设计荧光定量PCR引物(表1); 使用SYBR premix ExTaqII荧光定量试剂盒(TaKaRa), 以甘蓝型油菜β -actin为内参基因, 进行荧光定量PCR分析, 每组试验3个生物学重复, 每个样品3次技术重复; 采用2-Δ Δ Ct法统计分析数据, 计算防御素基因在甘蓝型油菜不同组织部位的相对表达量, 并求出标准偏差, 利用Microsoft Excel绘制出相对表达量的柱形图。
克隆获得5个防御素基因全长序列, 将其分别命名为BnPDF1.2、BnPDF1.4、BnPDF2.1、BnPDF2.3和BnPDF2.5。防御素基因cDNA全长在325~461 bp之间, 含177~243 bp开放阅读框, 编码58~80个氨基酸(表2)。BnPDF2.5丢失内含子结构, 外显子在序列上的进化保守性高于内含子(图1)。
| 表2 油菜防御素基因 Table 2 Plant defensin genes from Brassica napus |
甘蓝型油菜与甘蓝(Brassica oleracea)、拟南芥(Arabidopsis thaliana)、白菜防御素基因编码的氨基酸序列具有较高的同源性(图2), 其中由8个Cys组成的稳定结构是其保守结构, 因此单体蛋白能形成4个二硫键, 对维持防御素的整体结构起着重要作用, 这种保守的Cys在其他物种中也同样存在, 可见这些结构在种间发挥功能具有统一性, 所以在进化上被选择延续。不同防御素氨基酸序列在8个保守的Cys以外还存在广泛的序列差异, 对应位点只有4个较为保守的氨基酸残基分别是第29、第59位谷氨酸, 第38位丝氨酸, 第64位甘氨酸, 许多其他对应位点氨基酸残基则是高度相似。
5个甘蓝型油菜防御素基因均含有1个Knot1结构, 除BnPDF2.5以外, 其他防御素基因均含有1个跨膜区域。Knot1是植物抗菌肽、植物蛋白酶抑制剂、淀粉酶抑制剂、昆虫α -淀粉酶抑制剂、富含半胱氨酸的抗真菌蛋白, 以及植物γ -硫堇家族的主要功能域, 主要参与防御应答反应, 意味着植物受到病害侵袭时, 防御素能够参与到抗逆途径中, 传递防御相关信号或者直接作用于病害, 从而减轻植物的伤病[14]。
防御素含有3个保守基序(图3), motif 3是防御素的跨膜结构区域, 是防御素发挥正常功能所必须的结构, BnPDF1.4和BnPDF2.5在进化过程中, 因为基因碱基突变或碱基缺失, 丢失了保守的motif 3, 可能影响着基因的表达和功能。BnPDF1.2、BnPDF1.4与BnPDF2.1、BnPDF2.3、BnPDF2.5分别具有作为防御素功能区域的motif2、motif1, 意味着防御素功能可能产生了分化。
4个甘蓝型油菜防御素具有信号肽结构, 而未检测到BnPDF2.5的信号肽。BnPDF1.2、BnPDF1.4、BnPDF2.1和BnPDF2.3蛋白被定位于分泌通路(表3), 分泌到细胞周质, 因此, 可能是分泌蛋白。当植物受到危害时, 防御素基因BnPDF1.2、BnPDF1.4、BnPDF2.1和BnPDF2.3编码的蛋白可能在核糖体上合成后, 通过内质网膜进入内质网内腔, 最终成为分泌蛋白, 被分泌到细胞外, 存在于细胞间隙, 发挥抗病作用, 构成植物的第一道免疫屏障。BnPDF2.5无信号肽, 不能分泌到细胞外, 属于胞内蛋白, 但含有保守基序和功能结构域, 说明它可能依然参与防御反应, 但其防御机制与其他防御素的作用机制不同。
| 表3 甘蓝型油菜防御素亚细胞定位 Table 3 Subcellular localization of B. napus defensins |
甘蓝型油菜防御素被聚为两大类(图4), 每一个大类又分为2个亚类, BnPDF1.2、BnPDF1.4及其对应的白菜防御素与拟南芥的PDF1聚为一类, BnPDF2.1、BnPDF2.3、BnPDF2.5及其对应的白菜防御素与拟南芥的PDF2聚为一类, 在拟南芥中, PDF2的功能被注释为蛋白酶抑制剂[15], 表明BnPDF2.1、BnPDF2.3、BnPDF2.5可能也具有蛋白酶抑制活性。
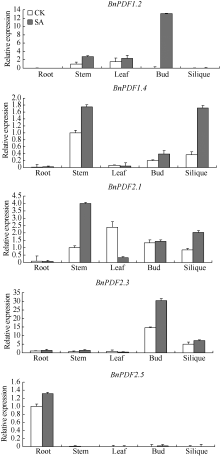
荧光定量PCR表明内参基因β -actin和防御素基因标准曲线的线性相关系数> 0.99, PCR扩增效率在0.9~1.2范围内, 熔解曲线峰单一(图5)。防御素基因BnPDF1.2、BnPDF1.4、BnPDF2.5表达量较低, 其中, BnPDF1.2仅在茎、叶中有微量表达; BnPDF1.4在茎、花蕾、角果中微量表达; BnPDF2.5只在根中微量表达, 在其他组织器官中基本不表达。而BnPDF2.1、BnPDF2.3在甘蓝型油菜根、茎、叶、花蕾、角果中均有表达, 但表达量存在明显差异, 其中BnPDF2.3在花中的表达量最高, BnPDF2.1在叶中表达量最高, 在根中表达量低。这说明防御素为油菜各个组织器官所必需, 以最大程度保护植株抵御病害; 同时, 不同防御素基因具有组织器官表达特异性, 在同一组织中表达低的防御素所发挥的功能可能被表达高的防御素所替代或补充。少量防御素基因高表达, 不仅能够积极快速应答以抵御病害侵袭, 还能够使能效利用达到最大化, 有利于植株正常生长。防御素基因在花蕾、角果中表达量较高, 可能因为花蕾和角果中含有丰富的营养物质, 易受病害侵袭, 意味着防御素在甘蓝型油菜的开花和种子发育过程中具有十分重要的作用。
图6表明, 随着SA浓度的增大, 油菜防御素基因BnPDF2.1、BnPDF2.3的相对表达量均先上升后下降, 当SA的处理浓度为1 mmol L-1时, BnPDF2.1、BnPDF2.3的相对表达量达到最大值。在一定范围内, 防御素基因的相对表达量随着SA处理浓度的增大而增大, 可能是随着植株受危害程度加大, 防御素基因表达量提高, 加强了防御信号的传导, 植株表现出积极防御应答。当SA浓度大于1 mmol L-1时, 防御素基因的相对表达量急剧下降, 可能是过高浓度的SA已经威胁到植株正常生长和自身的防御系统的正常应答。
 | 图6 水杨酸对防御素基因在花蕾中表达水平的影响Fig. 6 Effect of salicylic acid on expression level of defensin genes in Brassica napus buds |
经1 mmol L-1 SA处理2 h后, 油菜防御素基因BnPDF1.2、BnPDF1.4、BnPDF2.1、BnPDF2.3、BnPDF2.5在茎、花蕾、角果中的表达量均有不同程度上调, BnPDF1.2原本在花蕾中不表达, 经SA诱导后, BnPDF1.2在花蕾中高表达, BnPDF1.4在角果中表达量提高了4倍, BnPDF2.1在茎中的表达量提高了约3倍(图7); 除BnPDF1.2在叶中的表达量略有上升外, BnPDF1.4、BnPDF2.1、BnPDF2.3在叶中的表达均下调; 油菜防御素基因在根中表达量均很低, 经SA处理后, 表达量变化不明显。诱导抗病性所需外源SA的浓度影响着植物体内的内源SA含量, 内源SA直接参与植物抗逆信号传导过程, 防卫基因在不同组织中表达的快慢与表达量的多少与抗逆信号传递快慢有关[16]。防御素在叶片中表达下调, 原因可能是在其表达过程中, 诱导其基因表达信号的传递受到了阻碍。
甘蓝型油菜(2n=4x=38, AACC)是由甘蓝(2n= 2x=18, CC)与白菜(2n=2x=20, AA) 经历天然杂交和自然加倍后形成, 因此, 甘蓝型油菜的基因组同时包含甘蓝与白菜几乎所有的基因序列[17, 18]。本研究根据白菜防御素基因序列设计引物, 从甘蓝型油菜中克隆得到5个防御素基因, 将其与油菜基因组数据比对分析, 发现每一个油菜防御素基因都可以找到2个或更多的拷贝, 这些重复基因在来源于白菜和甘蓝的染色体上均有分布。生物信息学分析表明, 不同的防御素基因氨基酸序列显示出较大的差异, 但8个保守的Cys残基均存在, 从而保证了二硫键的形成, 分子内二硫键对于维持防御素的结构稳定性具有重要作用, 也是防御素抗微生物活性和细胞毒效应的重要结构基础[2]。植物防御素的精确作用机制, 目前尚未得到证实, 本研究发现的油菜防御素BnPDF2.1、BnPDF2.3作为分泌蛋白, 存在于细胞间隙, 可能具有蛋白酶抑制活性, 从而抑制病原菌蛋白酶对寄主组织的降解[19]; 植物防御素也可能进入靶细胞内, 通过抑制靶细胞蛋白酶的活性, 从而达到抗逆的效果。BnPDF2.5不具备跨膜结构和信号肽序列, 因而不能被信号肽转运到细胞外, 可能通过参与胞内防御信号级联放大传导过程而发挥抗病作用, 但其具体功能还有待进一步研究。
植物防御素的作用主要是抵抗病原菌, 在植物体内往往分布在病菌容易入侵的部位, 或者是病菌扩展的通道, 这与其生物学功能是一致的, 而种子的胚、花的花粉囊是植物营养最充足的部分, 这可能是植物防御素在这些部位中大量表达的原因[20, 21]。不同防御素基因在不同油菜组织中表达量与其所参与的生物学功能重要程度有关, 在同一组织中表达低的防御素所发挥的功能可能被表达高的防御素所替代或补充。越来越多的研究发现, 内含子对基因表达具有正调控作用, 目前在许多基因的内含子中均发现了基因表达的调控元件, 其中大多为增强元件, 如发现猪的MyHC (myosin heavy chain)基因内含子中存在重要的调控元件, 可以调控转录的起始来增强基因的表达[22]。本研究中, BnPDF2.5缺失了内含子结构, 且BnPDF2.5表达量极其微弱; 油菜防御素基因BnPDF2.1、BnPDF2.3的内含子序列较BnPDF1.2、BnPDF1.4内含子长约200 bp, 而防御素BnPDF2.1、BnPDF2.3较BnPDF1.2、BnPDF1.4表达丰度高。不同的防御素基因可能因内含子结构全部或部分丢失, 导致一些表达调控元件的丢失, 从而造成其表达差异, 这种猜测还需要进一步验证。
油菜防御素基因家族虽然成员众多, 但不同防御素基因各司其职, 在通常情况下, 在各组织中均有较高表达的油菜防御素基因BnPDF2.1、BnPDF2.3便可积极响应防御应答, 保护植株免受侵害; 只有当受到病害侵袭时, 其他防御素基因BnPDF1.2、BnPDF1.4、BnPDF2.5才迅速反应, 共同抵御病害。
从甘蓝型油菜中克隆获得了5个防御素基因, 它们的ORFs全长325~461 bp, 含有177~243 bp开放阅读框, 编码58~80个氨基酸, 具有典型的Cys组成的保守结构域。防御素基因具有组织器官表达特异性, BnPDF1.2仅在茎、叶中有微量表达, BnPDF1.4在茎、花蕾、角果中微量表达, BnPDF2.1、BnPDF2.3在根、茎、叶、花蕾、角果中均有表达, 但表达量存在明显差异, BnPDF2.5只在根中特异表达。外源SA能够诱导油菜防御素基因的表达, 说明这些基因可能在甘蓝型油菜抵御病原菌侵染等过程中发挥一定的防卫作用。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|