第一作者联系方式: E-mail: ynlwf@163.com, 0873-7227004
为明确甘蔗野生资源对黑顶柄锈菌的抗性水平, 了解 Bru1基因在甘蔗野生资源中的分布状况, 于2013年对中国国家甘蔗种质资源圃保存的31份野生核心种质资源进行苗期抗褐锈病鉴定和抗褐锈病基因 Bru1的分子检测。结果表明, 31份供试材料中, 高抗(1级)至中抗(3级)的有28份, 占90.3%。其中19份材料表现高抗(1级), 占61.3%, 3份材料表现抗病(2级), 占9.7%, 6份材料表现中抗(3级), 占19.4%。31份供试材料中只有贵州78-2-12、云南97-4、 E. rockii 95-19、 E. rockii 95-20、云南83-224、广西79-8、云南95-35和广西89-13含抗褐锈病基因 Bru1,占参试材料的25.8%; 其余20份抗病材料和3份感病材料均不含抗褐锈病基因 Bru1,表明除 Bru1外, 可能还有其他抗褐锈病基因存在。结果暗示中国国家甘蔗种质资源圃保存的野生核心种质资源中蕴藏着优良的抗褐锈病基因, 是选育抗褐锈病甘蔗品种很有利用前景的抗源种质。
The objectives of this study was to clarify the level of resistance to Puccinia melanocephala and the distribution of Bru1 in sugarcane wild germplasm collections. Resistance of 31 wild core germplasm from National Nursery of Sugarcane Germplasm Resources (NNSGR, Kaiyuan, China) was identified at seedling stage, and the resistance gene Bru1 was detected in 2013. The results showed that 28 out of 31 materials (90.3%) were highly resistant (Grade 1) or moderately resistant (Grade 3). Of them, nineteen (61.3%) were highly resistant (Grade 1), three (9.7%) were resistant (Grade 2) and six (19.4%) were moderately resistant. Bru1 was detected in eight (25.8%) resistant materials (Guizhou 78-2-12, Yunnan 97-4, E. rockii 95-19, E. rockii 95-20, Yunnan 83-224, Guangxi 79-8, Yunnan 95-35, and Guangxi 89-13). The absence of Bru1in other 20 resistant and three susceptible entries suggests they may contain brown rust resistance-associated genes other than Bru1. Therefore the elite brown rust resistance gene should be contained in numerous sugarcane wild core germplasm collections of NNSGR, and be valuable for future brown rust resistant breeding programs in sugarcane.
由黑顶柄锈菌(Puccina melanocephala H. Sydow & P. Sydow)引起的甘蔗褐锈病是一种重要的世界性甘蔗病害, 常造成巨大的经济损失[1, 2]。该病自1890年在爪哇首次被发现以来, 随后迅速扩散到世界上多数植蔗国家和地区, 并多次爆发流行, 致使一些丰产高糖当家品种如Co475、T34362和CP78-1247被淘汰[3, 4, 5, 6, 7, 8]。目前, 该病也是我国蔗区最普遍, 危害最严重的病害之一, 造成甘蔗种质退化、产量降低[9, 10, 11, 12]。据调查, 发病严重田块, 一般减产15%~30%, 严重地块减产达40%以上, 蔗糖分降低10%~36% [13, 14]。甘蔗褐锈病的蔓延, 使我国蔗区主栽的一批丰产高糖品种因高度感病而面临淘汰, 极大地影响了蔗糖产业的持续稳定发展[13]。甘蔗锈病的流行与品种抗病性密切相关, 大面积种植感病品种是病害流行的重要原因, 选育和种植抗病品种是防治该病最经济有效的措施。而抗病种质资源的发掘利用是抗病育种的基础和关键。目前, 我国对甘蔗锈病抗病资源的筛选鉴定和评价还停留在人工接种表型观察选择[15, 16], 尚未开展抗锈病基因标记选择研究。传统的人工接种表型选择抗病性的方法耗时、低效, 鉴定结果易受病原和环境因素影响, 难以满足育种家对抗病育种要求。随着分子标记技术的发展, 利用与抗病基因紧密连锁的分子标记可以有效地追踪抗病基因。国外研究人员已在栽培品种R570上发现和定位甘蔗抗褐锈病主效基因Bru1[17, 18], 该基因被证实对来自不同国家地区的褐锈病菌分离物具有抗性[19], 并已开发出与Bru1密切相关的2个分子标记用于种质鉴定[20]。
甘蔗野生种质资源具有耐旱、耐瘠、抗逆性强等特点, 是甘蔗品种改良中抗逆基因的重要来源之一[21]。因此, 鉴定和筛选甘蔗野生核心种质资源, 特别是割手密和斑茅中的抗性种质, 转育和利用它们含有的有效抗性基因对选育抗病品种具有重要意义。本研究拟了解Bru1基因在甘蔗野生资源中的分布状况, 为有效地开展甘蔗抗褐锈病育种提供优良抗源材料和参考依据。
选用中国国家甘蔗种质资源圃保存的的31份野生核心种质资源(表2), 感病对照为选3, 抗病对照为闽糖70-611, 含Bru1基因模式品种R570。
2013年5月种植在云南省农业科学院甘蔗研究所(云南开远), 将各材料分别种植在直径35 cm、高30 cm的塑料桶内, 桶内装入2/3的土壤和有机质(3∶ 1), 每份材料4桶, 4次重复, 每桶5株, 共20株, 随机排列, 常规管理。
2013年8月26日为甘蔗锈病发生盛期。从云南勐海发病蔗区田间采集带黑顶柄锈菌孢子的发病蔗叶, 浸泡于盛有2/3清水的塑料盆中1~2 h后, 用手边搓揉边取出发病蔗叶, 两层纱布过滤, 滤液即为用于接种的孢子悬浮液。搅拌均匀后用血球计数板计数孢子数, 接种浓度为10× 104个孢子 mL-1。
于2013年8月28日傍晚喷雾接种, 用手动背负式喷雾器将上述接种液均匀地喷于蔗叶上, 接种量控制在孢子悬浮液在蔗叶上不流淌为宜。接种前对桶栽材料充分浇水以增加湿度。接种后将桶栽材料置遮光网棚中正常管理, 每天用清水喷淋2~3次保湿, 雨天不用喷淋。
接种后4~5周调查供试材料发病情况。根据叶片感染状况描述、记载逐份材料叶片病情, 同时目测估计顶部可见肥厚带叶片的侵染面积百分率。褐锈病的分级标准为1~9级。其中, 叶片无症状为1级高抗; 叶片有坏死斑, 病斑占叶面积10%以下为2级抗病; 植株上有一些孢子堆, 病斑占叶面积11%~25%为3级中抗; 上层1~3片叶有一些孢子堆, 同时下层叶有许多孢子堆, 病斑占叶面积26%~35%为4级中感; 上层1~3片叶有极多孢子堆, 同时下层叶有轻微的坏死, 病斑占叶面积36%~50%为5级感病1; 上层1~3片叶有极多孢子堆且下层叶有比第5级更多的坏死, 病斑占叶面积51%~60%为6级感病2; 上层1~3片叶有极多孢子堆, 下层叶坏死, 病斑占叶面积61%~75%为7级感病3; 上层1~3片叶有某些坏死, 病斑占叶面积76%~90%为8级高感1; 叶片坏死, 植株濒于死亡, 病斑占叶面积91%~100%为9级高感2。抗性评价见表1[22]。
| 表1 甘蔗褐锈病抗病性鉴定评价标准 Table 1 Identification standard of sugarcane resistance to brown rust disease |
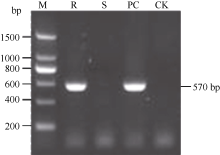
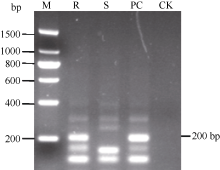
参照Costet等[20]的方法设计甘蔗抗褐锈病基因Bru1的PCR标记R12H16和9O20-F4引物, 委托上海生物工程公司合成。R12H16标记上游引物为5′ -CTACGATGA AACTACACCCTTGTC-3′ , 下游引物为5′ -CTTATGTTA GCGTGACCTATGGTC-3′ , 预期扩增产物长度为570 bp; 9O20-F4标记上游引物为5′ -TACATAATTTTAGTGGCAC TCAGC-3′ , 下游引物为5′ -ACCATAATTCAATTCTGCAG GTAC-3′ , 预期扩增产物长度为200 bp。分别采集各材料充分展开的第一片新叶, 采用北京全式金生物技术公司的Easy Pure plant Genqmic DNA Kit植物DNA提取试剂盒按照说明书提取叶片总DNA, 用Eppendorf AG 22331蛋白/核酸分析仪鉴定提取质量。
以抽提的叶片总DNA为模板, 分别以R12H16和9O20-F4标记为引物对各材料进行PCR扩增检测。R12H16标记扩增体系25 µ L, 包括ddH2O 9.5 µ L、2× PCR Taq混合物12.5 µ L、DNA模板2.0 µ L、上下游引物各0.5 µ L (20 µ g µ L-1); 9O20-F4标记扩增体系25 µ L, 包括ddH2O 13.0 µ L、2× PCR Taq混合物10.5 µ L、DNA模板1.0 µ L、上下游引物各0.4 µ L (20 µ g µ L-1)。参照Costet等[20]的扩增程序2个标记的PCR均为, 94℃预变性5 min; 94℃变性30 s, 55℃退火30 s, 72℃延伸45 s, 35个循环; 72℃延伸5 min。
R12H16标记PCR扩增产物直接用1.5%琼脂糖凝胶电泳检测; 9O20-F4标记的阳性结果需要通过限制性内切酶Rsa I的消化产物来判别, 即取9O20-F4标记PCR产物15 µ L、10× NEB缓冲液2.5 µ L、RsaI (10 000 U) 1.0 µ L、加ddH2O 6.5 µ L补足25 µ L进行酶切, 酶切反应程序为37℃ 2 h、65℃ 10 min, 酶切结束取酶切反应产物10 μ L, 以2%琼脂糖凝胶电泳检测。
31份供试材料中, 1级高抗至3级中抗的有28份, 占90.3%。其中19份材料表现1级高抗, 占61.3%, 3份材料表现2级抗病, 占9.7%, 6份材料表现3级中抗, 占19.4%; 3份材料表现为4级中感, 占9.7% (表2)。
| 表2 甘蔗野生核心种质资源褐锈病抗性及Bru1的PCR检测 Table 2 Brown rust resistance and PCR detection of Bru1 in sugarcane wild core germplasms |
PCR扩增结果表明抗病对照闽糖70-611和含Bru1模式品种R570均分别稳定扩增出2个标记的特异性条带, 而感病对照选3和空白对照未扩出特异性条带(图1和图2), 各样品重复检测结果一致, 表明2个特异性标记R12H16和9O20-F4均能稳定地检测出抗褐锈病基因Bru1。
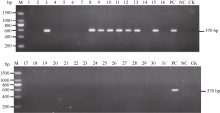
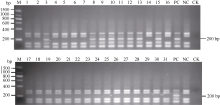
31份供试材料中只有贵州78-2-12、云南97-4、E. rockii 95-19、E. rockii 95-20、云南83-224、广西79-8、云南95-35和广西89-13含有抗褐锈病基因Bru1, 占参试材料的25.8%; 其余20份抗病材料和3份感病材料均不含抗褐锈病基因Bru1(图3、图4和表2)。
Bru1是由Daugrois等[17]和Asnaghi等[18]在甘蔗品种R570上发现和定位的第1个甘蔗抗褐锈病主效基因, 它位于甘蔗第7条染色体0.42 cM区域内, 并与高粱第4条染色体大约在225 kb区域及水稻第2条染色体的短臂上600 kb区域具有同线性[23], 该基因对不同地区的褐锈病分离物具有广谱的抗性, 对甘蔗抗锈病育种具有非同寻常的意义[19]。Costet等[20]开发出与Bru1密切相关的2个分子标记R12H16-PCR和9O20-F4-PCR-RsaI, 用它们对覆盖全球的380份甘蔗品种和育种材料检测发现, 86%抗病材料中有Bru1, 而所有感病材料均不含抗褐锈病基因Bru1, 表明2个标记能有效地鉴定抗褐锈病基因Bru1。这为利用分子标记辅助选择抗锈病育种提供了机会, 有助于在甘蔗种质资源及大批量后代材料中高效、准确地筛选抗锈病材料, 缩短育种时间, 增加抗褐锈病育种的成功率。
甘蔗野生资源是现代甘蔗育种中抗病基因的重要来源, 因此, 对它们进行系统的抗病鉴定和评价, 从中筛选抗源材料, 挖掘野生抗病基因资源提供育种利用, 拓宽甘蔗抗病遗传基础, 对选育抗病品种具有重要意义。本研究对中国国家甘蔗种质资源圃保存的31份野生核心种质资源进行苗期抗褐锈病鉴定和抗褐锈病基因Bru1的分子检测, 明确了各野生核心种质资源对黑顶柄锈菌的抗性水平, 掌握了Bru1基因在甘蔗野生资源中的分布状况, 检测筛选到含有抗褐锈病基因Bru1的野生核心种质资源8份, 为有效地开展甘蔗抗褐锈病育种提供了优良抗源材料和参考依据。
Glynn等[24]对485个亲本和1072个杂交后代材料检测显示Bru1是佛罗里达甘蔗遗传基础中褐锈病抗性的主要来源, 存在由黑顶柄锈菌小种进化引起Bru1抗性丧失的潜在极端易损性威胁。Racedo等[25]研究揭示EEAOC常用亲本材料和种质资源中除Bru1外, 还存在甘蔗褐锈病潜在替代抗性来源, 这一发现对扩大甘蔗褐锈病抗性狭窄的遗传基础有帮助。云南是中国甘蔗野生资源重要的分布中心和世界野生甘蔗起源中心之一, 其复杂多样的地理及气候条件形成了丰富的甘蔗种质资源, 是中国乃至世界甘蔗遗传改良的天然珍贵基因库之一[26, 27]。本研究结果显示了中国国家甘蔗种质资源圃保存的野生核心种质资源(斑茅)中蕴藏着优良的抗褐锈病基因Bru1, 是选育抗褐锈病甘蔗品种很有利用前景的抗源种质; 另一方面, 有20份抗褐锈病野生核心种质资源(多为割手密)未检测到抗褐锈病基因Bru1, 显示除了Bru1外, 可能还有其他抗褐锈病基因存在, 有待进一步深入研究发掘, 以克服抗源单一, 而有选择性地增加其他类型抗病基因在抗病育种中的引入与利用, 避免由锈菌致病性变异引起Bru1抗性丧失的潜在威胁。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|