第一作者联系方式: E-mail: tyncreater@126.com, Tel: 0731-89733455 **同等贡献(Contributed equally to this work)
转绿型叶色突变体是研究植物叶绿体分化与发育的基础材料。 grc2是利用60Co-γ射线诱变籼型三系保持系T98B后获得的单叶独立转绿型黄化突变体。 grc2植株上任一叶片刚抽出时为黄色, 在生长10 d左右后变绿, 具有单叶不依赖于植株特定发育阶段而独立转绿的特性。与野生型T98B相比, grc2黄化叶片的总叶绿素和叶绿素b含量显著降低, 叶绿体滞留在黄化质体阶段, 表明 grc2可能在叶片早期发育中起关键作用。遗传分析表明, grc2受1对隐性核基因独立控制; 利用源于 grc2/Nipponbare的F2群体的960个突变单株, 将 grc2基因定位在STS标记S254与S258之间约31 kb的范围内, 该区域含有5个未报道过的注释基因。这些结果为 grc2的克隆及功能研究提供了重要信息。
Green revertible leaf-color mutants are basical materials for studying the mechanism of chloroplast differentiation and development. We have obtained a green-revertible chlorina mutant named grc2 with every leaf greening independently, from an indica maintainer line T98B treated by60Co-γ radiation. Each leaf of grc2 is initially chlorotic, and then turns green after growing about 10 days. The mutant grc2 showed a new pattern of virescence which refreshed green regardless of its plant growth stage. Compared with the wild type T98B, the total chlorophyll and chlorophyll b content reduced significantly in the yellowish leaves of grc2 and chloroplast remained in the etioplast stage, suggesting that grc2 would probably be an essential gene functioning in the development of young leaves. Genetic analysis revealed that, grc2 was controlled by a single recessive nuclear gene. The gene of grc2 was fine mapped between STS markers S254 and S258 with a physical interval of 31 kb on the short arm of chromosome 6, by using 960 F2 plants with mutant phenotype from a cross between grc2 and Nipponbare. This region contained five annotated genes that had not published. These results provides important information for studying in gene cloning and gene function of grc2.
叶色变异是发生在高等植物中的一类突变频率较高、变异类型较丰富、表型直观明显的性状突变。水稻叶色变异的表现形式多样, 按照苗期叶色表现, 可分为黄化、白化、浅绿、深绿、常绿、条纹和斑点等基本类型[1], 而按照叶色变异后能否转绿则可分为转绿和非转绿类型。转绿型突变体是一类在经历阶段性失绿后又能恢复到正常叶色形态的特殊叶色突变体, 这类材料具有重要的理论和应用研究价值: 一方面, 通过对这类突变体转色前、中、后各阶段的细胞学、生理生化及其基因表达与调控等水平的系统研究有助于认识叶绿素生物合成[2]与叶绿体发育[3]的基本规律, 增强对光合作用机理的了解; 另一方面, 通过将这类材料作为形态标记资源应用于水稻遗传改良, 可以显著提高良种繁育和杂交种生产过程中的除杂效率, 确保种子纯度[4, 5]。
不同转绿型突变体的失绿表型和转绿行为可能各有差异, 这为揭示叶绿体分化与发育的分子机制提供了丰富的试验材料。按照失绿表型, 可将转绿型突变体划分为白化转绿、条纹转绿和黄化转绿类型, 在已鉴定的约36个受隐性核基因控制的水稻转绿型叶色突变体中, 有31个属于白化转绿或条纹转绿类型, 仅有5个为黄化转绿类型。相关研究表明, 多数转绿型叶色突变体的转绿行为受温度、生育进程或二者的共同调控, 如受温度控制的w1[6]、w17[7]及w25[8]等突变体在相对低温条件下(如20~25℃)叶片呈白色, 随着温度升高(如达到30℃)叶色逐渐转绿; 而受生育进程控制的ysa[9]与hfa-1[10]等在苗期白化, 三叶期后开始转绿, 白化条纹转绿突变体st1转绿时期晚, 直至抽穗后叶片才转绿[11]。据不完全统计, 已完成了16个基因如gra[12]、wyv1[13]、sgra[14]等的精细定位, 以及6个白化转绿控制基因如v1[15]、v2[16]、v3和st1[11]、ysa[9]、hw-1(t)[17]和3个黄化转绿控制基因ygl1[18]、vyl[19]与grc1[20]的克隆。通过对已克隆基因的功能研究发现, 由于基因突变直接或间接地干扰到质体转录本的形成、编辑、剪接、稳定和翻译等过程, 导致叶绿素生物合成和叶绿体分化发育受阻, 降低了叶绿素特别是叶绿素b的含量, 从而表现为阶段性失绿现象[9, 11, 15, 16]。但是, 在失绿后生物体如何恢复到叶绿素合成和叶绿体发育正常秩序的相关机理还远未阐明, 这必然有赖于更多转色型突变体的挖掘及其深入而系统的基因功能研究。
grc2(green-revertible chlorina 2, grc2)是在辐射诱变三系保持系T98B的后代中发现的一个受单个隐性核基因控制的黄化转绿型突变体, grc2植株上的任一叶片在刚抽出时为黄色, 在经历10 d左右后全叶变绿; grc2叶片的转绿行为具有明显的个体独立性, 不受生育进程和温度控制, 这与其他转绿型材料多在植株发育至特定生育阶段或其生长环境温度达到特定要求后完成植株全部叶片变绿的转色行为完全不同。一方面, 这意味着grc2作为一个重要的功能基因程序性地调控了个体叶片的早期发育, 另一方面, 反映出了在遗传育种和杂交种除杂保纯上, grc2由于具有选择标记可辨别期长、对植株生理伤害相对较轻等优势可能较其他叶色标记更为理想[5]。鉴于grc2的重要理论和应用价值, 本研究利用BSA法将grc2基因精细定位至第6染色体短臂一个31 kb的区域, 为该基因的最终克隆及生物学功能解析奠定了基础。
在利用60Co-γ 射线诱变籼型三系保持系T98B成熟种子的M2代中鉴定出一个新型黄化转绿突变体grc2; 该突变体植株上新生的每一个叶片都为黄色, 尔后逐渐变绿; 连续种植8代, 均表现同一表型; 配制grc2和日本晴(Nipponbare, 简称Nipp)、湘恢299 (R299)等的杂交组合, 利用其F1和F2群体进行遗传分析和基因定位。
以野生型品种T98B为对照, 在三叶一心期标记突变体grc2新生的心叶; 参照Wellburn[21]的方法, 分别取生长5 d的黄化叶片与生长15 d的转绿叶片, 利用紫外分光光度计测定叶绿素a和叶绿素b的含量, 并计算总叶绿素含量。
分别以叶色正常的粳稻品种日本晴(Nipp)及籼稻品种湘恢299 (R299)与突变体grc2进行正交和反交, 观察F1的表型; 统计grc2/Nipp与R299/grc2两个组合的F2群体中突变表型和野生表型单株数量, 计算分离比; 通过对分离比例的卡方检验, 推断grc2的遗传方式。
利用grc2与Nipp杂交产生的F2代群体进行定位分析。按照CTAB[22]法提取亲本及F2单株叶片中的基因组DNA; 分别取F2代15个正常植株和15个黄化转绿植株叶片的DNA等量混合, 构建正常池和突变池。选取均匀覆盖12条染色体的268对SSR、Indel引物[由生工生物工程(上海)股份有限公司合成], 进行亲本多态性筛选, 根据多态性引物在正常池和突变池的基因型, 确定grc2所处的连锁群。在grc2所在的染色体上发展分子标记进行目的基因的连锁分析, 按照公式[(B+2A)/2n]× 100计算遗传距离并构建连锁图谱(其中A表示纯合显性单株数, H表示杂合显性单株数, n表示隐性群体数量)。在水稻注释计划数据库(RAP-DB, http://rapdb.dna.affrc.go.jp/)中, 查找定位区域内的基因信息。
用于检测分子标记的PCR总体系为12 μ L, 包括6.0 μ L的2× Easy Taq PCR SuperMix (TRANSGEN, 中国), 5.0 μ L的H2O和1.0 μ L的模板DNA。PCR程序为92℃预变性2 min, 92℃变性30 s, 55~63℃复性35 s, 72℃延伸40 s, 共32个循环; 最后, 72℃延伸5 min, 4℃保存备用。取1 μ L加入溴酚蓝的PCR产物点样于10%的非变性聚丙烯酰胺凝胶中, 在170 V恒定电压下电泳1.5~2.0 h, 硝酸银染色观察。
grc2是一个以“ 个体叶片” 为单位进行转绿的新型黄化突变体。在秧苗期, grc2自露芽、形成新叶至新叶生长5 d左右的时期内, 均为明显可见的黄化表型(图1-A, B); 至新叶生长10 d左右后, 叶片转为浅绿; 至生长15 d左右后, 叶色恢复至正常绿色; 在移栽后的整个营养生长期, grc2新生叶片同样表现出由黄转绿的叶色转换特性(图1-C, E), 这使得在同一植株上能同时观察到黄叶与绿叶两种叶色表型, 而野生型品种T98B的所有叶片自抽出至成熟过程中都表现为正常绿色(图1-C, D)。
grc2叶片在转绿前后的叶绿素含量变化明显, 转绿后叶绿素含量显著增加(图2)。grc2的心叶生长5 d后仍为黄色, 叶片总叶绿素、叶绿素b含量显著低于野生型品种T98B, 分别为T98B的76.12%与46.15%, 而叶绿素a含量与对照接近(为对照的95.12%)。心叶生长15 d后, 叶色转绿, 叶片叶绿素b含量大幅度增加, 达到了对照的85.23%; 由于叶绿素b的显著增加, 而叶绿素a含量变化不明显, 使得总叶绿素含量明显提高, 达到了对照的90.69%。由此推断, grc2是一个影响叶片早期发育的叶绿素b降低型突变体。
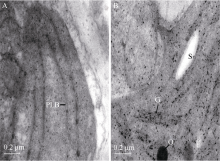
grc2叶片在转绿前后的叶绿体超微结构发生了明显地改变, 转绿后叶绿体发育正常(图3)。心叶生长5 d后(叶片为黄色), 其叶绿体发育处于黄化质体阶段, 叶绿体中以单个的原片层体居多, 基质稀疏(图3-A); 而心叶生长15 d后, 叶色变绿, 叶绿体发育成熟, 单个原片层经垛叠形成了基粒, 基质变得浓密, 并积累了淀粉粒和嗜锇粒, 为行使正常的生物学功能创造了条件(图3-B)。
正常叶色的粳稻品种Nipp、籼稻品种R299分别与突变体grc2的4个正反杂交F1组合都表现为正常叶色, 组合R299/grc2与grc2/Nipp的F2后代中分离出了正常叶色和黄化转绿2种类型单株, 二者理论分离比都符合3∶ 1, 表明grc2受1对隐性核基因独立控制(表1)。
| 表1 突变体grc2的遗传分析 Table 1 Genetic analysis of the grc2mutant |
在所使用的平均分布于12条染色体上的286对引物中, 有135对在Nipp和grc2之间具有多态性; 利用这些亲本多态性引物筛选正常池和突变池, 发现第6染色体上的多个SSR引物如RM587和RM204等在2个基因池间表现多态性, 特推断第6染色体为grc2所坐落的连锁群。
在此基础上, 再利用960个F2代隐性单株及第6染色体上新筛选的亲本多态性标记, 将grc2定位于RM19266与RM19275之间约220 kb的范围内; 利用RM19266与RM19275共检测出了10个与13个交换单株, 二者与grc2的遗传距离分别为0.57 cM和0.78 cM, 而介于这2个标记之间的RM19270没有检测出交换单株, 推断RM19270为grc2的共分离标记(图4-A)。为了更精细地确定grc2的定位边界, 在RM19270两侧设计了一系列序列标签位点(STS)标记, 如分别坐落于LOC_Os06g02540、LOC_Os06g02580、LOC_Os06g02600的S254、S258与S260等STS标记(表2); 结果显示, RM19270的左侧标记S254检测出了1个杂合显性单株, 而右侧标记S258与S260分别检测出了3个和5个杂合显性单株, 根据这一结果, 确定grc2位于S254与S258之间约31 kb的范围内, 推算S254、S258与grc2的遗传距离分别为0.05 cM和0.16 cM (图4-B, C)。RAP-DB数据库显示, 在这31 kb的定位区域内仅注释了5个非报道过的基因(表3), 这些基因编码与生长调控(LOC_Os06g02560)、囊泡运输与抗病(LOC_Os06g02570)、镍运输(LOC_Os06g02580)等相关的蛋白, 以及含保守肽uORF的转录产物(LOC_ Os06g02550)。
| 表2 grc2基因的连锁标记 Table 2 Sequence of markers linked with grc2 |
| 表3 grc2定位区域内基因信息 Table 3 Genes in mapping area ofgrc2 |
目前, 在grc2所定位的第6染色体上已鉴定了4个转绿控制基因, 分别是控制白化转绿的st1、v3、与v3等位的gra75, 以及控制黄化转绿的grc1, 但无论从位置上还是表型上都可推断grc2是一个新的叶色基因。在位置上, grc1位于第6染色体长臂, 而grc2与st1、v3同位于第6染色体上短臂, 但grc2与st1、v3分别相距2.5 Mbp和7.3 Mbp[11]。在表型上, v3和st1同时受温度和生育进程调控, 如在三叶期和四叶期之前的v3和st1叶片为绿色, 至分蘖期大部分叶片完全白化; 当将二者置于恒定20℃或30℃的条件下, 都出现了白叶表型, 当于30℃和20℃交替的条件下则几乎全绿[11]。相比而言, gra75和grc1只受生育进程调控, gra75的前3叶为绿色, 从第4叶开始出现白化, 至第8叶开始转为正常绿色[23]; 而grc1在四叶期以前叶片为黄绿, 在此之后叶色转为正常[20]。与st1、v3、gra75及grc1不同的是, 本研究所鉴定的叶色突变体grc2为新型黄化转绿表型, grc2植株上的任一叶片刚抽出后都为黄化, 尔后又能不依赖于植株发育阶段而独立转绿(图1), 这种独特的转色行为仅与vyl、热农1A等接近。vyl在全生育期都表现为黄化转绿, 其新生叶片为萎黄表型, 之后自顶端向下逐渐转绿[19]; 热农1A的每一片叶都经历幼叶黄化, 随后从叶尖向叶基部由黄转绿的动态发育过程[5]。为了从表型特征上科学区分这些转绿型材料, 我们认为, 可以按植株叶片是否具有独立转绿特性划分为两类, 一类是不受植株生育进程控制的单叶独立转绿型突变体, 如grc2和热农1A等; 另一类是依赖特定生育阶段的全植株转绿型突变体, 如v1和grc1等。由于在单叶独立转绿型材料的整个生育阶段几乎都有失绿叶的存在, 将此性状转育至三系和两系不育系中, 可有效延长除杂期, 有利于提高杂交种子纯度; 可见, 这类资源将在品种遗传改良上具有较大的应用前景。
通常根据叶色变异特点可以大致推断出突变基因的作用时期。在叶绿体发育的时间尺度上, 高等植物都必须经历由前质体至黄化质体再到成熟叶绿体的发展阶段。一般白叶突变体的叶绿体发育停滞在前质体(proplastid)阶段, 其叶绿体中填充了大量的囊泡, 难以形成片层, 这种破坏性的组织结构容易导致植株死亡[24, 25]; 而黄叶突变体一般能正常发育至黄化质体(etioplast)阶段, 其叶绿体中虽能积累大量的单个类囊体片层, 但仅有少量片层经相互垛叠形成基粒, 这种不正常的叶绿体结构通常会导致植株生长势下降[26]; 与白化或黄化突变体不同的是, 正常叶色材料经历的前质体和黄化质体时期非常短, 一般在见光数小时后叶绿体即可发育成熟, 并行使正常的生物学功能[27]。因此, 对于可转绿的叶色突变体而言, 一旦植株的发育状态或其生长的外界条件满足某种需求后, 植物体将依靠某种修复机制[28, 29]摆脱其叶绿体长期停滞在前质体或黄化质体阶段的发育状态, 逐渐回归至正常的叶绿体发育轨道。从这个意义上讲, 可以将转绿型突变体看成是叶绿体发育进程滞后的缓绿或迟绿型材料[30, 31]; 而通过对GRC2等转绿控制基因的克隆, 可以为阐明叶绿体发育的调控机制提供有力的遗传工具。
叶绿体的正常发育是编码叶绿体蛋白的细胞核基因与编码自身蛋白的叶绿体基因之间相互协调的结果, 细胞核和叶绿体基因组之间通过质核信号转导等途径相互影响, 共同调控叶绿体的发育和叶绿素的代谢。在已克隆到的白化转绿控制基因中, 大多数与质体基因复制、转录和翻译进程受到干扰或破坏有关, 如V3和St1分别编码核苷酸还原酶(RNR)的大、小亚基RNRL1和RNRS1, 当RNR活性不足时, 通过降低质体DNA的合成而优先保障核基因的复制[11]; V2编码一个定位于质体和线粒体上的新类型鸟苷酸激酶(pt/mtGK), 该基因抑制叶绿体分化早期质体遗传体系中质体转录本的翻译[16]; 而YSA则编码一个参与RNA转录后加工的PPR蛋白[9]。VYL、GRC1和YGL1是仅已克隆的3个黄化转绿控制基因, VYL基因编码一个叶绿体Clp蛋白酶亚基, VYL的表达影响光介导的叶绿体发育进程[19], 而GRC1[20]与YGL1[18]基因分别编码血红素氧合酶和叶绿素合成酶, 调控叶绿素的生物合成; 可见, 任何直接或间接参与叶绿体发育和叶绿素合成的相关基因的突变都有可能引发叶色变异。由于grc2是一个未曾报道的新基因, 其调控叶色变异的分子机制可能不同于以往叶色突变体; 本研究对于grc2的精细定位将为最终克隆该基因及揭示GRC2调控叶色的分子机制奠定基础。
鉴定了一个受隐性核基因控制的单叶独立转绿型黄化突变体grc2; 转绿前的grc2叶片总叶绿素和叶绿素b含量显著降低, 叶绿体发育停滞在黄化质体阶段, 转绿后叶绿体发育正常; 已将grc2精细定位至第6染色体短臂31 kb的区域内, 该区域含有5个未报道过的注释基因, 这些结果为该基因的最终克隆及生物学功能解析奠定基础。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|