第一作者联系方式: E-mail: sunxiying90@163.com
在我国小麦主产区均有禾谷孢囊线虫(CCN, Heterodera spp.)发生。限于有效抗源的严重匮乏, 抗CCN育种研究一直难以规模化开展。Madsen是一个抗孢囊线虫的美国冬小麦品种, 但抽穗偏晚使其很难在育种上迅速利用。本研究利用中国小麦品种烟农21和济麦19与Madsen杂交和回交, 从BC1F4代中选育出稳定品系H3714和H4058。田间病圃和温室接种鉴定结果表明, 这2个品系对河南省 H. avenae荥阳群体(致病型Ha43)和 H. filipjevi许昌群体(致病型Hfc-1)的抗性显著优于烟农21和济麦19。在接种条件下, 两个品系表现成株期白粉病抗性, H4058苗期还可抗不同白粉菌菌株。2个品系的抽穗期与烟农21和济麦19相似, 明显早于Madsen。利用偏凸山羊草2NS染色体特异分子标记VENTRIUP-LN2及该染色体上 Vrga1D基因特异分子标记Vlr2.6-3′-Vlr2.4-5′和VRGA-F11-VRGA-R5分析, 发现H3714和H4058含有偏凸山羊草2NS染色体片段, 且该染色体片段来自Madsen。根据Illumina iSelect 90K SNP分析结果, 两个品系的染色体构成存在差异。在检测到两个品系共有的4918个多态性SNP中, 2/3的SNP位点在2个姊妹系间表现相同, 另外1/3的SNP位点表现不同。本研究培育的抗禾谷孢囊线虫小麦新种质H3714和H4058可作为培育抗线虫小麦品种的抗源。
Cereal cyst nematode (CCN, Heteroderaspp.) has occurred in major wheat ( Triticum aestivum L.) producing regions in China. Developing wheat cultivars resistant to CCN is limited due to the shortage of effective sources of resistance. Madsen, a winter wheat cultivar released in the Pacific Northwest Region of the USA, is highly resistant to CCN populations from China. However, it is difficult to use this cultivar in breeding programs because of its late heading and maturity. In the present study, Chinese winter wheat cultivars Yannong 21 and Jimai 19 were crossed and backcrossed to Madsen, and lines H3714 and H4058 were developed from BC1F4 progenies. Tests under both natural infestation and artificial inoculation conditions indicated that resistance of H3714 and H4058 to the H. avenae Xingyang population (pathotype Ha43) and the H. filipjevi Xuchang population (pathotype Hfc-1) from Henan province was superior to that of Yannong 21 and Jimai 19. Results of the field test inoculated with a mixture of Bgt isolates demonstrated that both lines showed adult plant resistance to powdery mildew, and line H4058 was also resistant to different Bgt isolates at the seedling stage. The heading date of these lines was comparable to that of Yannong 21 and Jimai 19, and obviously earlier than that of Madsen. The fragments of chromosome 2NS from Aegilops ventricosa were detected in lines H3714 and H4058 using a pair of chromosome-specific primers VENTRIUP-LN2 and the molecular markers Vlr2.6-3′-Vlr2.4-5′ and VRGA-F11-VRGA-R5 that were specific for Vrga1D gene from Ae. ventricosa. Results of Illumina iSelect 90K SNP assay showed that the two lines differed in their chromosome constitutions. Two thirds of the polymorphic SNPs were identical and the remaining ones were different among 4918 polymorphic SNPs between the two sib lines. The newly developed wheat lines H3714 and H4058 can be used as sources of resistance in developing CCN-resistant wheat cultivars.
禾谷孢囊线虫(cereal cyst nematode, CCN)在我国16个省、市、自治区发生, 成为威胁我国冬小麦和春小麦生产的一个重要土传病原物[1, 2]。造成CCN快速扩展可能的原因, 一是我国冬小麦主产区小麦-玉米-小麦轮作或春麦区小麦连作的种植模式有利于病原线虫的生存; 二是当前绝大多数生产品种对线虫侵染敏感, 有利于线虫群体的繁殖; 三是规模化播种、田间管理和收获机械携带土壤, 可能造成病原线虫的远距离传播[3]。在我国, 禾谷孢囊线虫(Heterodera avenae Wollenweber, 1924)的发生比菲利普孢囊线虫[H. filipjevi (Madzhidov, 1981) Stelter, 1984]更加普遍, 后者只在河南、宁夏、青海等个别地点发生(彭德良, 私人通讯)。
CCN通过危害小麦根系而影响植株吸收土壤中的养分, 进而阻碍植株生长, 造成减产。当前, 绝大多数推广小麦品种均不抗CNN的侵染[4, 5, 6, 7], 只有太空6号、中育6号、华麦1号等个别品种表现一定程度的抗性[8, 9, 10]。尽管CCN的危害已经广为人知, 但是小麦抗线虫育种却很难开展起来, 主要原因是有效抗源十分匮乏。绝大多数已知抗CCN基因对我国的线虫致病型没有抗性。Cre1、Cre2、Cre3、Cre7和Cre8等抗线虫基因对河南H. filipjevi群体敏感, 只有CreR基因具有抗性[11]。近期通过对不同来源的小麦种质资源的抗CCN鉴定, 在国外引进的小麦种质、合成小麦、硬粒小麦和小麦-野生近缘种后代等材料中发现一些抗性资源[11, 12, 13, 14], 这些抗性资源需要经过改良, 使之适合当地的生态条件, 才能被有效地利用。
Madsen是美国太平洋西北地区推广多年的一个冬小麦品种[15]。我们经过多年的鉴定, 发现Madsen对我国的禾谷孢囊线虫具有良好的抗性[4]。虽然Madsen在美国生产上产量表现优异, 并且抗病性好, 但是由于中、美生态条件的差异, 该品种在我国黄淮冬麦区和北部冬麦区的抽穗期比当地栽培品种晚2周左右, 因此其优异的线虫抗性难以直接利用, 必须经过遗传改良, 才能在我国小麦抗CCN育种上发挥作用。
采用Madsen与我国推广小麦品种杂交、回交和连续自交的方法, 已经培育出一大批高代稳定的小麦种质。本研究的目的是通过田间病圃和温室接种抗性鉴定, 分析2个稳定种质H3714和H4058对CCN的抗性反应。CCN危害严重的小麦生产区, 特别是黄淮冬麦区, 往往是白粉病(病原菌为Blumeria graminis f. sp. tritici) 流行的地区, 本研究还采用人工接种方法鉴定H3714和H4058对白粉病的反应。由于Madsen是小麦-偏凸山羊草(Aegilops ventricosa) 2NS-2AS易位系[16], 采用2NS的特异分子标记分析H3714和H4058是否携带该易位染色体; 另外, 采用Illumina 90K iSelect SNP芯片技术[17], 分析和比较H3714和H4058的遗传构成。
Madsen的系谱是VPM1/‘ Moisson’ 951/2* ‘ Hill- 81’ [15]。烟农21 (系谱为烟1933/陕82-29)和济麦19 (系谱为鲁麦13/临汾5064)是通过国家品种审定委员会审定的冬小麦品种, 对CCN敏感[4]。利用Madsen与烟农21杂交, 再用济麦19回交1次, 然后自交4代, 从BC1F4代中选育出抽穗期与我国小麦推广品种相似的品系H3714和H4058。小麦品种温麦19和中作9504分别作为孢囊线虫和白粉病抗性鉴定的感病对照品种。VPM1的系谱是Ae. ventricosa/T. persicum//3* Marne, Ae. ventricosa#10是VPM1的偏凸山羊草亲本[18]。
1.2.1 田间病圃鉴定 2013— 2014年生长季, 分别在河南省荥阳市(H. avenae致病型Ha43)[19]和许昌市(H. filipjevi致病型Hfc-1)[20]小麦田设置病圃。按照随机区组设计排列小麦材料, 3行区, 行长1 m, 每行播种30粒, 3次重复。2013年10月中旬播种, 2014年5月中旬小麦灌浆期, 从每个小区调查10株根系上的孢囊数, 单株孢囊< 5个为抗病, 5~10个为中抗, 11~14个为中感, 15~25个为感病, > 25个为高感[21]。
1.2.2 温室接种鉴定 在河南省荥阳市试点收集病土, 在解剖镜下挑取孢囊, 将其轻轻压破, 令释放的虫卵悬浮于蒸馏水中, 在冰箱(4℃)内放置10周, 然后在15 ± 2℃培养箱黑暗条件下孵化30 d, 用蒸馏水调节二龄幼虫(J2)悬浮液至200条 mL-1, 用于接种不同基因型小麦。将干燥的土、沙在180℃下灭菌2 h, 按7︰3 (w/w)比例混匀, 装入PVC管(直径30 mm, 高130 mm), 每管装94.5 g混合土。小麦种子经2% NaClO消毒, 在恒温培养箱(25℃)中催芽2~3 d, 选取生长势相近的种子移入PVC管内, 每管种植1株, 将J2悬浮液滴加到PVC管中, 每株接虫600条。每个小麦材料设3次重复, 每个重复2株。接种的植株在15~20℃培养箱中(12 h光照/12 h黑暗)生长, 75 d后调查根系上形成的孢囊数目。实验进行2次。参照Nicol等[21]的方法进行抗性分级。
采用白粉菌菌株E09、E11、E20和E21进行苗期抗白粉病鉴定, 用中作9504幼苗保持和繁殖菌种。将小麦材料播种于50孔(5× 10)的育种盘中, 每孔(5 cm × 5 cm) 10粒。植株第1片叶完全展开时, 用扫拂法接种, 保湿24 h, 然后在18~20℃条件下生长。当感病对照品种中作9504充分发病时, 采用0~4级标准调查第1叶片的反应型, 0~2为抗病反应型, 3~4为感病反应型[22]。
2013— 2014年生长季, 在中国农业科学院作物科学研究所北京昌平试验站进行白粉病成株期抗性鉴定[22], 中作9504作为感病对照和接种行。2014年3月小麦返青时接种混合菌株, 菌株毒力型为V1、V3a、V3b、V3c、V3d、V3e、V3f、V4a、V4b、V5、V6、V7、V8、V17、V19、V25和V35 (周益林, 私人通讯)。2014年5月下旬小麦乳熟期, 采用0~9级标准调查病害严重度, 抗病反应型分为免疫(0级)、高抗(1~2级)、中抗(3~4级)、中感(5~6级)和高感(7~9级), 同时记录植株倒2叶最大病害严重度。
根据大麦cDNA MWG682序列设计的分子标记VENTRIUP-LN2 (VENTRIUP: 5′ -AGGGGCTACTGA CCAAGGCT-3′ ; LN2: 5′ -TGCAGCTACAGCAGTAT GTACACAAAA-3′ ), 可特异扩增Xcmwg682基因座偏凸山羊草2NS染色体特异等位基因, 片段大小为262 bp [16]。Vrga1D基因是从VPM1的供体偏凸山羊草克隆的一个NBS-LRR抗病基因[23]。Vlr2.6-3′ - Vlr2.4-5′ 标记(Vlr2.6-3′ : 5′ -TCTGTATTCTCCTTGG GTAC-3′ ; Vlr2.4-5′ : 5′ -TTTTCACCTGCTTGCAGCA C-3′ )扩增Vrga1D基因LRR和3′ 非转录区的886 bp片段[24]。VRGA-F11-VRGA-R5 (VRGA-F11: 5′ -AAT CCAAAGGTCAGCAATCC-3′ ; VRGA-R5: 5′ -GGA ATCCAGGTCCTTGAGGAAC-3′ )是扩增Vrga1基因285 bp片段的引物[25]。这2个Vrga1D基因的特异分子标记可以检测2NS染色体片段。PCR体系为25 μ L, 包括50 ng模板DNA, 0.2 μ mol L-1引物, 150 μ mol L-1 dNTPs, 10× 缓冲液和1 U Taq酶。参照Helguera等[16]、Seah等[24]和Fang等[25]的报道进行DNA扩增, 用2%琼脂糖凝胶电泳(Vlr2.6-3′ -Vlr2.4-5′ 和VENTRIUP-LN2)或8%聚丙烯酰胺凝胶电泳(VRGA- F11-VRGA- R5)检测PCR扩增产物。
利用Illumina 90K iSelect SNP芯片分析技术, 对H3714和H4058及其亲本进行全基因组扫描, 通过Clustering Module version 1.0进行SNP分型[17]。根据H3714和H4058与其亲本的SNP类型, 将SNP分型数据分别记为A (Madsen)、B (烟农21+济麦19)和C (H3714和H4058特有)。参照Wang等[17]构建的SNP图谱确定SNP在染色体上的位置, 采用GGT2.0 [26]分析H3714和H4058染色体的遗传构成, 绘制2个材料的遗传图谱。
对单株孢囊数进行方差分析时, 首先进行lg (x+1)转换[27]。采用Fisher’ s LSD法确定品种之间的差异显著性(P< 0.05)。采用SAS统计软件(Version 8, SAS Institute)进行统计分析。
在河南省荥阳市的田间病圃H. avenae抗性鉴定中, 供试小麦材料之间的平均单株孢囊数差异显著(P< 0.05)。H3714和H4058的单株孢囊数分别为8.4个和4.4个, 表现中抗和抗病反应型, 与Madsen (3.0个)差异不显著, 但显著低于亲本烟农21 (33.8个)和济麦19 (25.0个), 以及感病对照温麦19 (90.0个) (P < 0.05)。
同样, 在河南省许昌市的田间病圃H. filipjevi抗性鉴定中, H3714和H4058表现中抗反应型, 单株孢囊数分别为6.7个和7.0个, 与Madsen (1.2个)差异不显著, 但与济麦19、烟农21和温麦19有显著差异(P < 0.05) (图1)。在接种H. avenae的条件下, H3714和H4058的单株孢囊数分别为5.8个和9.2个, 均显著低于对照品种温麦19 (18.6个) (P< 0.05)。
供试材料对E09、E11、E20和E21菌株的苗期接种鉴定结果表明, H3714对4个菌株的反应型均为3级, 表现感病反应型。H4058对这些菌株的反应型分别为0级或1级, 表现抗病反应型(表1)。Madsen表现感病, 反应型为3级或4级, 与感病对照中作9504相同。
2014年5月下旬, 在田间接种条件下, H3714和H4058植株的反应型分别为4和0, 表现中抗和免疫反应型, 2个品系的最大严重度均为0。Madsen的反应型为8, 最大严重度为85%。作为接种行的中作9504发病充分, 反应型为8, 最大严重度为100%。
| 表1 H3714、H4058和Madsen苗期和成株期对白粉病的反应 Table 1 Reactions of H3714, H4058, and Madsen to Blumeria graminis f. sp. tritici (Bgt) isolates at the seedling and adult plant stages |
利用偏凸山羊草2NS染色体特异分子标记VENTRIUP-LN2在VPM1和Madsen上的扩增片段(262 bp)与偏凸山羊草一致; H3714和H4058也观察到相同的扩增片段, 普通小麦品种烟农21、济麦19和温麦19没有扩增产物(图2-A)。
偏凸山羊草Vrga1D基因的特异分子标记Vlr2.6-3′ -Vlr2.4-5′ 在偏凸山羊草、VPM1和Madsen中扩增出886 bp特异片段, H3714和H4058扩增出相同的片段, 而烟农21、济麦19和温麦19没有扩增产物(图2-B)。Vrga1D基因另一个分子标记VRGA-F11-VRGA-R5的特异扩增片段为285 bp, 偏凸山羊草、VPM1、Madsen、H3714和H4058均可见该片段, 而烟农21、济麦19和温麦19的扩增片段较小(图2-C)。VPM1、Madsen、H3714和H4058还扩增出一个比285 bp片段略小的片段, 这个片段在偏凸山羊草、烟农21、济麦19和温麦19中都没有出现, 可能是VPM1的一个特异片段。这些结果表明H3714和H4058具有来自Madsen亲本的2NS染色体片段。
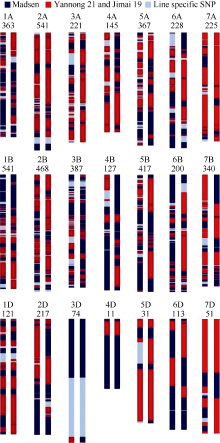
在81 587个SNP位点中, 检测到有效SNP位点70 195个。其中H3714和H4058具有明确染色体位置的多态性SNP位点分别有11 216和13 369个。H3714每条染色体上多态性位点为33~1106个, 其中4D上最少, 2B和5B上最多; H4058每条染色体上多态性位点为41~1385个, 以4D上最少, 5B上最多。从同源群来看, H3714和H4058在第2和第1部分同源群多态性SNP最多, 分别占18.7%和18.3%, 而第4部分同源群多态性SNP最少, 分别为7.3%和7.5% (图3-A)。A、B、D基因组中, B基因组多态性最高, H3714和H4058的多态性位点分别占50.5%和51.2%; 其次为A基因组, 多态性位点分别占38.0%和37.7%; D基因组的多态性位点最少, 2个品系分别占11.5%和11.1% (图3-B)。
H3714和H4058中检测到有确切染色体位置的多态性SNP位点分别为6201和7081个, 其中与烟农21和济麦19一致的SNP位点数目(2783个和3672个)比与Madsen (2510个和3222个)一致的SNP位点多, 2个品系中均有一些独有的SNP位点(908个和187个)。
图4是根据H3714和H4058各染色体多态性SNP位点绘制的遗传构成比较的示意图。在多态性SNP位点中, H3714和H4058共有的位点有4918个。两个品系相同的SNP位点有3268个(66.4%), 不同的位点有1650个(33.6%)。无论是相同的位点还是不同的位点, B基因组的SNP数目(分别为1615个和865个)均多于A基因组SNP的数目(分别为1153个和667个), 而D基因组的SNP数目最少(分别为500个和118个)。从不同类型的SNP来看, 两个品系2A、3A、6A、7A、2B、5B、7B、5D和7D染色体与Madsen一致的SNP频率较高, 1A、1B、4A、2D和6D染色体与烟农21和济麦19一致的SNP频率较高。
虽然H3714和H4058来自同一个杂交组合, 但是其遗传构成有较大差异(图4)。表现差异的SNP位点以不同频率分布在除4D染色体之外的其他20条染色体上, 其中5A、2B和3B染色体上差异SNP的频率较高。5D、6D、7D染色体较少, 4D染色体上的位点只有11个, 没有不同的位点。另外, 2个品系2A和7B等染色体比较相似。而D基因组染色体的遗传构成相似可能是由于这些染色体上的多态性SNP数目较少的原因。
当前, 有效抗源的匮乏是限制小麦抗孢囊线虫育种的主要因素。一些抗线虫的国外品种和小麦野生近缘种需要经过遗传改良才能在育种上利用。因此, 创制抗CCN新种质是当前培育抗线虫品种的前提和首要任务。本研究通过田间病圃和温室接种鉴定的方法, 从美国小麦品种Madsen与我国小麦品种烟农21和济麦19杂种后代中发现抗CCN的小麦种质H3714和H4058, 这2个新品系对河南省H. avenae和H. filipjevi群体的抗性显著优于其亲本烟农21和济麦19。
虽然在多年的田间病圃和接种鉴定中美国小麦品种Madsen表现很强的线虫抗性, 但是抽穗期晚所造成的花期不遇是限制其利用的主要因素。采用杂交和回交策略选出的H3714和H4058在保持线虫抗性的同时, 生育期比Madsen大大提前。根据2014年在北京昌平试验田的观察, 2个品系的抽穗期分别为4月30日和4月28日, 与烟农21和济麦19接近, 而Madsen的抽穗期为5月15日(数据未发表)。H3714和H4058抽穗期的改良, 便于其在杂交育种上作为亲本与其他小麦品种或种质资源组配杂交组合, 进而培育抗CCN小麦品种。
我国禾谷孢囊线虫发生的区域大多也是白粉病危害的地区。利用寄主抗性是同时控制地下和地上病原生物的首选措施。抗病育种既要针对危害地下根系的土传病害, 又要兼顾侵染地上部组织的真菌病害(例如白粉病)。Madsen具有良好的线虫抗性, 但却不抗白粉病。H3714和H4058兼具线虫和白粉病抗性, 特别是H4058不但表现成株期抗病, 而且苗期也抗不同来源的白粉菌菌株。虽然VPM1携带抗白粉病基因Pm4b[28], 但是由于Madsen不抗白粉病, 因此, H3714和H4058的成株期或苗期白粉病抗性不可能来自Madsen, 而是与其他亲本有关, 这需要对其系谱中涉及的亲本进行抗性鉴定才能确定其白粉病抗性究竟从哪个亲本遗传而来。
 | 图3 多态性SNP位点在H3714和H4058部分同源群(A)和基因组(B)上的分布Fig. 3 Distributions of polymorphic SNPs on different homoeologous groups (A) and genomes (B) in lines H3714 and H4058 |
Madsen的亲本VPM1携带一个2NS/2AS易位染色体, 这个易位染色体携带Cre5基因, 可以抗法国H. avenae致病型Ha12[29]。根据分子标记分析结果, Helguera等[16]证明Madsen也含有这个易位染色体。利用2NS染色体片段的3个特异分子标记VENTRIUP-LN2、Vlr2.6-3′ -Vlr2.4-5′ 和VRGA-F11- VRGA-R5在H3714和H4058中扩增出与Madsen、VPM1和偏凸山羊草相同的片段, 表明这些材料中可能携带2NS染色体片段。根据系谱分析, H3714、H4058和Madsen对我国禾谷孢囊线虫致病型的抗性也可能与这个基因有关。这个偏凸山羊草易位染色体片段还携带Yr17、Lr37和Sr38抗条锈病、叶锈病和秆锈病基因簇[24, 28, 30]。H3714和H4058也可能具有Yr17-Lr37-Sr38抗锈病基因簇。Madsen还具有抗眼斑病基因Pch1[15]和小麦黄花叶病基因YmMD[31]。Williamson等[32]报道, VPM1还具有抗根结线虫(Meloidogyne spp.)基因Rkn3。H3714和H4058是否具有更多病害的抗性基因还需要通过精准抗性鉴定和分子定位来确定。
根据RFLP标记分析的结果, VPM1和Madsen的2NS染色体片段估计为25~38 cM [16]。虽然这个易位到小麦2A染色体上的偏凸山羊草染色体片段较大, 但除了携带有益的抗病基因之外, 可能没有严重的连锁累赘。研究证明VPM1的2NS染色体片段对小麦的产量和品质没有不利影响[33, 34]。在世界各地VPM1已经被广泛用于小麦品种改良[35, 36, 37]。利用VPM1培育的小麦品种Madsen自1989年推广以来[15], 已经在美国华盛顿州种植了20多年。VPM1在我国小麦育种上也多有利用[38]。由于小麦部分同源染色体配对抑制基因Ph的存在, 通常偏凸山羊草的2NS染色体与小麦2AS染色体不能配对和交换。但是, Helguera等[16]和Robert等[39]发现2NS染色体与小麦2AS染色体可能重组, 只是发生频率很低。要想高效率地缩短2NS染色体片段, 需要采用ph1突变体促进部分同源配对, 提高部分同源染色体的重组频率。
通常利用分子标记分析品种的亲缘关系主要采用PCR为基础的SSR等类型的分子标记。单核苷酸多态性(SNP)可以真实地解析小麦品种之间的亲缘关系[40]。最近, Cavanagh等[41]开发了基于Illumina技术平台的9K SNP分析芯片, Wang等[17]又进一步开发了90K SNP芯片, 为分析小麦品种的亲缘关系提供了一种高通量方法。本研究采用90K SNP芯片方法分析和比较了抗病种质H3714和H4058的染色体构成, 发现2个姊妹系在绝大多数染色体上都存在一定的差异。不过, 根据这些SNP分析结果尚不足以确定哪些染色体片段与H3714和H4058的抗性有关。利用分离群体和分子标记定位可以最终解析2个材料与抗性相关的染色体区段。
选出的2个BC1F4代品系H3714和H4058对H. avenae (致病型Ha43)和H. filipjevi (致病型Hfc-1)的抗性与Madsen相似, 但抽穗期比后者提早2周, 与烟农21和济麦19相近。这两个品系还表现成株期或苗期白粉病抗性。H3714和H4058与Madsen均含有偏凸山羊草2NS染色体片段。2个姊妹系的遗传构成在共有的4918个多态性SNP位点中, 2/3的SNP位点相同, 另外2/3的SNP位点上表现不同。本研究培育的抗禾谷孢囊线虫新种质H3714和H4058为小麦抗线虫育种提供了新的有效抗源。
致谢: 感谢中国农业科学院植物保护研究所周益林研究员提供白粉菌菌株。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|