第一作者联系方式: 李新, E-mail: 1052719375@qq.com, Tel: 15597178856; 肖麓, E-mail: xlu2005@aliyun.com
大黄油菜是源于青海湟源的地方品种, 种皮颜色鲜黄, 其大黄油菜的黄籽性状受1对隐性基因( Brsc1)控制, 该基因被定位于白菜A9染色体上一段1.7 Mb的区间内。为了更好地利用这一黄籽资源, 对 Brsc1基因进一步精细定位。利用青海大黄油菜和褐籽白菜型油菜09A-126构建BC4及F2分离群体。利用白菜同源区段内已公布的SSR标记, 同时利用该区段序列信息开发新的SSR引物, 共获得6个与目标基因紧密连锁的标记(BrID10711、BrA5~BrA9), 其中BrA5与目标基因共分离, BrA9为一侧最近标记, 它与目标基因之间的遗传图距为0.69 cM。至此, Brsc1基因进一步被限定于标记Y06和BrA9之间约1.2 Mb的区间内。利用本研究中获得的标记检测F2群体中3种类型单株, 鉴定出一个共显性标记BrA8。将本研究中获得的SSR标记与前人研究结果进行整合, 加密了 Brsc1基因所在区间的标记密度。同时, 特异片段与拟南芥基因组进行序列比对的结果表明, 共有5个标记与拟南芥的第1染色体有较好的共线性关系, 暗示 Brsc1基因的同源基因可能位于拟南芥的第1染色体上。本研究中获得的标记将为 Brsc1基因的克隆及利用 Brsc1基因进行黄籽油菜的分子辅助育种提供有利条件。
Dahuang rape, a landrace originated from Qinghai Huangyuan, has bright yellow seed coat. Previous studies indicated that the yellow-seeded trait in Dahuang was controlled by a recessive gene ( Brsc1), which was located in a 1.7 Mb interval on chromosome A9 of Brassica rapa ( B. rapa). In order to better use the yellow-seeded resource, we further fine mapped the Brsc1 gene. BC4 and F2 populations, constructed from the cross of Dahuang and 09A-126 (brown-seeded, B. rapa), were used for fine mapping. New PCR markers were developed based on the information of the homologous region in B. rapa and the published SSR markers were used in polymorphism survey. A total of six markers (BrID10711, BrA5 to BrA9) tightly linked to the target gene were obtained, wherein BrA5 co-segregated with Brsc1, and BrA9 was 0.69 cM away from the Brsc1 gene. So Brsc1 was further limited in a 1.2 Mb interval, approximately. The markers identified in this study were used to detect three types of individual plants in F2 population. BrA8 was identified as a co-dominant marker. Marker density of the region encompassing the Brsc1gene was increased by integrating the markers from previous researches and this study. Sequence alignment with the genome of Arabidopsis thaliana was performed and a good homologous linear relationship between five markers and chromosome 1 of Arabidopsis thaliana was detected, which implied that homologous gene of the Brsc1 gene maybe located in the chromosome 1 of Arabidopsis thaliana. Markers obtained from this study would provide favorable conditions for map-based cloning of the Brsc1and molecular marker-assisted selection (MAS) breeding of the yellow-seeded rape .
油菜是我国主要的油料作物, 也是我国食用植物油的主要来源。油菜种皮颜色不仅是一个形态指示性状, 还与种子休眠和品质有关。油菜种皮颜色有黄色、褐色、黑色等, 研究表明, 在相同遗传背景下, 黄籽油菜与黑、褐籽等油菜相比, 具有种皮薄, 皮壳率低, 蛋白质和含油量高, 色素含量少等优点[1, 2]。白菜型油菜、芥菜型油菜中有大量的黄籽资源[3, 4], 而甘蓝型油菜中不存在天然的黄籽资源。白菜型油菜作为栽培油菜基本种, 遗传资源丰富, 且分布广泛, 蕴含的黄籽资源, 是创建甘蓝型油菜黄籽种质的重要物种之一[5, 6, 7, 8]。
白菜型油菜作为油菜基本种之一, 相对于四倍体的甘蓝型黄籽油菜, 遗传模式简单[9], 但由于不同种质的黄籽材料遗传特点各异, 黄籽基因来源不同, 导致其黄籽性状遗传相对复杂。Mohammad等[10]通过对白菜型油菜黄籽遗传模式的研究表明, 白菜型油菜籽粒颜色遗传受3对基因控制, 这3对基因等效异位, 相互独立。Rahman等[11]对黄籽沙逊遗传模式的研究表明, 黄籽性状受2对隐性基因控制。在Schwetka[12]和李正强[13]的研究中发现, 白菜型油菜种皮颜色性状受多对基因控制。
分子标记的诞生, 使得研究者可以通过筛选分子标记, 对种皮色泽相关的基因进行定位。Chen等[14]在白菜-芥蓝(B. campestris-B. alboglabra)的C染色体组异附加系中定位出一个与黄籽基因紧密连锁的RAPD标记。Rahman等[11]在白菜型油菜中筛选出1个与黄籽性状主效基因(Br1/br1)紧密连锁的SRAP标记。Kebede等[15]利用白菜型油菜重组自交系群体, 对白菜型黄籽沙逊油菜种皮颜色基因进行QTL分析, 在A9连锁群检测到2个与籽粒颜色相关的QTL位点。Xiao等[16]利用回交群体, 对白菜型油菜青海大黄种皮色泽基因Brsc1进行定位, 最终将该目标基因锁定在白菜的A9连锁群上。芸薹属作物与拟南芥亲缘关系很近, 编码区序列高度保守, 因此可以利用拟南芥中的同源基因对白菜型油菜基因进行定位及克隆。Zhang等[17]利用图位克隆技术从黄籽白菜中获得TTG1的同源基因, 发现该同源基因和拟南芥的TTG1基因序列高度同源且功能相同。Li等[9]通过图位克隆技术从白菜型油菜中分离得到一个种皮色泽相关基因BrTT8, 该基因是拟南芥TT8基因的同源基因。
青海大黄油菜, 具有种皮颜色鲜黄、遗传稳定等特点[18, 19], 是研究油菜黄籽性状的良好材料。Xiao等[16]对控制青海大黄油菜黄籽性状的Brsc1基因进行定位, 构建了目标基因区间的遗传连锁图谱。赵会彦等[20]利用AFLP、SSR和SCAR标记对Brsc1基因进行精细定位, 将Brsc1基因所在的区域缩小至参考基因组上约1.7 Mb的区间内, 同时构建了遗传连锁图谱和物理图谱, 然而目标基因所在区段仍比较大, 无法选定可靠的候选基因。本研究采用大黄油菜和1个褐籽白菜型油菜构建的BC4分离群体, 利用BRAD数据库中已公布的PCR标记, 同时利用目标区间序列信息开发新的SSR标记, 对Brsc1基因进一步精细定位。将开发获得的新标记与前人的标记整合, 构建目标基因所在区域的遗传连锁图谱, 为Brsc1基因的图位克隆奠定基础, 同时为白菜型黄籽油菜及甘蓝型黄籽油菜的辅助选育提供有利条件。
供试材料来自青海省农林科学院春油菜研究所, 黄籽亲本为青海大黄油菜, 褐籽亲本为09A-126。两亲本均已连续自交7代以上, 其种皮颜色性状均可稳定遗传。
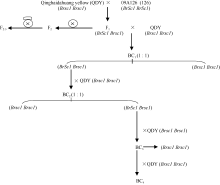
以大黄油菜(QDY, 黄色种子)为轮回亲本、09A- 126 (126, 褐色种子)为供体非轮回亲本的连续回交方法构建定位群体[21]。在BC1、BC2和BC3世代中均保留褐籽单株上收获的种子播种, 用于下一轮的回交。在BC4分离群体中, 共获得1739个单株, 该群体用于重组单株的筛选和Brsc1基因的精细定位。
在F1中随机选择1个单株套袋自交, 获得F2分离群体。从F2群体中随机选取25个单株提取DNA, 用于共显性标记的分析, 同时将F2群体中的这25个单株分别套袋自交, 于成熟期考察每个F2单株上收获的种子种皮颜色。结果表明, 在这25个单株中, 20株表现为褐籽, 5株表现为黄籽。将每个F2单株上收获的自交种子播2行, 获得F2:3家系, 成熟期考察每个F2:3株系的每个单株种皮颜色。结果表明, 在20个褐籽F2单株的自交后代中, 5个F2:3株系中的每个单株均表现为褐籽, 即种皮颜色性状不发生分离, 因此推测出获得这5个F2:3株系的上一代F2单株是纯合型褐籽(BrSc1BrSc1)单株; 在20个褐籽F2单株的自交后代中, 15个F2:3株系中褐籽与黄籽株的分离比表现为3∶ 1, 因此可以推断这些F2:3株系的上一代F2单株是杂合型褐籽(BrSc1Brsc1)单株。5个黄籽F2单株自交获得的F2:3株系中的每个单株均表现为黄籽, 基因型为Brsc1Brsc1。
角果成熟后, 将BC4群体、F2群体及F2:3家系中所有单株分别脱粒, 通过目测法考察鉴定各单株的种皮颜色。根据种皮颜色, 将BC4群体所有单株区分成黄籽和褐籽两组。根据F2群体中各单株种皮颜色性状的鉴定结果, 同时结合F2:3家系中粒色性状的分离与否, 将F2群体单株分为黄籽、纯合型褐籽(不分离)和杂合型褐籽单株(分离) 3组。
BC4群体和F2群体油菜植株长至4~5片真叶时, 取1 cm2大小幼嫩叶片, 采用CTAB法提取DNA, 根据籽粒颜色的区分分类放置提取的DNA, 用紫外分光光度计测定DNA浓度, -20℃保存, 取原液稀释到50 ng μ L-1作模板备用[22, 23]。
PCR均在Bio-Rad T100上扩增, 反应总体积10 μ L, SSR反应程序为94℃预变性4 min; 94℃变性45 s, (Tm 5℃)退火30 s, 72℃延伸45 s; 循环30次, 最后72℃延伸5 min。用6%聚丙烯酰胺凝胶电泳法分析PCR条带[24], 参考梁宏伟等[25]的方法银染及显影。
结合Xiao等[16]对目标基因的定位结果, 参考赵会彦等[20]报道的SSR、AFLP、SCAR引物序列, 在白菜BRAD数据库, 参考目标基因区段公布的SSR标记, 利用SSR Finder快速寻找SSR位点, 用Primer5软件设计SSR引物, 针对该区段开发新的SSR分子标记。
利用获得的SSR标记对这25个F2单株进行基因型检测, 能够区分黄籽、杂合型褐籽和纯合型褐籽单株的标记, 即认为是与Brsc1基因连锁的共显性标记。
从BRAD数据库中白菜型油菜A9染色体上目标基因所在区段下载得到已公布的SSR标记, 并在该区段每隔一段距离设计开发一个新的SSR引物。在基因池中进行SSR引物多态性检测, 在已分组的黄籽和褐籽群体中各随机挑选若干单株, 等量混合, 构建出黄籽和褐籽两组基因池, 进行多态性检测, 表现多态性的SSR引物继续在BC4分离群体的单株中被验证。结果发现, 已公布的SSR标记BrID10711与新开发的BrA5-BrA9 5个SSR标记均与目标基因紧密连锁, 其中标记BrA5与目标基因共分离。图2所示为标记BrA6在BC4群体48个单株中的扩增结果。利用F2群体3种类型的单株(黄籽、杂合型褐籽和纯合型褐籽)对6个特异性SSR标记检测L标记, 其扩增结果如图3所示。6个特异性SSR标记的引物序列及在染色体上的位置详见表1。
对6个SSR特异片段分别回收、克隆和测序, 将序列信息提交BRAD数据库比对表明, 4个特异片段与白菜型油菜A9染色体序列高度同源(表1), 因此进一步确定A9连锁群具有控制油菜种皮颜色的基因位点。将6个特异片段的序列信息同时提交TAIR网站比对表明, 标记BrA6与拟南芥第1染色体上部分序列高度同源(表1)。
以BC4群体基因型数据构建分子标记连锁图。6个特异性标记进入A9连锁群, 图谱包括5个AFLP标记, 10个SSR标记。
BC4定位群体共包含1739个单株, 在BC4群体中随机挑选48个黄籽单株和48个褐籽单株对6个特异性标记进行初步检测。选用位于Brsc1基因两侧较远、扩增条带清晰且重现性好的B089L03-3和Y14标记对BC4群体所有单株进行检测, 筛选出交换单株。在1739个单株的群体中, Y14找到48个交换单株, B089L03-3找到54个交换单株, 2个标记找到的交换单株完全不同。利用B089L03-3和Y14之间6个特异性标记(BrID10711、BrA5、BrA6、BrA7、BrA8和BrA9)、4个AFLP标记(Y05、Y06、Y07和Y10)[16], 3个特异性标记(KS10760、BrA1和BrA2) [20]对筛选到的交换单株进行检测, 确定这些标记的交换单株。
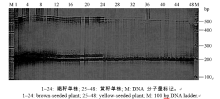 | 图2 引物BrA6在BC4群体单株中的扩增检测结果Fig. 2 Amplification results of primer BrA6 in individual plants of BC4 population |
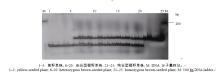 | 图3 引物BrA8在F2群体单株中的扩增检测结果Fig. 3 Amplification results of primer BrA8 in individual plants of F2population |
| 表1 与Brsc1基因紧密连锁的SSR标记 Table 1 SSR markers tightly linked to the Brsc1 gene |
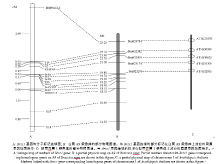
前人获得的7个标记和本研究所得6个标记在BC4群体中具有明显多态性, 获得这些标记的交换单株, 确定重组率, 计算遗传距离, 构建Brsc1基因与分子标记的遗传连锁图谱。结果所有的标记分布在一个跨度为7.4 cM的连锁群上, 标记BrID10711、BrA9位于基因的一侧, BrA5为一共分离标记, BrA6、BrA7和BrA8标记位于基因的另一侧; Brsc1被定位在BrA9和Y06之间, 两标记与Brsc1间的遗传距离分别为0.69 cM和0.11 cM (图4-A)。结合赵会彦等定位结果, 整合绘制Brsc1基因与分子标记的物理图谱(图4-B)表明, 各标记在连锁图中的分布与其在染色体上的物理位置基本一致, 据此将Brsc1基因锁定于Y06 (19.3 Mb)和BrA9 (18.1 Mb)标记之间1.2 Mb的区间内, 线性比对表明, 该区段各特异性标记没有对应的拟南芥同源基因(图4-C)。
Xiao等[16]利用包含456个单株的BC1群体将Brsc1定位在A9连锁群的Y06与Y10标记之间, 区间大小为2.8 Mb; 赵会彦等[20]构建了包含1739个单株的BC4群体, 采用不同的AFLP引物组合和开发新的SSR引物, 将目标基因锁定于A9染色体上Y06 (19.3 Mb)和A4 (17.6 Mb)标记之间1.7 Mb的区间内, 本研究继续跟进以上研究进展, 开发和收集SSR引物, 筛选出6个与目标基因连锁的SSR标记, 将目标基因区段缩短至1.2 Mb, 且各标记间的遗传距离相近, 将Brsc1基因附近标记进一步加密。
本研究所得6个SSR标记除共分离标记外分布于Brsc1两侧, 由整合后的遗传连锁图谱可以看出, Brsc1两侧的连锁标记数目分布均匀; 整合绘制Brsc1基因与分子标记的物理图谱后发现, 分布在遗传连锁图中的BrA8标记在物理图谱上没有相对应的位置, 这与BrA8标记在BRAD数据库序列比对后与白菜型油菜没有同源序列有关。继前人获得与目标基因共分离的标记Y05、Y12后, 本研究筛选到一个与目标基因共分离的BrA5 (19.2 Mb)标记, 该标记位于Y06 (19.3 Mb)和A4 (17.6 Mb)标记之间, 且距离共分离标记Y05 (18.9 Mb)较近, 这为黄籽油菜分子标记辅助选择育种提供更多可能。此外, 本研究筛选到一个共显性SSR标记BrA8, 为黄籽油菜分子标记辅助选择育种体系的建立创造了有利条件。
白菜型油菜黄籽性状遗传模式复杂多样, 但从Li等[9]和Kebede等[15]对白菜型油菜黄籽性状定位分析的研究结果中发现, 不同试验材料或不同群体构建的遗传连锁图中, 在A9连锁群上可以定位到与种皮色泽相关的基因位点, 这与本研究及Xiao等[16]将大黄油菜黄籽基因Brsc1定位至白菜型油菜A9染色体上的结果相似。Kebede等[15]利用白菜型油菜重组自交系群体, 对黄籽沙逊油菜的黄籽性状进行QTL分析, 在A9连锁群检测到2个与籽粒颜色相关的QTL, 分别为主效QTL SCA9-2和微效QTL SCA9-1, 与本研究相比, 主效QTL SCA9-2包含的CB10022标记与本研究定位的Brsc1基因连锁且SCA9-2位点在18.9 Mb左右的基因组内, 且与定位Brsc1基因区段内获得的共分离BrA5 (19.2 Mb)标记相近, 说明两者可能为同一位点。Li等[9]同样对黄籽沙逊油菜的黄籽性状进行了基因定位研究, 将黄籽基因定位于白菜型油菜A9染色体11.4 Mb处, 与本研究定位区间(18.1~19.3 Mb)相距较远, 与Kebede等[15]QTL分析研究的2个QTL (SCA9-2、SCA9-1)在A9染色体上的位置也均不同, 进一步说明, 在相同或不同的种质里白菜型油菜黄籽性状遗传模式复杂多样且控制黄籽性状基因位点可能不一样。Li等[9]依据拟南芥TT基因设计白菜型油菜同源IP引物, 获得与白菜型油菜种皮色泽基因共分离的T8-2标记, 通过拟南芥基因组的同源序列比对, T8-2标记与拟南芥4号染色体序列同源, 本研究获得的共分离标记BrA5 (19.2 Mb)没有对应的拟南芥同源基因, BrA6 (19.8 Mb)标记与拟南芥3号染色体序列同源, 不难发现, 本研究定位的Brsc1基因与Li等[9]图位克隆的BrTT8基因可能是A09染色体上2个不同位点的基因。
关于黄籽性状的研究, 目前多集中于黄籽基因的定位层面, 通过图位克隆方法获得相关黄籽基因的研究报道较为少见。目前通过同源序列法获得的黄籽基因都是些类黄酮合成相关的基因。在甘蓝型油菜中, 路小春[29]根据拟南芥TT1基因保守序列, 在甘蓝型油菜近等系中获得差异并完成BnTT1基因的图位克隆。Wei等[30]利用拟南芥TT2基因同源序列, 在甘蓝型油菜中分离出BnTT2基因家簇。Fu等[31]利用2个重组自交系群体, 获得主效QTL与拟南芥线性比对, 锁定TT10为该主效QTL的重要候选基因。Chai等[32]从二倍体亲本白菜型油菜(B. rapa)和甘蓝(B. oleracea)中分别克隆得到一个TT12同源基因。在白菜型油菜中, 李运涛等[33]根据拟南芥DFR基因保守序列, 图位克隆出DFR (TT3)同源基因。Zhang等[17]利用图位克隆技术从黄籽白菜中获得TTG1同源基因。Li等[9]通过图位克隆技术分离得到一个白菜型油菜种皮色泽相关基因BrTT8。本研究将Brsc1定位在A9染色体1.2 Mb的基因组区域内, 但该染色体区段仍比较大, 与目标基因连锁的标记几乎没有对应的拟南芥同源基因和白菜型油菜同源基因, BrA5 (19.2 Mb)是该区间内筛选到的一个与目标基因共分离的标记, 与侧翼标记Y06 (19.3 Mb)距离相近, BrA5标记69%序列集中A3染色体上, 所对应的白菜型油菜同源基因Bra023961也位于A3染色体上, 与目标基因定位到的A9染色体不一致, Bra023961基因不能为目标基因的定位提供有利的信息。与本研究相比, 甘蓝型油菜中克隆到的拟南芥同源基因TT10、TT12, 白菜型油菜中克隆到的拟南芥同源基因DFR (TT3)、TT8, BrTT8, 这些粒色性状相关的基因都不在本研究定位的Brsc1基因区间(18.1~19.3 Mb)内, 可能控制黄籽性状的基因在不同的研究材料中是不同的, 因此本研究还需扩大作图群体, 在该区段进行标记加密, 将目标基因定位在更小的基因组区域内, 最终选择可靠的候选基因, 实现Brsc1的图位克隆。
筛选到与大黄油菜黄籽基因Brsc1紧密连锁的6个SSR标记(BrID10711、BrA5-BrA9), 其中有1个共显性标记BrA8。将前人获得的标记与本研究获得的标记整合, 对目标基因进一步定位, 得到1个共分离标记BrA5, 并将目标基因锁定于白菜型油菜A9染色体上Y06和BrA9标记之间1.2 Mb的区间内。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|