第一作者联系方式: E-mail:2012101146@njau.edu.cn; Tel: 025-84399061
γ-氨基丁酸(GABA)是一种四碳非蛋白质氨基酸, 具有降血压等功能。为提高稻米中GABA含量, 利用RNA干扰技术, 构建水稻中GABA代谢关键酶GABA转氨酶1基因( OsGABA-T1)的干扰载体, 通过农杆菌介导法, 将其转化至粳稻品种宁粳1号中。实时荧光定量PCR检测结果表明导入的RNA干扰结构成功地降低了目的基因 OsGABA-T1的表达, 且干扰家系中 OsGABA-T2基因表达也随之下降。对转基因T3代稻米GABA含量测定发现, 糙米中GABA含量相对于对照增加了13倍以上, 精米中GABA含量也显著增加, 而其他主要氨基酸含量则没有明显变化。测定储藏4个月的转基因稻米发现, GABA含量仍具有较高水平。所以, 利用RNA干扰技术可有效提高稻米γ-氨基丁酸(GABA)含量, 为培育富含GABA的降血压功能性水稻品种提供基础。
γ-Aminobutyric acid (GABA) is a four-carbon non-protein amino acid and has been identified to have a function in reducing blood pressure. In order to increase GABA contents in rice grains, we constructed a RNA interference (RNAi) vector suppressing the expression of GABA transaminase 1 gene ( OsGABA- T1). GABA transaminase is a key enzyme that converts GABA to succinate semialdehyde (SSA). The RNA interference vector was transformed into the callus of japonica cv. Ningjing 1. qRT-PCR analysis showed that OsGABA- T1 transcript abundance in the RNAi transgenic lines was effectively reduced, so did the homolog gene OsGABA- T2. The GABA contents of brown rice in T3 generation of RNAi lines were 13 times higher than these in Ningjing 1, so did in polished rice as well as brown rice and polished rice stored for four months of post-harvest in transgenic rice, while other main amino acid contents did not change much. In summary, this research provides a basis for breeding a rice variety which could contribute to reduce blood pressure due to the enrichment of GABA contents in rice seeds though effectively suppressing the expression of OsGABA-T1 gene by the RNA interference technique.
高血压一直被认为是一种常见的高危慢性疾病。目前, 全球大概有10亿人正承受着高血压病症的困扰, 且呈上升趋势, 预计至2025年将再增加约60% [1]。许多研究证实, γ -氨基丁酸(γ -aminobutyric acid, GABA)是一种广泛分布于细菌和动植物中的四碳非蛋白氨基酸, 是哺乳动物中枢神经系统中重要的抑制性神经递质[2], 具有降血压[3, 4]、改善脑机能、促进生长激素分泌等功能[5]。而水稻作为世界上最主要的粮食作物之一, 全球约有半数人口以此为主食, 但糙米中GABA含量极低, 每100 g大米中大约仅含有6~9 mg的GABA, 精米中含量则更低[6, 7]。因此, 通过培育具有降血压功能的富含GABA的水稻可在很大程度上广泛和有效地缓解大量人群的高血压症状, 减轻高血压人群的精神压力和经济负担。
植物中GABA的代谢途径为三羧酸循环(Tricarboxylic Acid Cycle)的旁路。该途径中, GABA由谷氨酸脱羧酶(Glutamate decarboxylase, GAD)催化谷氨酸(Glu)生成[8, 9], 在γ -氨基丁酸转氨酶(GABA-transaminase, GABA-T)作用下生成琥珀酸半醛(Succinic semialdehyde, SSA)[10, 11], SSA随后在琥珀酸半醛脱氢酶(Succinic semialdehyde dehydrogenase, SSADH)作用下生成琥珀酸[12]进入三羧酸循环或者在SSA还原酶作用下形成γ -羟基丁酸[13, 14, 15]。Shelp等[16]研究发现在响应逆境的过程中GABA也可以由腐胺生成。目前, 以GABA合成关键酶GAD的研究较多, 该酶C端具有钙调素(Calmodulin, CaM)结合结构域。在水稻的5个OsGAD基因中, 除OsGAD2外, 其他4个OsGAD基因都具有这种结构[17]。 OsGAD2基因的C端结构域具有自动抑制GABA的作用[18], 过表达C端截短的OsGAD2基因可以显著增加种子中GABA含量[19]。在水稻中含有4个OsGABA-T基因[20], 其中OsGABA-T1(Os04g0614600)和OsGABA-T3(Os04g0614500)位于第4染色体, OsGABA-T2(Os08g0205900)和OsGABA-T4(Os02g 0112900)分别位于第8和第2染色体。OsGABA-T1和OsGABA-T2定位于线粒体中, OsGABA-T3和OsGABA-T4分别定位于质体和细胞质[21], 它们彼此间氨基酸序列同源性高达74%~84%, 与拟南芥[22]和番茄[23]转氨酶基因具有68%~75%氨基酸同源性。关于GABA-T基因的报道多以定位及酶活性为主要方向, 而对GABA影响的研究则相对较少。本研究通过构建干扰载体, 利用农杆菌介导的转基因途径, 将RNA干扰OsGABA-T1基因的表达载体导入水稻基因组, 抑制水稻中OsGABA-T1基因的表达, 获得稳定遗传的富含GABA的转基因品系, 并以此为材料, 研究OsGABA-T1基因表达降低后对GABA含量、氨基酸含量及农艺性状的影响, 为培育富含GABA而不含抗性标签的可供食用的降血压水稻品种提供基础。
转基因受体品种为本单位育成的大面积推广种植的粳稻品种(Oryza sativa L. subsp. japonica)宁粳1号(Ningjing 1), 构建干扰OsGABA-T1的LH-FAD2- 1390RNAi载体, 经农杆菌介导, 获得OsGABA-T1基因干扰的转基因植株, 并将其种植于南京农业大学土桥实验基地转基因专用田。通过对每一世代植株幼苗提取DNA进行潮霉素抗性选择标记基因(Hyg)的筛选, 得到稳定表达的T2代转基因家系, 在T2代转基因干扰株系中选取6株(独立转化子), 编号为T1、T2、T3、T4、T5、T6, 用于后续的研究。选取宁粳1号和这6株转基因株系的叶片及籽粒(以开花当天为起点, 选取花后6 d、12 d、18 d、24 d、30 d和36 d的种子), 以液氮冷冻, 置-80℃冰箱保存, 用于RNA的提取。将这6株转基因株系分单株收种后, 种植每个编号100株T3代植株, 以供农艺性状的调查。
根据GenBank公布的水稻OsGABA-T1基因及登录号AK102306, 选取其特异性片段作为RNAi干扰区段(557 bp: 1233-1789), 设计引物, 加上相应的双酶切位点及保护碱基(F: 5° -AATGGTACCGGAT CCGCAATTATGGTTAGCCCAG-3° , R: 5° -AATGAG CTCACGCGTTTATCATCGTCATCGTCGT-3° )。用试剂盒RNAprep pure Plant Kit [天根生化科技(北京)有限公司]提取宁粳1号总RNA进行干扰片段的扩增, 将得到的目标片段用琼脂糖凝胶回收试剂盒纯化, 并与pMD18-T载体连接转化, 对所获得的白斑通过质粒PCR扩增测序, 确定其为重组克隆载体pMD18-T-OsGABA-T1。用BamH I和MluI对上述重组克隆载体质粒及空载体LH-FAD2-1390RNAi质粒进行双酶切, 回收质粒酶切产物, 用T4-DNA连接酶过夜连接后转化DH5α 感受态细胞, 筛选出重组质粒, 得到含反向RNAi目标区段的中间载体LH-FAD2-1390RNAi-OsGABA-T1-1。利用KpnI和SacI同时双酶切重组克隆载体(pMD18-T-OsGABA- T1)质粒和中间载体(LH-FAD2-1390RNAi-OsGABA- T1-1)质粒, 将目标片段正向连入中间载体得到含正反RNAi目标区段的表达载体LH-FAD2-1390RNAi- OsGABA-T1。
参照CTAB法[24]提取水稻幼叶DNA用于PCR。用筛选标记基因Hyg的特异性引物(F: 5° -CTATTTC TTTGCCCTCGGAC-3° , R: 5° -ATGCCTGAACTCAC CGCGAC-3° )进行PCR检测。PCR程序为98℃预变性2 min; 94℃变性10 s, 55℃退火30 s, 68℃延伸60 s, 34个循环。目的条带为1018 bp, 经过每个世代的筛选获得稳定表达的T2代植株。
用试剂盒RNAprep pure Plant Kit [天根生化科技(北京)有限公司], 分别提取宁粳1号和转基因株系(T1至T6)的叶片及种子的RNA。用NanoDrop2000微量紫外分光光度计测定RNA浓度, 1.2%的琼脂糖凝胶电泳检测总RNA的完整性和质量。反转录成cDNA, 稀释10倍取5 μ L用于实时荧光定量PCR分析。根据已报道的水稻OsGABA-T基因和Actin内参基因的序列设计引物(表1)。用实时荧光定量PCR试剂盒(iTaq Universal SYBR Green Supermix Kit, Bio-Rad)于Bio-Rad CFX96Real-time System上进行qRT-PCR分析, 20 μ L反应体系(iTaq Universal SYBRT Green Supermix 10 μ L, RNase-free water 3.8 μ L, 前后引物各0.6 μ L, cDNA 5 μ L)。扩增反应程序为95℃ 30 s; 95℃ 5 s, 60℃ 30 s, 65℃ 5 s, 40个循环。每个试样重复3次。
| 表1 qRT-PCR所用引物 Table 1 Primers for qRT-PCR |
收获T3代种子, 于50℃烘箱烘干, 将糙米和精米磨粉过60目筛, 分别称取100 mg粉末, 加6 mol L-1盐酸, 在充氮气状态下将水解管密封置110℃烘箱烘21 h。取出冷却后, 将水解液过滤至100 mL的容量瓶中定容。取1 mL至另一容量瓶中, 水浴去除盐酸后, 加1 mL水复溶, 用0.22 mm微孔滤头过滤, 用氨基酸分析仪(日立L-8900)测定氨基酸和GABA含量。
分别选取宁粳1号和T3代转基因各家系30株生长均匀一致的植株, 调查株高、穗长、单株有效穗数、结实率和千粒重等主要农艺性状, 比较各性状在转基因水稻与受体亲本之间的差异。
测定宁粳1号叶片及花后6个时期种子中OsGABA-T基因(表1)的表达情况, 发现这4个基因中OsGABA-T1和OsGABA-T2基因表达量相对较高, OsGABA-T3和OsGABA-T4的表达量很低(图1)。在种子成熟过程中OsGABA-T1和OsGABA-T2基因随着时间的推移表达量下降, OsGABA-T1基因在24 d左右表达趋于稳定, 而OsGABA-T2表达仍在下降(图1-A), 在叶片中OsGABA-T1基因表达量最高(图1-B)。因此, 选择OsGABA-T1基因进行RNA干扰以期获得富含GABA的转基因植株。
根据OsGABA-T基因的表达情况, 构建OsGABA-T1基因干扰载体(图2), 期望获得富含GABA的转基因植株。通过农杆菌介导转化, 将潮霉素抗性选择标记基因(Hyg)与OsGABA-T1基因干扰片段导入粳稻品种宁粳1号中。使获得的转基因植株自交, 对每个世代所有植株进行潮霉素抗性基因(Hyg)的PCR检测, 获得稳定表达的干扰OsGABA-T1基因的转基因T2代家系阳性植株, 选取6株(编号T1至T6)用于后续研究(图3)。
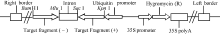 | 图2 含干扰片段的表达载体LH-FAD2-1390RNAi-OsGABA-T1的结构示意图Fig. 2 Structure map of LH-FAD2-1390RNAi-OsGABA-T1 containing RNAi fragment |
干扰OsGABA-T1家系的T2代植株叶片中OsGABA-T1和OsGABA-T2基因表达量较宁粳1号明显降低, 而OsGABA-T3和OsGABA-T4基因无显著变化(图4), 说明RNA干扰已抑制了OsGABA-T1基因的表达, 并影响OsGABA-T2基因的表达。与OsGABA-T1和OsGABA-T2基因在叶片中的表达情况相似, T3代种子中OsGABA-T1和OsGABA-T2基因表达量比宁粳1号仍明显下降(图5)。进一步选取代表性的株系测定干扰家系花后不同时期种子中OsGABA-T1和OsGABA-T2基因表达量, 发现干扰家系中OsGABA-T1和OsGABA-T2表达量一直显著低于宁粳1号(图6)。这表明干扰OsGABA-T1基因, 不仅导致OsGABA-T1基因的表达降低, 而且对OsGABA-T2的表达也造成影响。
 | 图5 转基因植株种子中OsGABA-T1和OsGABA-T2表达量Fig. 5 Expression of OsGABA-T1andOsGABA-T2 genes in seed of the transgenic lines |
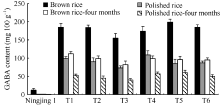
T3代种子收获后, 对宁粳1号和6个转基因株系的糙米及精米中GABA含量进行测定, 发现宁粳1号的糙米中GABA含量约为12 mg 100 g-1, 转基因株系糙米中GABA含量是其13倍以上, 最高可达199 mg 100 g-1 (图7)。宁粳1号精米中GABA含量已基本检测不到, 而在转基因株系精米中GABA含量最低仍具有73 mg 100 g-1。在常温条件下储藏4个月后, 宁粳1号的糙米和精米中均已基本检测不到GABA, 而转基因株系中精米和糙米中GABA含量仍保持较高水平(图7)。因此, 干扰OsGABA-T1基因确实可增加水稻种子中GABA含量。
由表2可以看出, 与宁粳1号相比, 6个T3代转基因株系糙米中其他常见氨基酸的含量并没有发生明显的变化。因此, 干扰OsGABA-T1基因对其他氨基酸的代谢影响并不大。
| 表2 转基因家系糙米中氨基酸含量 Table 2 Amino acids contents in brown rice (mean± SD) |
为评价该转基因水稻是否还能保持原品种的优良农艺性状, 调查其T3代植株主要农艺性状, 可以发现转基因家系中株高、每穗粒数、结实率、千粒重等性状均显著低于宁粳1号(表3)。
| 表3 转基因水稻主要农艺性状 Table 3 Main agronomic traits of OsGABA-T1 gene transgenic lines (mean± SD) |
为研究OsGABA-T基因对GABA含量的影响, 构建抑制OsGABA-T1基因表达的RNA干扰载体, 将其转入我国高产常规水稻宁粳1号后, 可显著提高转基因水稻中的GABA含量(图7)。经过几个世代的潮霉素标记基因的PCR鉴定和GABA含量的测定, 证实这种性状可以稳定遗传。
转基因家系相对于对照株高变矮, 结实率降低, 千粒重下降(表3)。这种变化很可能是GABA含量与植物体内的激素代谢相关所致, 进而影响植物的生长与衰老, 及果实成熟。Kathiresan等[25]发现繁缕茎对GABA的反应存在双向性, 较高浓度的GABA可以通过乙烯的介导来抑制茎的生长。与此同时, 在番茄中, 抑制SIGABA-T基因会因为细胞伸长缺陷及其他因素引起植株矮化, 且结实率与SIGABA-T1基因的mRNA表达量呈正相关, 而换成果实成熟特异性启动子E8则没有这种异常表型[26]。刘巧泉等[27]使用水稻GluB-1胚乳特异性启动子, 实现了铁结合蛋白在转基因水稻种子中特异性高效表达, 在很大程度上减小了转基因对植株的影响。本研究使用的组成型表达启动子导致整株植株含有过量的GABA, 进而导致GABA与植物体内的激素代谢相关性的异常, 造成转基因家系农艺性状变化。所以, 更换胚乳特异性表达启动子, 使其在胚乳中特异性表达, 将是后续研究的重要方向。
OsGABA-T1和OsGABA-T2的氨基酸序列同源性达84%。因此, OsGABA-T1基因干扰家系中OsGABA-T2基因的表达量下降很可能是由于两者同源性较高, 从而导致在干扰OsGABA-T1基因的过程中也对OsGABA-T2基因产生了一定程度的干扰。与此同时, 亚细胞定位显示水稻OsGABA-T1和OsGABA-T2均定位于线粒体中[21]。所以, 二者可能在种子的发育过程中协同调控GABA的含量。
转基因株系中GABA含量在糙米中最高可达199 mg 100 g-1, 精米中仍含有73 mg 100 g-1(图7), 而人体每天只需摄入30~50 mg纯天然的GABA就能起到理想的保健作用。通过RNA干扰抑制水稻OsGABA-T1基因的表达可以富集GABA, 培育富含GABA的具有降血压功能的水稻。但是要培育高产的富含GABA的降血压转基因水稻还需要进一步改进。本研究所使用的载体含有潮霉素抗性标签, 并且不可以通过后代分离去除。于恒秀等[28]通过双T-DNA载体筛选得到不含潮霉素基因的转Wx基因植株, 自交得到纯合转基因系。后续研究中使用psb130双T-DNA载体构建干扰载体, 筛选后代从而获得不含潮霉素抗性选择标记基因的干扰OsGABA-T1基因的转基因植株。在GABA富集过程中我们不仅要节流还要开源, 过表达C端截短的OsGAD2同样可以显著提高GABA含量[18, 19]。因此, 进一步将构建胚乳特异性过表达OsGAD2基因的载体, 筛选获得阳性转基因株系, 并且与干扰OsGABA-T基因获得的水稻进行功能性水稻聚合育种, 将可以获得富集GABA程度更高的具有降血压的功能稻, 这不仅具有很大的发展潜力和经济价值, 而且也能实现优化高效的育种目的。
RNA干扰抑制水稻OsGABA-T1基因的表达后, 干扰株系叶片和种子中OsGABA-T1和OsGABA-T2基因表达量均显著降低, 同时糙米和精米中GABA含量相对于宁粳1号也随之显著增加, 而其他氨基酸没有明显变化。所以, 利用RNA干扰OsGABA-T1基因能有效提高稻米γ -氨基丁酸(GABA)含量。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|