第一作者联系方式: E-mail:swuwxhong@163.com
多聚半乳糖醛酸酶抑制蛋白(PGIP)是一种特异性结合和抑制真菌内切多聚半乳糖醛酸酶(endo-PG)活性的细胞壁结合蛋白。采用RT-PCR从嘉陵40 ( Morus atropurpurea Roxb.)果实中扩增 PGIP基因cDNA, 利用生物信息学的方法分析其编码蛋白的结构和功能。结果表明, 嘉陵40 PGIP开放阅读框全长1017 bp, 编码338个氨基酸残基, 被命名为 MaPGIP1。MaPGIP1蛋白分子量37.9 kD, 等电点为为6.65, 信号肽为N端26个氨基酸残基, 具有4个潜在的N-糖基化位点。MaPGIP1蛋白的核心区域由9个串联的LRRs基序组成。原核表达产物经SDS-PAGE分析, MaPGIP1蛋白以包涵体形式出现, Western blot证实了重组蛋白的特异性, 经过Ni-NTA柱纯化和分步透析复性后获得可溶性蛋白, 该蛋白能部分抑制果桑肥大性菌核病菌( Ciboria shiraiana) PG (CsPG)活性, 其最适pH值为4.5~5.0, 最适温度30℃。抑菌试验结果表明, MaPGIP1蛋白在果桑肥大性菌核病菌菌丝侵染油菜叶片过程中具有一定的抑制效果。
Polygalacturonase-inhibiting protein (PGIP) is a defense protein found in plant cell wall. It is involved in plant defense against infection of pathogens by modulating/inhibiting the activity of endo-polygalacturonase. In this test, a pair of specific primers were designed based on PGIP genes of mulberry ( Morus notabilis) in Morus Genome Database. The cDNA of Jialing 40 PGIP gene was amplified from fruit by RT-PCR. The sequences of mulberry PGIP, physic-chemical parameters of PGIP protein and phylogenetic relationship were analyzed by bioinformatics softwares. Using pET-28a(+) as a fused expression vector, a recombinant plasmid pET28a- PGIPcontaining the mature peptide of PGIP was constructed. Then its expression was induced in Escherichia coliBL21 (DE3) with IPTG. The samples induced at different times were collected and SDS-PAGE was used to analyze the protein expression in E. coliBL21 (DE3). After purification of the protein by Ni-Hind affinity column and Western blot, the PGIPgene expressed in E. coliBL21 (DE3). Finally its enzymatic activity was tested by bacteriostatic experiment. The full-length cDNA of PGIPfrom Jialing 40 fruit was obtained. Sequence analysis showed that the fragment contains an open reading frame of 1017 bp encoding 338 amino acid residues with a molecular mass of 37.9 kD, named MaPGIP1. This deduced protein has a pI of 6.65, a hydrophobic region of 26 amino acid residues in the N-terminal which was considered to be a signal peptide, with four potential N-glycosylation sites, and it center LRR structural domain is composed of nine tandem LRR motifs. Phylogenetic tree showed that Jialing 40 had the closest evolutionary relationship with M. notabilis. The prokaryotic expression results showed that efficient expression of PGIP protein could be realized after induction with 0.5 mmol L-1 IPTG in E. coli BL21 (DE3) for five hours at 28 °C. The SDS-PAGE displayed that the recombinant proteins only appeared as inclusion bodies. The inclusion bodies protein was purified by Ni-NTP affinity column and confirmed by Western blot. Soluble product could be refolded though stepwise dialysis strategies. The recombinant protein concentration was 0.58 μg μL-1tested by Bradford method. MaPGIP1 partially inhibited CsPG with an optimum pH between 4.5 and 5.0, and an optimum temperature of 30°C. The preliminary infection experiment result showed that MaPGIP1 protein after renaturation had a certain inhibiting effect on Hypertrophy Sorosis Sclerotenisis infected by Ciboria shiraiana.
细胞壁是植物寄主细胞抵御病原真菌入侵的第一道防线。病原真菌侵染植物时能分泌多种水解细胞壁的酶, 如多聚半乳糖醛酸酶(polygalacturonase, PG)、果胶甲基酯酶(pectin methylesterase, PME)、果胶裂解酶(pectate lyase)[1]。其中多聚半乳糖醛酸酶可以降解植物细胞壁中的果胶, 破坏细胞的完整性, 为病原菌的生长和发育提供大量的营养物质[2, 3]。植物在抵御病原菌的进化中, 逐步形成了一系列自卫防御机制, 多聚半乳糖醛酸酶抑制蛋白(polygalacturonase inhibiting protein, PGIP)便是其中之一。PGIP是一种特异性结合和抑制真菌内切PG活性的细胞壁结合蛋白, 富含抗病基因所具有的亮氨酸重复序列(leucine-rich repeat, LRR), 属于LRR蛋白超家族, 是一种重要的植物防御蛋白。PGIP具专一性、可逆地与真菌多聚半乳糖酶结合, 竞争性抑制病原菌PG酶的活性, 可阻断病原菌的侵染和抑制相应病害的发生[1, 4]。此外, PGIP在与PG的相互作用中使植物细胞壁能形成有生物活性的寡聚半乳糖醛酸(oligogalacturonide, OG), 有效地激活植物体内的防御系统, 从而诱导植物的抗病性响应, 使植物获得系统抗病性[5]。在植物免疫方面, PG-PGIP的互作方式已成为蛋白质识别的模式系统[6]。另有报道, PGIP还与花粉发育[7]、花的发育[8]、种子萌发[9]、胁迫反应、果实冷藏和果实的病虫害响应有关[10]。因而, PGIP的研究已成为抗病基因工程和果实耐贮藏基因工程研究的热点。目前, 国内外的研究者已经从高山离子芥[11]、苹果[12]、番石榴[13]、马铃薯[14]、香瓜[15]、梨[16]、扁桃[17]等植物中克隆了PGIP基因。
本研究从桑树基因组信息入手, 克隆了桑树的PGIP基因, 并对该基因的生物功能进行了初步研究, 为果桑的抗病分子育种提供了新思路。
选取重庆市审定的果桑(Morus atropurpureaRoxb.)品种嘉陵40的果实, 液氮速冻后-80℃冰箱保存备用。油菜中双10由西南大学农学与生物科技学院提供。果桑肥大性菌核病菌(Ciboria shiraiana)由本实验室分离、鉴定并保存, 其中国典型培养物保藏中心编号为CCTCC AF 2014019。大肠杆菌菌株DH5α 、BL21(DE3)购自生工生物工程(上海)股份有限公司。pET28a(+)载体为本实验室保存, T/A克隆载体pMD19-T simple vector购自宝生物工程(大连)有限公司。
T4 DNA连接酶、限制性内切酶BamH I、NotI、TaqDNA聚合酶、RNAiso Plus试剂盒、反转录酶M-MLV、蛋白质Maker均购自宝生物工程(大连)有限公司; 胶回收试剂盒、质粒抽提试剂盒均购自Omega公司; 引物由南京金斯瑞生物科技有限公司合成; 鼠抗His· Tag单克隆抗体(一抗)、辣根过氧化物酶(HRP)标记羊抗鼠IgG (二抗)、Ni-NTA亲和树脂购自南京金斯瑞生物科技有限公司。牛血清白蛋白(BSA)购自生工生物工程有限公司; 其他试剂均为国产分析纯。
取100 mg桑椹于预冷的研钵中加液氮迅速研磨成粉末状, 参照TaKaRa公司RNA抽提试剂盒说明书提取总RNA, 最后用50 μ L DEPC水溶解RNA, 0.8%琼脂糖变性凝胶电泳检测, 微量紫外分光光度计测定浓度。以总RNA为模板, 以Oligod(T)18为引物, 利用M-MLV反转录酶合成cDNA第1链, -80℃保存备用。根据在川桑基因组数据库(http://morus.swu.edu. cn/morusdb/)中检索到的PGIP基因序列设计了1对特异性引物(MaPGIP-CF: 5° -ATGGACGATCGAAAG CAGATC-3° , MaPGIP-CR: 5° -CTATTTACAACTTTC CATGAGC-3° )。以第1链cDNA为模板进行PCR扩增, 反应程序为94℃预变性4 min; 94℃变性45 s, 50℃退火45 s, 72℃延伸60 s, 35个循环; 结束后72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测后, 紫外灯下切下目的条带, 用Omega胶回收试剂盒回收。回收产物与pMD 19-T simple vector载体连接并转化大肠杆菌 DH5α 感受态细胞, 随机挑取抗性克隆, 菌液PCR检测阳性单克隆送南京金斯瑞生物科技有限公司测序。
将克隆得到的片段用Sequencher4.2软件拼接, 获得MaPGIP1的cDNA全长序列, 使用ExPasy在线工具ProtParam (http://web.expasy.org/protparam/)预测PGIP编码氨基酸的基本理化性质, 使用ProtScale (http://web.expasy.org/protscale/)分析亲水性与疏水性, SignalP (http://www.cbs.dtu.dk/services/)预测蛋白质信号肽和亚细胞定位, NetNGlyc (http://www. cbs.dtu.dk/services/NetNGlyc/)预测蛋白质糖基化位点。在SMART (http://smart.embl-heidelberg.de/)上预测蛋白质结构域, 利用软件SWISS-MODEL Automated Mode (http://swissmodel.expasy.org/)预测蛋白的三维结构, 并用软件Swiss-PdbViewer (http:// spdbv.vital-it.ch/)展示获得的三维结构。将预测的氨基酸序列与川桑(Morus notabilis)、拟南芥(Arabidopsis thaliana)、菜豆(Phaseolus vulgaris)、中国李(Prunus salicina) 4种植物的PGIP编码的氨基酸序列进行多重比对。利用MEGA5.2软件的邻近结合法(neighbor- joining, NJ)构建PGIP蛋白分子系统发育树, 设BootStrap值为1000。
预测信号肽切割位点后, 将桑树PGIP基因成熟肽cDNA片段克隆到表达载体pET28a(+)中构建融合表达载体, 其过程为, 根据所克隆的PGIP的序列以及原核表达载体pET28a(+)多克隆位点序列, 设计1对引物PGIP-BF: 5° -CGGGATCCGAGCTCTG CCATCCCCAAGAC-3° , (下画线处为BamH I酶切位点)和PGIP-NR: 5° -GAATGCGGCCGCTCTATTTAC AACTTTCCATGAGCG-3° (下画线处为Not I酶切位点)。用BamH I和NotI双酶切PCR产物和pET28a(+)质粒, 分别回收目的片段, 二者经T4 DNA连接酶连接后转化大肠杆菌DH5α 感受态细胞, 随机挑取抗性克隆, 然后将PCR及双酶切鉴定后的阳性克隆送南京金斯瑞生物科技有限公司测序, 将测序正确的重组表达载体命名为pET28a-PGIP。MaPGIP1蛋白的表达与检测参考李镇刚等[18]的方法。
将0.5 mmol L-1 IPTG在28℃下诱导表达量最高时段收集的大肠杆菌BL21菌液超声波破碎, 4℃、
13 000× g离心10 min, 分别收集上清与沉淀(即包涵体), 用适量8 mol L-1尿素溶解沉淀过夜, 4℃、13 000× g离心10 min, 收集上清液。采用Ni-NTA亲和层析柱将超声波破碎的上清液和包涵体溶液中的表达蛋白分离纯化, 参照金斯瑞蛋白纯化试剂盒(Cat No. L00250)操作。取等量纯化样品进行SDS-PAGE电泳检测。然后将蛋白从SDS-PAGE胶上转移到NC膜上, 用封闭液(TBST+5%脱脂奶粉) 4 ℃封闭过夜; 随后与鼠抗6× His单克隆抗体室温孵育90 min, 以TBST缓冲液清洗3次; 加入TBST缓冲液稀释过的辣根过氧化酶标记的羊抗鼠二抗, 室温反应1 h, 以TBST缓冲液清洗3次; 将等体积的ECL显色液A和B混匀后滴在NC膜上, 避光显色5 min, 于成像系统上曝光2 min, 照相记录。
收集上述含有目的蛋白的流出液, 加入一定体积的复性缓冲液(50 mmol L-1 Tris-HCl, 2 mmol L-1还原型谷胱甘肽, 0.5 mmol L-1氧化型谷胱甘肽, 5%甘油, pH 8.0), 4℃过夜后装入合适的透析袋中密封, 用透析缓冲液(PBS, 含10%甘油, 5 mmol L-1 β -巯基乙醇, 8、4、2、1、0.5、0 mol L-1尿素, pH 8.0) 4℃下透析进行蛋白质复性。每种尿素浓度透析3次, 每次处理8 h。最后将透析袋放入缓冲液A (10 mmol L-1 Tris-HCl, 1 mmol L-1 EDTA, 2 mmol L-1 β -巯基乙醇, 10%甘油, pH 8.0)中4℃下透析24 h。然后低温冷冻干燥浓缩蛋白液到1 mL左右。采用Bradford法测定重组蛋白浓度。
按皇甫海燕[19]的方法制作D-半乳糖醛酸标准曲线。参考周立等[20]的方法制备果桑肥大性菌核病菌PG酶(CsPG): 将PDA固体培养基上生长的果桑肥大性菌核病菌菌丝块接种到Czapek-Dox液体培养基(0.5%果胶代替蔗糖), 25℃, 150转 min-1振荡培养5 d, 然后抽提得到滤液, 4500× g离心30 min, 取上清液, millipore超滤管浓缩菌液, 制备浓缩的CsPG。因PGIP具有抑制PG分解多聚半乳糖醛酸生成D-半乳糖醛酸的特性, 取0.5%多聚半乳糖醛酸溶液(用100 mmol L-1NaAc-HAc, pH 5.0缓冲液配制) 300 μ L, 加CsPG 50 μ L、不同量的MaPGIP1蛋白, 用100 mmol L-1 NaAc缓冲液补齐1 mL, 30℃水浴1 h。然后加入1 mL DNS试剂, 沸水浴5 min, 冷却后用水稀释至5 mL, 在紫外分光光度计540 nm波长下比色, 以不加MaPGIP1蛋白作对照, 记录其OD值。平行测定3次取其平均值在标准曲线上查出反应液中相当于D-半乳糖醛酸的毫克数。定义MaPGIP1的活力单位为30℃和pH 5.0的条件下, 与对照相比, 每分钟酶促反应减少1 μ g当量半乳糖醛酸的量。
在30℃的测活体系下, 用不同pH值的100 mmol L-1 NaAc-HAc缓冲液配制0.5%的多聚半乳糖醛酸溶液, 取300 μ L底物, 加入100 μ L的MaPGIP1蛋白液, 50 μ L CsPG酶, 用对应的缓冲液补齐1 mL, 以不加MaPGIP1蛋白液为对照, 测定MaPGIP1对CsPG的抑制作用, 确定其最适pH值。4℃下将MaPGIP1酶液在不同pH值缓冲液中处理12 h, 然后在30℃、pH 5.0的条件下检测MaPGIP1蛋白对CsPG的抑制作用, 分析其pH稳定性。试验数据为平行测定3次的平均值。
反应体系同上, 在pH 5.0的条件下, 测定不同温度(20~80℃)下MaPGIP1酶促反应速度, 确定其最适温度。将MaPGIP1在不同温度(20~100℃)热处理30 min, 迅速冷却至室温, 在最适的测活体系(30℃, pH 5.0)中检测MaPGIP1蛋白对CsPG酶的抑制作用, 分析其热稳定性。试验数据为平行测定3次的平均值。
按皇甫海燕[19]的方法, 待油菜长到6~8片真叶时, 取若干生长一致的油菜叶片, 表面消毒后, 用灭菌的牙签轻轻刺伤表面, 然后在受伤部位依次滴加50 μ L的灭菌水、PBS缓冲液、MaPGIP1蛋白液, 每个处理重复3次, 然后将直径大约为5 mm带有PDA的果桑肥大性菌核病菌丝块反贴在油菜叶片处理处, 置灭菌培养皿中, 移入培养箱(25℃恒温, 12 h光照, 12 h黑暗, 光照度300 µ mol m-2 s-1, 相对湿度90%), 逐日观察3 d叶片被侵染的情况并统计病斑直径。
以嘉陵40果实总RNA为模板, 通过RT-PCR扩增, 获得大约1000 bp的条带。将该片段克隆到pMD19-T simple vector载体上, 经测序表明, 该序列全长1017 bp, 含一个开放阅读框(ORF), 编码一个由338个氨基酸残基组成的蛋白质(图1)。在线软件预测该蛋白质的分子量为37.9 kD, 理论等电点为6.65, 分子式为C1717H2650N442O495S14, 酸性氨基酸(Asp+Glu)占9.8%, 碱性氨基酸(Lys+Arg)占9.5%, 亮氨酸比例最高(13.3%); 不稳定系数为38.71, 说明该蛋白为稳定蛋白。将该cDNA及其推导的氨基酸序列在NCBI网站上进行Blast比对, 表明该cDNA及其推导的氨基酸序列与已报道的PGIP基因及其推导的氨基酸的序列同源性最高。分析结果表明, 所克隆片段为桑树的PGIP基因, 命名为MaPGIP1, 并提交给GenBank, 登录号为KJ704112。蛋白质疏水性分析表明, 该蛋白N端有一明显的疏水区, 采用神经网络方法预测蛋白质信号肽表明, MaPGIP1信号肽为N端的26个氨基酸残基, 这与疏水性分析结果相一致。序列分析结果还表明, MaPGIP1成熟肽氨基酸序列中具有4个潜在的N-糖基化位点, N端和C端各有4个参与二硫键形成的半胱氨酸残基, 亚细胞定位分析表明, 该蛋白属于胞外蛋白。MaPGIP1三级结构预测结果表明, 由MaPGIP1肽链构建的三维模型(图2左)含10个α -螺旋和20个β -折叠, 主体结构由9个串联的LRRs基序组成; MaPGIP1氨基酸序列从第76个氨基酸开始的LRRs基序均具有“ LxxLxLxxNxLS/TGxIPxxLxxL” (x代表任意氨基酸残基)这样的共有序列, 除个别替换、插入或缺失外, 序列高度保守(图2-右)。
MaPGIP1编码氨基酸序列多重比对结果(图3)表明, MaPGIP1与川桑PGIP蛋白同源性最高, 一致性达84%, 与菜豆、拟南芥和中国李PGIP蛋白同源性只有50%~65%。4条氨基酸序列都含有位点十分保守的8个半胱氨酸残基。选用GenBank中已登录的11个物种的17条氨基酸序列绘制同源进化树(图4)。结果表明, MaPGIP1与川桑PGIP具有较近的亲缘关系; 与豆科植物PGIP蛋白关系较远。同属一科的植物聚为一类, 不同科的植物PGIP蛋白进化上形成不同分支。
利用BamH I和Not I对重组子pET28a-PGIP和pET28a(+)分别进行双酶切鉴定, 酶切产物用1%的琼脂糖凝胶电泳检测, 结果pET28a(+)仅在5300 bp处出现一条亮带, 而pET28a-PGIP则分别在5300 bp和1000 bp处出现2条亮带。此外, 重组质粒的测序结果与克隆序列完全一致, 开放阅读框正确, 表明MaPGIP1基因原核表达载体pET28a- PGIP构建成功。
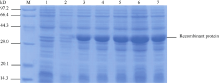
将酶切鉴定和测序后的重组质粒pET28a- PGIP转化大肠杆菌BL21 (DE3), 经0.5 mmol L-1 IPTG诱导表达后进行SDS-PAGE分析(图5)。融合蛋白在28℃条件诱导产生了一条约38 kD蛋白条带, 与理论分子质量一致。28℃、200转 min-1的诱导条件下, 目的蛋白2 h后即高效表达且5 h后表达量最高。
诱导后大肠杆菌BL21(DE3)菌液超声波破碎后, 经SDS-PAGE分别检测上清液和沉淀, 结果表明, 目的蛋白主要以包涵体的形式存在, 即该融合蛋白为不可溶。随即用8 mol L-1尿素溶解沉淀, 离心后取上清液, 采用Ni-NTA亲和层析柱对表达蛋白进行分离纯化。当用含100 mmol L-1咪唑的洗脱冲洗柱子时, 少量目的蛋白能被洗脱, 用含250 mmol L-1咪唑的洗脱液可以把目的蛋白完全洗脱(图6-A)。进一步检测所表达的蛋白是否含有6× His表达标签的融合蛋白, 以鼠抗6× His为一抗, 以辣根过氧化酶标记的羊抗鼠为二抗, 对表达产物的Western blot印迹分析表明, 经0.5 mmol L-1 IPTG诱导5 h产生的38 kD的蛋白条带与抗体发生很强的交叉反应, 进一步证明融合蛋白得到表达(图6-B)。
由于重组MaPGIP1蛋白全部存在于包涵体中, 因此, 只有通过复性才能获得有生物活性的蛋白。收集经Ni-NTA 亲和层析柱纯化的目的蛋白, 装入透析袋中密封, 4℃下用透析缓冲液进行蛋白质复性, 经过分步透析后, 获得可溶性蛋白, 采用Bradford法测定重组蛋白浓度, 标准曲线方程y=20.442x- 7.5948 (R2=0.9988), 线性范围0.2~0.8 μ g。经计算, 复性的MaPGIP1蛋白浓度为0.58 μ g μ L-1。
抑菌试验的结果表明, 滴加灭菌水或PBS缓冲液的叶片, 接种菌丝后所产生的病斑面积比滴加MaPGIP1蛋白的叶片病斑面积要大, 并且前两者对叶片的侵害程度也比后者严重(表1和图7)。说明果桑肥大性菌核病菌在侵染油菜叶片的过程中, MaPGIP1蛋白对其有一定的抑制效果。
| 表1 MaPGIP1蛋白对肥大性菌核病菌侵染油菜叶片的抑制效果 Table 1 Inhibition effect of MaPGIP1 protein against infection by Ciboria shiraiana to rape leaves (mm) |
D-半乳糖醛酸标准曲线公式y = 1.2871x - 0.0512 (R2= 0.9998), 线性范围0.1~0.8 mg。PG可以降解多聚半乳糖醛酸生成D-半乳糖醛酸, 而MaPGIP1会抑制PG酶的活性, 从而影响到所生成D-半乳糖醛酸的量, 从图8可以看出, 随着MaPGIP1蛋白量的增加, CsPG降解多聚半乳糖醛酸生成D-半乳糖醛酸的量逐渐减少, 当添加20 μ L MaPGIP1蛋白液时, 对CsPG酶的抑制率为6.9%, 当添加100 μ L MaPGIP1蛋白液时, 对CsPG酶的抑制率为44%, 充分说明MaPGIP1蛋白对CsPG有一定的抑制作用, 当添加MaPGIP1蛋白液为120、150和200 μ L时, 对CsPG酶的抑制率分别为45.4%、46.0%和47.0%, CsPG酶活性并没有被完全抑制, 推测可能是由于MaPGIP1缺乏糖基化修饰而不能完全表现该蛋白活性, 并且进一步增加 MaPGIP1蛋白液, CsPG酶的活性并没有出现明显下降, 因此, 取100 μ L MaPGIP1蛋白液进行下一步试验是比较适宜的。
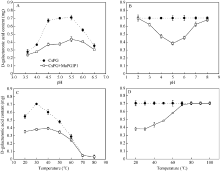
在pH值在3.5~6.5范围内, 重组MaPGIP1蛋白对CsPG酶都具有一定的抑制作用, 随pH值增大呈上升趋势, 在pH 5.0时达到高峰, 之后随pH值增大呈下降趋势, 并且在pH 4.5~5.0之间, MaPGIP1蛋白对CsPG酶抑制作用最强, 抑制率达到44.9%~ 46.3%; 而pH为3.5或6.5时, MaPGIP1蛋白抑制能力迅速下降, 分别为13.7%和13.9%; 由此表明, MaPGIP1蛋白的最适pH可能在4.5~5.0之间(图9-A)。在pH值在4.0~6.0范围内, MaPGIP1蛋白能抑制CsPG酶32.6%~45.5%的活力; 当pH > 7或pH < 3时, MaPGIP1蛋白的活力迅速降低, 几乎丧失, 说明该蛋白不耐酸碱(图9-B)。如图9-C所示, MaPGIP1蛋白在低温情况下随温度的增加对CsPG酶的抑制能力逐渐增强, 至30℃抑制能力达到最高, CsPG酶活力下降了46%, 之后随着温度的上升蛋白活力开始下降, 80℃时, CsPG酶几乎失去活性, 无法准确测定MaPGIP1蛋白活性。当MaPGIP1蛋白在低温(20~ 30℃)处理30 min后, 对CsPG酶的抑制能力略有下降, 40℃处理后, 其抑制能力为38%, 50~70℃ MaPGIP1蛋白活力迅速下降, 抑制能力从30%降到3%, 在80℃及更高温度, MaPGIP1蛋白活力已经丧失(图9-D)。
本研究从果桑嘉陵40果实中克隆到一条长1017 bp、包含完整开放阅读框的cDNA序列, 同桃、中国李、梅的PGIP基因同源性为64%~67%, 氨基酸序列分析显示其具有PGIP蛋白典型的LRR重复序列, 符合LRR蛋白家族特征。确定为桑树的PGIP基因, 命名为MaPGIP1, GenBank登录号为KJ704112。LRR蛋白广泛存在于自然界中, 参与许多重要的生命活动, 包括植物防御、信号传导、发育、DNA修复和RNA加工等[5, 7, 8, 9]。PGIP属于高等植物LRR蛋白家族, 具有典型的LRR结构。在植物中大多数已知抗性基因的表达产物都是LRR蛋白, 具有“ xxLxLxxLxxNxLxxGxIPxxLxxL” 共有序列, 这一结构由β -折叠/β -转角/β -折叠/α -螺旋结构区域构成, 其主要功能可能是提供一个通用的蛋白质-蛋白质相互作用的结构骨架, 被认为是参与蛋白质-蛋白质相互作用的关键区域, PGIP正是通过LRR基序暴露于外表面的氨基酸残基来抑制PG的活性[21, 22, 23]。如果暴露于表面的某些氨基酸残基发生改变, 则会对PGIP的活性有重要的影响[24]。对嘉陵40的MaPGIP1蛋白序列预测分析发现, 该蛋白成熟肽N端和C端各有4个Cys残基, 可以形成2对二硫键, 推测其对维持蛋白质结构稳定和生物活性具有重要作用。在线软件预测MaPGIP1有4个潜在的N-糖基化位点, 核心区域由9个LRR基序串联组成, 都具有“ LxxLxLxxNxLS/ TGxIPxxLxxL” 这一保守结构。从预测的MaPGIP1三级结构来看, 它与菜豆PGIP2结构类似[25], 但MaPGIP1缺少一个LRR基序, 这说明不同植物的PGIP与PG的相互识别具有一定的特异性。
PGIP序列比对结果表明, 本试验所克隆的MaPGIP1与川桑PGIP的氨基酸序列同源性为84%, 与中国李和菜豆的氨基酸同源性分别为65%和50%, 表现出属内同源性高、属间相对较低的特点。在所有PGIP蛋白中, 半胱氨酸残基位点高度保守, 这反映了该位点的半胱氨酸对LRR蛋白生物功能具有十分重要的作用。进化树分析结果也显示近缘属内距离较近、远缘属间相对较远的特点。虽然不同植物PGIP蛋白之间的同源性不高, PGIP蛋白功能多样, 但LRR蛋白家族中保守氨基酸残基十分一致, 而且二级结构也惊人地相似, 暗示LRR基序在进化过程中保持较高的选择压力[26]。Mattei等[26]同时通过对氨基酸序列比对发现, 所有已知的LRR蛋白都具有十分保守的序列模式, 双子叶植物PGIP蛋白有3个保守的结构域, 即LRR区、N端区和C端区, 本文克隆的MaPGIP1在N端有LC、DK、LL、IK等保守的氨基酸残基, 中心结构由9个高度保守的LRR基序组成, C端有CLCGxPL保守序列, 这与Mattei等[26]的研究报道一致。
利用原核表达系统是表达重组蛋白的一种重要和有效的方法。原核表达系统简便、快速、高效, 然而, 大肠杆菌中高效表达的重组蛋白往往导致包涵体的产生, 虽然包涵体在分离纯化蛋白方面具有明显的优势, 但将其从变性状态复性为有生物学活性的产物仍是一大难题[27]。目前, 提高重组蛋白活性和产量的方法主要有两个, 一是促进重组蛋白的可溶性表达; 二是优化蛋白复性过程。包涵体的复性方法主要有稀释复性、透析复性、超滤复性和柱上复性等, 而稀释法和透析法是最简单和常用的方法。Nalumpang等[28]在大肠杆菌中表达柑橘PGIP基因时, 表达产物主要以不溶的包涵体形式出现, 可溶部分很少, 纯化效率也很低, 但将可溶部分用硫酸铵沉淀后表现出对PG有部分抑制作用。本实验将MaPGIP1基因导入大肠杆菌诱导融合蛋白的表达, 然后用高浓度尿素溶解表达产物, 通过Ni-NTA柱纯化收集目的蛋白, 利用含有氧化还原系统的复性缓冲液分步透析复性, 最终获得了具有活性的蛋白, 这为原核表达包涵体蛋白的复性提供了有效的试验方法。
PG是病原菌重要的致病因子, 在寄生过程中, 病原菌分泌PG以降解细胞壁的多聚半乳糖醛酸。由于能与病原菌PG相互作用, PGIP蛋白成为植物防御机制的重要组成部分, 这也为其在转基因育种中的应用提供了可能性。Powell等[29]将梨PGIP基因导入番茄后, 可以显著抑制灰霉菌(Botrytis cinerea)在转基因植株叶片上的扩散, 而且转基因植株组织的腐烂速度也明显低于非转基因植株。杨丽华等[30]将人参PgPGIP1转入小麦, T0至T4代转基因株系对全蚀病与根腐病的抗性明显提高。也有研究表明, PGIP由小的基因家族编码, 不同成员对PGs的识别具有特异性, 不同物种甚至同一物种不同的PGIP蛋白的抑菌效果存在差异[22, 31], 所以, 转PGIP基因的植株可能不会表现对特定PGs抑制。因此, 在通过转PGIP基因进行植物抗病育种前有必要进行体外抑菌试验。Prabhu等[32]将珍珠粟Pglpgip1基因转入大肠杆菌并获得了有活性的PglPGIP1蛋白, 该蛋白在pH 4.0~4.5时对AnPGII酶具有26%的抑制作用; 而来自棉花的PGIP蛋白对黑曲霉和大丽轮枝菌PG酶分别有50%和25%的抑制作用[33]; 但Kemp等[34]研究发现, 小麦PGIP对黑曲霉和腐病菌PG的抑制性只有5%。本研究以果桑肥大性菌核病菌为测试菌株, 体外抑菌试验结果表明, MaPGIP1对该菌具有一定的抑制作用, 在pH 4.5~5.0、30℃时, 抑制作用最强, 能抑制CsPG酶45.5%的活力, 从这一试验结果来看, MaPGIP1可以用于作物抗病分子育种的目的基因。
吕蕊花等[35]研究表明, 果桑肥大性菌核病菌和油菜菌核病菌的子囊孢子能相互交叉传染果桑和油菜。本实验也证实这一结论, 离体接菌表明MaPGIP1蛋白对该菌在侵染油菜前期有一定的抑制效果, 能缓解油菜的发病症状。这也说明MaPGIP1基因在桑树体内行使一定的功能, 但植物抗病是一个复杂的调控网络, MaPGIP1在其中扮演怎样的角色, 如何响应外界信号以及在桑树中的表达模式, 仍需进一步研究。
获得了桑树PGIP全长cDNA序列, 命名为MaPGIP1, 并成功实现了该基因编码蛋白在大肠杆菌体内的高效表达。经过透析复性获得了可溶性蛋白, 该蛋白对果桑肥大性菌核病菌前期侵染过程有一定的抑制效果, 抑制的最适pH值为4.5~5.0, 最适温度为30℃。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|