植物激素茉莉酸(jasmonic acid, JA)作为一种可以长距离运动的信号分子在植物对昆虫侵害的系统抗性中起核心调控作用。为了解析玉米JA信号途径及抗虫机制, 本研究利用改进的玉米突变体的筛选方法, 筛选与JA信号途径相关的突变体用于下一步的研究。将甲基磺酸乙酯(ethyl methane sulfonate, EMS)诱变的玉米突变体库6118份种子分别置含有外源茉莉酸甲酯(methyl jasmonate, MeJA)的培养基中培养, 通过观察玉米根系的生长情况, 确定对MeJA的不同耐受性。当MeJA终浓度为50 µmol L-1时, 初步筛选到对MeJA不敏感的I级耐受性突变体61株; 当MeJA终浓度分别为100 µmol L-1和200 µmol L-1时进行验证, 得到的耐受性事件分别为37株和10株。对自交收获的子一代遗传性分析表明, 这些突变体对MeJA表现出的耐受性具有可遗传性。筛选获得的对MeJA不敏感突变体可能与JA调控有关, 是研究玉米JA信号途径的很好材料。
The phytohormone jasmonate plays a pivotal role in plant systematic resistance to herbivores attack as a long-distance mobile signal. To demonstrate the Jasmonic acid (JA) signal pathway and the insect-resistant mechanism in maize, we utilized an improved approach to screen the maize mutants associated with JA signal pathway, which will be available for further research. The 6118 lines’ seeds from EMS-mutagenic maize mutants library were cultivated in the medium containing the exogenous MeJA. The different tolerances of the mutants to MeJA were identified by observing the growth of maize roots. When the final concentration of MeJA was 50 µmol L-1, 61 MeJA-insensitive mutants with tolerance Grade I were obtained in the primary screening experiment. When the final concentration of MeJA was 100 µmol L-1 or 200 µmol L-1, 37 and 10 tolerant events were gained in the confirmation experiments, respectively. Then, we analyzed the heredity of M1 seeds tolerant to MeJA. The results showed that the tolerance of the mutants to MeJA was hereditable. The MeJA-insensitive mutants associated with JA regulation pathway are the potential materials for the further studies of JA signal pathway and insect resistant mechanism in maize.
高等植物在长期的进化过程中形成了复杂而精细的抗性反应机制以抵抗昆虫的侵害。茉莉酸(JA)在植物防御如植物与食草动物之间的相互作用方面起着重要作用。Reymond等[1]的研究表明, 在拟南芥叶片中, 约67%~ 85%的伤害诱导和昆虫诱导的基因是由JA调控其表达的, 超过1.3%的蛋白编码基因是通过激活JA信号来响应伤害诱导表达的。这些蛋白编码基因被分为功能基因(如茉莉酸合成、茉莉酸信号组件等基因)、防御基因和胁迫响应基因等。李常保等[2]以番茄为模式系统研究植物对昆虫抗性反应的分子基础, 筛选获得番茄抗性缺失突变体spr6。研究表明, 茉莉酸(JA)能够以剂量依赖的方式诱导蛋白酶抑制剂II (protease inhibitor, PI-II)的表达, Spr6基因是LeCOI1基因单碱基突变形成的一个等位基因, 该突变并没有影响JA的基础含量, 但影响了受伤诱导的JA的积累。
基于JA途径在植物防御中的重要作用, 在JA的生物合成与调控方面的研究进展很快, 已有多篇文献综述[3, 4, 5, 6, 7, 8, 9]。在信号转导方面, JA通过与转录因子间的相互作用来调控防御蛋白的表达及次生物质的合成[10]。JA信号发生在细胞核中, 它作为信号分子会诱导相关抗逆基因的表达, 从而增强植物的抗逆性[2]。拟南芥JA信号途径在没有外界胁迫的情况下, JAZ蛋白与MYC2及其他转录因子结合处于失活状态, 不能启动基因转录; 一旦植物受到生物(如昆虫、真菌激发子等)和非生物(如干旱、高盐和低温等)胁迫刺激时, 植物体内合成大量JA, 在依赖ATP的腺苷酸形成酶JAR1的作用下形成JA-Ile, JA-Ile与它的受体COI1结合, COI1蛋白与SCF泛素E3连接酶形成复合物[11], 此复合物与JAZ蛋白相互作用并被泛素化。然后, JAZ蛋白在26S蛋白酶体的作用下降解, 解除对MYC2转录因子的抑制作用, 从而启动JA响应基因的转录[5, 8, 12, 13]。
JA合成与信号转导链突变体是剖析JA合成与信号转导最有效的工具, 如拟南芥突变体aos、opr3、coi1、jar1等。JA合成基因缺陷的敲除突变体CYP74A (AOS)是运用反向遗传学的筛选方法分离得到的。此酶催化JA合成途径中的氢过氧化物脱水形成一种不稳定的丙二烯氧化物, aos突变体在伤处理1 h后, 内源JA水平没有增加, 而野生型增加了100倍[14]。突变体opr3是从拟南芥生物资源中心的28个雄性不育的T-DNA插入诱变的拟南芥株系中筛选获得的, 该突变体缺乏JA合成所必需的12-氧-植物二烯酸还原酶(OPR3), 而外源施用JA可以恢复它的育性[15]。coi1突变体是在筛选抗冠菌毒素的拟南芥突变体中被鉴定出来的[16], 该突变体雄性不育, 且对JA不敏感[16]。1998年运用图位克隆的方法定位了COI1基因, 该基因编码F-box蛋白[17]。野生型拟南芥幼苗在含有0.1 µ mol L-1的MeJA琼脂培养基中, 根的生长有50%受到抑制, 而MeJA对突变体jar1根伸长的抑制不敏感, 遗传学分析表明该性状是隐性的, 且受单基因控制[18]。玉米JA信号转导方面的研究还鲜有报道, 拟南芥JA合成与信号转导链突变体的筛选方法为本研究的开展提供了良好的借鉴作用。
目前, 在玉米抗虫研究中, 主要是利用转基因技术外源导入Bt杀虫蛋白基因来获得抗虫玉米, 而内源抗虫的研究报道在国内外较少。本研究通过施用外源MeJA, 观察玉米幼苗根的生长抑制情况, 从EMS诱变的玉米突变体库6118份种子中筛选出对MeJA不敏感的突变体, 并对其进行遗传性分析。该突变体材料将为今后研究玉米抗虫分子机理与JA信号转导之间的关系奠定基础。
EMS诱变的玉米郑58突变体库6118份种子[19], 保存于中国农业科学院生物技术研究所。琼脂粉购于北京普博欣生物科技有限责任公司。MS培养基购于美国PhytoTechnology Laboratories公司。植物凝胶购于北京迪朗生化科技有限公司。95%茉莉酸甲酯(MeJA)购于SIGMA-ALORICH公司。24孔细胞培养板购于美国康宁(CORNING)公司。
1.2.1 浸种处理 为了破除种子休眠, 提高发芽率并使发芽时间同步, 首先对6118份玉米突变体库的种子和对照野生型郑58种子进行浸种处理, 将种子依序放入24孔板中, 每孔1份, 每份2粒; 每孔加入无菌水, 盖好盖后, 置4℃冰箱过夜; 12 h后取出并去除孔内的水, 加入1%次氯酸钠溶液, 浸泡种子15 min后, 用无菌水清洗3次, 每孔内加无菌水, 置4℃冰箱过夜。
1.2.2 转盒发芽 方形塑料盒(长18 cm× 宽10 cm× 高4 cm)用75%乙醇除菌后, 加入灭菌蛭石和适量无菌水, 拌匀、铺平、压实, 备用; 去除24孔板内的水, 加入1%多菌灵溶液, 浸泡上述处理过的种子15 min后, 将包被有多菌灵溶液的种子依序转入方形塑料盒内, 依序编号后, 用保鲜膜盖住, 放入暗培养室, 25℃培养3~4 d。
1.2.3 耐受性筛选培养基的配制 该筛选培养基分两层, 上层是0.7%的琼脂, 起固定作用; 下层是1/4 MS + 0.4%植物凝胶(Gelrite) + 终浓度50 µ mol L-1的MeJA。先配制下层培养基, 调pH至5.7~5.8, 121℃灭菌20 min。待培养基冷却至50℃时, 加入MeJA溶液, 初筛浓度为50 µ mol L-1, 验证时的浓度为100 µ mol L-1和200 µ mol L-1, 充分混匀。取80 mL培养基加入无菌组培玻璃管, 室温放置, 待其凝固。将高压灭菌后的0.7%琼脂冷却至50℃, 取50 mL倒入已装有下层培养基的组培玻璃管, 室温放置, 待其凝固后使用。
1.2.4 转管培养 3~4 d后, 将发芽的玉米种子(根长1~2 cm)转至含有MeJA的培养基上培养。用镊子夹取种子, 小心将根尖刺入琼脂中。在玻璃管外, 用记号笔注明转管日期及转管时的根长。将转管后的种子放在光照培养室, 光/暗周期为16 h/ 8 h, 25℃培养20 d。在培养的过程中, 注意观察根的生长抑制情况, 并及时做好记录。
1.2.5 筛选和评价指标 在50 µ mol L-1 MeJA条件下初筛, 观察20 d后玉米根的生长情况, 对照野生型郑58植株的根的生长停留在上层琼脂与下层MS培养基的交界处, 不能超过交界处伸入到下层培养基中, 与对照相比, 若突变体的根伸入下层含有MeJA的MS培养基中, 且根系发达, 幼苗更加粗壮, 则说明突变体对MeJA不敏感或耐受; 若突变体的根的生长受到抑制, 只停留在琼脂层, 根系不发达, 幼苗矮小, 则说明突变体对MeJA敏感或不耐受(表1)。在50 µ mol L-1 MeJA条件下对突变体自交子一代进行遗传分析, 记录20 d后的玉米根伸入MS培养基中的长度, 定量分析评价子一代的遗传性。
| 表1 突变体对50 µ mol L-1 MeJA不敏感或耐受性等级 Table 1 Insensitivity or tolerance grade of the mutants to 50 µ mol L-1 MeJA |
1.2.6 MeJA不敏感突变体的遗传性分析 收获耐受性事件的子一代自交种子, 分别播种于50 µ mol L-1 MeJA和100 µ mol L-1 MeJA培养基及50 µ mol L-1 MeJA 蛭石介质中, 观察根在培养基中的生长抑制情况和在蛭石中的发芽情况。用培养基的筛选方法与初筛相同, 对照为野生型郑58, 并分别在含有MeJA和不含MeJA的MS培养基中生长。在含有MeJA的蛭石中培养方法如下, 先将10 μ L 95% MeJA (w/v)溶于10 mL无水乙醇中, 再用无菌水稀释至1000 mL, 混匀, 使MeJA的终浓度为50 µ mol L-1, 用此MeJA溶液拌蛭石, 最后将子一代种子和野生型郑58种子转到装有蛭石的塑料盒中, 并用保鲜膜包裹住塑料盒, 防止液体挥发。暗培养室25℃放置3~4 d, 观察发芽和根的生长情况。
在进行筛选实验之前, 首先预实验确定最适的MeJA筛选浓度。在浓度梯度实验中, 分别设置5 µ mol L-1、10 µ mol L-1、20 µ mol L-1、50 µ mol L-1、100 µ mol L-1、150 µ mol L-1和200 µ mol L-1的浓度梯度, 结果表明, 随着MeJA浓度的增大, 玉米根的生长受抑制的程度越来越严重, 而观察玉米根系生长情况的最适宜MeJA浓度为50 µ mol L-1。因此, 在初步筛选时, 我们确定筛选压力为终浓度50 µ mol L-1 MeJA。对照为野生型郑58。从6118份突变体中初步筛选获得对MeJA不敏感的I级耐受事件61个(表2, 含表中的a、b和c), 占突变体库总数的0.997%, 说明该EMS突变体库诱变频率相对较高, 适于进行各种突变体的筛选。与对照相比, 它们均表现出根系发达, 根伸入玻璃管底部并继续生长; 幼苗粗壮, 生长速度快, 当对照材料长到第2、第3片叶时, 它们均已长到第5、第6片叶; 吸收培养基中的养分快而多, 对MeJA表现出较强的耐受性。对照植株根的生长停留在上层琼脂与下层培养基的交界处, 主根短小, 侧根较少或不发达; 幼苗矮小, 瘦弱, 生长速度慢, 对MeJA表现出较强的敏感性。如图1所示, t580、t596和t407对MeJA不敏感性非常显著, 耐受等级为I级; 而t575、t587、t595、t388、t406和t424对MeJA表现出较不敏感性, 耐受等级为II级。
| 表2 61个对50 µ mol L-1 MeJA不敏感的I级耐受事件 Table 2 Sixty-one MeJA-insensitive mutants grown in the medium with 50 µ mol L-1 MeJA with tolerance Grade I |
 | 图1 初步筛选获得的部分MeJA不敏感突变体图1为50 µ mol L-1 MeJA条件下, 初步筛选获得的不敏感突变体。WT为野生型郑58, MS培养基中含50 µ mol L-1 MeJA, 作为实验对照。图1-A中的t580和t596对MeJA不敏感性非常显著, 耐受等级为I级, 而t575、t587和t595对MeJA表现出较不敏感性, 耐受等级为II级; 图1-B中的t407对MeJA不敏感性非常显著, 耐受等级为I级, 而t388、t406和t424对MeJA表现出较不敏感性, 耐受等级为II级。Fig. 1 Primary screening of MeJA-insensitive mutantsFig. 1 shows primary screening of MeJA-insensitive mutants grown in the medium with 50 µ mol L-1 MeJA. WT is wild type Zheng 58 as an experimental control, grown in the MS culture medium containing 50 µ mol L-1 MeJA. Fig. 1-A shows t580 and t596 were significantly insensitive to MeJA as Grade I, and t575, t587 and t595 were insensitive to MeJA as Grade II. Fig. 1-B shows t407 was significantly insensitive to MeJA as Grade I, and t388, t406 and t424 were insensitive to MeJA as Grade II. |
为了排除在50 µ mol L-1 MeJA条件下筛选到的61个I级耐受性事件中假阳性的存在和确定这些事件对MeJA的耐受程度, 本研究对61个I级耐受事件进行了进一步验证。分别在MeJA终浓度100 µ mol L-1和200 µ mol L-1条件下进行发芽试验, 20 d后观察结果: 在100 µ mol L-1 MeJA条件下, 61个I级事件中有37个事件的根伸入到含MeJA的培养基中, 即交界面以下1.0~1.5 cm处。与对照相比, 主根粗壮, 侧根较多; 幼苗粗壮, 生长速度快, 对照生长到第3片叶时, 这些事件均已长到第4、第5片叶。表明在MeJA终浓度100 µ mol L-1条件下, 这37个事件耐受性显著(图2-A和表2, 含b和c)。在MeJA终浓度200 µ mol L-1条件下, 这61个I级事件中有10个事件的根伸长到含MeJA的培养基中, 即交界面以下约1 cm处。与对照相比, 主根粗壮, 有较少侧根, 幼苗粗壮, 而对照主根短小, 无侧根, 幼苗瘦弱。表明在MeJA终浓度200 µ mol L-1条件下, 这10个事件仍然表现出一定的耐受性, 但在高浓度的MeJA条件下, 根的生长受到抑制(图2-B和表2, 只含c)。
由于某些突变体存在不育性、畸形、早衰等现象而导致不能结实或过早地死亡, 因此, 本研究筛选到的61个不敏感突变体中只收获了46个事件(其中有19个在表2“ a” , 23个在表2“ b” , 4个在表2 “ c” 中)的自交子一代种子, 为了验证这些子一代玉米的MeJA耐受性是否具有可遗传性以及研究其在MeJA终浓度50 µ mol L-1条件下的发芽情况, 从这46个事件中选取了具有代表性的11个事件进行验证分析。结果表明, 子一代在MeJA分别为50 µ mol L-1和100 µ mol L-1条件下, 仍然对MeJA表现出显著的耐受性, 其中, t596-2在MeJA浓度为50 µ mol L-1条件下, 伸入MS培养基中的长度为2.5 cm, 幼苗粗壮, 根系发达, 耐受程度为I级, 在100 µ mol L-1 MeJA条件下, 也表现出对MeJA的耐受性, 但在高浓度的MeJA条件下, 根的生长受到抑制(图3-A和B)。子一代种子在含有50 µ mol L-1 MeJA的蛭石中第3天发芽, 而对照野生型郑58在第6天才发芽, 且试验组芽长均比对照组长约3 cm (图3-C), 但根的生长抑制情况在发芽初期与对照相似, 没有表现出耐受性, 在转移到管中继续培养20 d后, 根的生长才表现出明显的耐受性。对在50 µ mol L-1和100 µ mol L-1 MeJA条件下玉米根的长度和根伸入MS培养基的长度测量(表3)表明, 在50 µ mol L-1 MeJA条件下, 这些耐受性事件中的根长最长达到14.00 cm, 比对照长7.00 cm, 如h818-1。而根伸入MS培养基中的长度最长能达到2.50 cm, 对照则只停留在交界面以上, 不能伸入MS培养基中, 如t596-2。同时, 在100 µ mol L-1 MeJA条件下, 这些耐受性事件中的根长最长达到13.80 cm, 比对照长7.2 cm, 如h818-1; 根伸入MS培养基中的长度最长能达到1.10 cm, 对照则只停留在交界面以上, 不能伸入MS培养基中, 如t407-1。从根系的生长情况来看, 这些100 µ mol L-1 MeJA条件下的玉米根系与在50 µ mol L-1条件下的情况相似, 均表现出对MeJA不敏感, 但在高浓度的MeJA条件下, 根的生长受到抑制。
 | 图2 部分MeJA不敏感突变体在高浓度MeJA中的验证图2-A为MeJA终浓度100 µ mol L-1条件下的重复验证结果。WT为野生型郑58, MS培养基中含100 µ mol L-1的MeJA, 作为实验对照, 从图2-A中可以看出t331-1、t331-2、t199-1、t199-4均伸入到交界面以下, 表现出对终浓度100 µ mol L-1的MeJA耐受性; 图2-B为MeJA终浓度200 µ mol L-1条件下重复验证结果, WT为野生型郑58, MS培养基中含200 µ mol L-1的MeJA, 作为实验对照。从图2-B中可以看出s054-1、s054-2、s080-2、s087-1、s087-2均伸入到交界面以下, 表现出对终浓度200 µ mol L-1的MeJA耐受性。Fig. 2 Confirmation of MeJA-insensitive mutants in 100 µ mol L-1 and 200 µ mol L-1 MeJA mediaFig. 2-A shows the confirmation of MeJA-insensitive mutants in the condition of 100 µ mol L-1 MeJA. WT is wild type Zheng 58 as a control, grown in the MS culture medium containing 100 µ mol L-1 MeJA. The roots of t331-1, t331-2, t199-1, t199-4 elongated under the border, showing that they were significantly insensitive to 100 µ mol L-1 MeJA. Fig. 2-B shows the confirmation of MeJA-insensitive mutants in the condition of 200 µ mol L-1 MeJA. WT is wild type Zheng 58 as an experimental control, grown in the MS culture medium containing 200 µ mol L-1 MeJA. The roots of s054-1, s054-2, s080-2, s087-1, s087-2 elongated under the border, showing that they were significantly insensitive to 200 µ mol L-1 MeJA. |
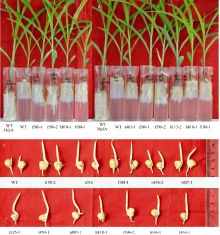 | 图3 MeJA不敏感突变体的遗传性分析图3-A为MeJA终浓度50 µ mol L-1条件下的验证分析结果, WT MeJA-为野生型郑58, MS培养中不含MeJA, WT为野生型郑58, MS培养基中含有50 µ mol L-1 MeJA。从图3-A中可以看出t580-1、t596-2、t332-1、h818-1和f188-1均伸入到交界面以下, 表现出对终浓度50 µ mol L-1的MeJA耐受性; 图3-B为MeJA终浓度100 µ mol L-1条件下验证分析结果, WT MeJA-为野生型郑58, MS培养基中不含MeJA, WT为野生型郑58, MS培养基中含有100 µ mol L-1 MeJA。从图3-B中可以看出t463-1、t580-1、t596-2、h115-2、h818-1和f188-1均伸入到交界面以下, 表现出对终浓度100 µ mol L-1的MeJA耐受性。图3-C为子一代种子在含有MeJA浓度为50 µ mol L-1的蛭石中的发芽情况, WT为野生型郑58, 其他处理与实验组一致, 可以看出t198-2、n516、f188-1、n496-2、t407-1等事件的芽长均比对照长约3 cm, 表明突变体种子在发芽时与对照材料相比未受MeJA抑制。Fig. 3 Heredity analysis of MeJA-insensitive mutantsFig. 3-A shows the confirmation of the insensitive-mutants progeny grown in the condition of 50 µ mol L-1 MeJA. WT MeJA-is wild type Zheng 58, grown in the MS medium without MeJA. WT is wild type Zheng 58, grown in the MS medium containing 50 µ mol L-1 MeJA. Roots of t580-1, t596-2, t332-1, h818-1, and f188-1 elongated under the border, showing that they were significantly insensitive to 50 µ mol L-1 MeJA. Fig. 3-B shows the confirmation in the concentration of 100 µ mol L-1 MeJA. Roots of t463-1, t580-1, t596-2, h115-2, h818-1, and f188-1 elongated under the border, showing that they were significantly insensitive to 100 µ mol L-1 MeJA. Fig. 3-C shows germination of F1 seeds grown in the vermiculite with 50 µ mol L-1 MeJA. WT is wild type Zheng 58, and other processing were consistent with the experimental groups. Buds of t198-2, n516, f188-1, n496-2, t407-1 were approximately 3 cm longer than ones of WT, showing that the seed germination of mutants is not inhibited by MeJA compared with WT. |
| 表3 子一代在50 µ mol L-1 MeJA和100 µ mol L-1 MeJA培养基中20 d后的根长和根伸入MS培养基的长度 Table 3 The root length and the length of root into the MS medium of mutants progeny in the media with 50 µ mol L-1 MeJA and 100 µ mol L-1 MeJA after 20 days (cm) |
本研究在含有50 µ mol L-1 MeJA的培养基上对玉米突变体库中的6118份种子进行了耐受性筛选。筛选获得61个I级耐受事件, 这些突变体主要表现出根系发达, 生长速度快, 对MeJA耐受性显著。当加大筛选浓度到100 µ mol L-1和200 µ mol L-1 MeJA时, 这些事件仍然表现出MeJA的耐受性。但随着MeJA浓度的增加, 这些事件的根在培养基中的长度也相应变短, 幼苗也变得弱小。由此可见, 这些不敏感突变体只在一定的浓度范围内对MeJA表现出耐受性, 而高浓度MeJA对植物生长具有一定的抑制作用, 并且MeJA浓度越高, 对植物的生长抑制越严重[20, 21]。
本研究在筛选方法上做了一些改进, 可以快速、大批量的筛选突变体, 并且提高了种子的发芽率和减少了霉菌的产生。首先是在种子的预处理上, 采用了1%次氯酸钠溶液浸泡处理, 以破除种子休眠和使种子发芽处于一致状态; 其次是用1%多菌灵溶液包被种子, 使种子处在多菌灵的保护下发芽, 减少霉菌污染; 其三是用没有任何营养成分的蛭石作为种子发芽的固定物质, 除去了配制培养基的步骤, 既节省了时间, 也减少了霉菌滋生的机会; 其四是将发芽后的种子转移到含有不同浓度MeJA的MS培养基的玻璃管中继续生长, 可以实时观察根的生长抑制情况, 并且使筛选结果简单明了。该方法适合筛选大型突变体库, 具有方便快捷、重复性好的优点。与已发表的文献相比, 本研究的种子预处理、具体操作步骤和培养基配制均不同[21, 22, 23]。
从理论上讲, 初筛获得的不敏感突变体与对应的子一代应该表现出一致的不敏感性, 但从图1-A和图3-A可以看出, 在50 µ mol L-1 MeJA条件下, t580和t596虽然都表现出MeJA不敏感性, 但深入培养基的长度及根分支数有所不同。究其原因有两点, 第一, 在筛选突变体库时, 由于筛选量大, 只关注根的生长情况, 对筛选结果只做了一个定性的统计, 在获得了初筛突变体后进一步优化培养条件, 在更严格的筛选条件下才进行二轮实验确定; 第二, 培养基添加的MeJA极易挥发, 在子一代材料筛选时, 采取了多种方法减少MeJA的挥发, 所以也保证了MeJA的抑制根的生长能保持长久。因此, 随着实验条件的进一步优化, 筛选结果更加真实、有效, 同时也证明了初筛结果可以很好地反映突变体材料的MeJA的敏感性。
COI1基因是拟南芥茉莉素信号转导链重要的调控基因, COI1 (CORONATINE INSENSITIVE 1)编码一个F-box蛋白并参与形成SCFCOI1 E3泛素连接酶[17, 24], 表明泛素化介导的蛋白质降解途径在JA信号转导途径中起重要作用。COI1蛋白通过作用于茉莉酸信号途径调控病虫害的防御、花粉的发育以及对根的抑制, 其中很多蛋白因子, 如转录因子MYC2、SCF和它的下游活性蛋白AXR1、JAI4/SGT1b和MPK4也参与了COI1和茉莉酸组成的抑制根生长的信号途径[25]。COI1蛋白无功能突变体coil-1几乎丧失了茉莉素所调控的一切反应, 如根的生长对茉莉素不敏感, 茉莉素诱导基因几乎不表达, 对一些病虫害的抗性降低并表现为雄性不育[16]。玉米JA途径突变体的筛选和相关基因的研究也取得了一些研究进展, 例如在2009年Acosta等[26]通过tasselseed1突变体的研究, 克隆了影响JA信号的性别决定基因tasselseed1, 该基因可能与JA的生物合成有关; 2012年Yan等[27]从玉米转座子文库中获得了opr7和opr8突变体, 双突变体表现出叶片延迟衰老, 更易受到甜菜夜蛾的攻击, 揭示了OPR7和OPR8基因参与JA诱导的玉米发育和防御功能。但玉米中与JA途径相关的突变体和基因的研究仍然较少, 在国内更是鲜有报道。本研究筛选获得的玉米MeJA不敏感突变体可能在JA调控及信号感知方面的基因发生碱基突变, 导致相关蛋白功能缺失, 从而表现出根的生长对MeJA不敏感。基于以上研究结果, 在下一步的研究中, 我们将从这些突变体材料出发, 对JA途径相关的基因进行定位和克隆, 并分析这些相关基因在JA途径中的作用。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|


