第一作者联系方式: E-mail: haidu81@aliyun.com, Tel: 18223480008
MYB类转录因子是植物中最大的转录因子基因家族之一, 广泛参与植物生长发育全过程, 对植物次生代谢等具有重要的调控作用。本研究对大豆 GmMYB042基因的表达特性和功能进行了系统研究, 针对该基因C端的保守氨基酸基序(PDLNLELTIS)和锌指结构进行了一系列的序列删除突变, 并将各缺失突变体在烟草中进行了过表达, 以验证目的基因及其特殊基序的功能。表达特性分析结果表明, GmMYB042基因在大豆的根瘤、根、茎、叶、花、荚果皮和种子中均有表达, 且在茎、种子和花中的表达量相对较高; GmMYB042基因在大豆中的表达受PEG、高盐、低温和UV-B辐射的诱导。过表达分析结果表明, GmMYB042基因的过表达使转基因烟草类黄酮代谢途径部分关键酶基因(如 PAL、 CHS和 FLS)的表达量明显上升, 转基因烟草总黄酮的含量明显高于对照; 各缺失突变体的转基因烟草类黄酮代谢途径相应酶基因的表达量发生了相应的变化, 进一步证明目的基因对类黄酮生物合成的调控作用; 各缺失突变体的转基因烟草的叶缘有明显皱褶, 说明目的基因可能还参与调控叶的形态建成。
MYB transcription factor is one of the largest transcription factor gene families in land plants, and is involved in a myriad of regulatory processes, such as secondary metabolism. In the present study, the expression profiles and function of GmMYB042 gene were systematically studied. In order to investigate the roles of the conserved amino acid motif PDLNLELTIS and a predicted zinc finger region at its C-terminal, a series of sequence deletions of these two regions were made by PCR method. Subsequently, the corresponding over-expression constructs of GmMYB042 gene and its mutants were made and transformed into tobacco NC89 with Agrobacterium LBA4404 ,respectively .Expression analyses revealed that GmMYB042gene was expressed in nodule, root, stem, leaf, flower, pod, and seed of soybean, and with a relative higher expression level in stem, flower, and seed; its expression could be induced by PEG, high salt, low temperature, and UV-B radiation stresses. Over-expression analyses showed that the expressions of some enzyme genes in flavonoid biosynthesis pathway (including PAL, CHS, CHI, and FLS) were obviously increased in GmMYB042transgenic lines, resulting in an increased content of the flavonoid compounds. Accordingly, the transcription levels of the corresponding enzyme genes involved in flavonoid biosynthesis pathway were decreased in the transgenic lines of GmMYB042mutants, further supporting the conclusion of regulating role of GmMYB042gene in tobacco flavonoid biosynthesis pathway.
MYB类转录因子以其N端含有的一段保守DNA结合域(DNA-binding domain)为共同特征, 广泛存在于真核生物界, 是植物基因组中最大的转录因子家族之一[1]。MYB结构域一般由1~4个串联的、不完全重复的MYB重复区域(R1、R2和R3)组成。通常根据MYB重复区的数量对该类转录因子分类, 如含有1个重复区或含2个彼此间隔开的MYB重复区的为MYB-related类(1R-MYB), 含有2个串联MYB重复区的为2R-MYB类(R2R3-MYB), 含有3个串联MYB重复区的为3R-MYB类(R1R2R3- MYB), 含有4个串联MYB重复区的则4R-MYB类(R1R2R2R1/2-MYB)[2, 3, 4]。它们共同组成了植物基因组中一个庞大的MYB转录因子基因家族。其中, 2R-MYB类是植物中数量最多、最为典型的MYB类转录因子。MYB转录因子的C端则为其转录激活区(Transcription activation domain), 富含酸性氨基酸, 一般折叠成双亲性的螺旋发挥作用。
首个MYB转录因子基因v-MYB是从引起禽急性成髓细胞白血病病毒AMV和E26 (avian myeloblastosis virus (AMV))中发现的[1]。随后, v-MYB的同源基因, A-MYB、B-MYB和C-MYB在多种脊椎动物中也相继被鉴定, 并被证实参与调控细胞增殖、分化和凋零过程[5]。植物中鉴定的第一个MYB转录因子基因是参与调控玉米花青素生物合成的C1基因[6]。随后在许多植物基因组中陆续发现了大量的MYB基因。例如, 在拟南芥基因组中就有126个2R-MYB基因[7]、大豆基因组中有255个有完整读码框的2R-MYB基因[8]、杨树中则有191个2R-MYB基因[9]等。大量功能研究表明该类转录因子基因广泛参与植物生长发育全过程, 如次生代谢调控、激素和环境因子的应答、细胞分化、形态建成等[10, 11, 12, 13, 14, 15]。
类黄酮广泛分布于植物界, 在许多植物组织, 如根、叶、花和果实中均有大量分布[16, 17]。该类化合物具有多种生物学功能, 如调节植物生长、参与植物抗逆胁迫、作为植物抗毒素和活性氧清除剂等。相关药理和临床实验证实黄酮类化合物具有非常重要的药理功能, 是药用植物的主要活性成分之一, 对人体健康具有非常重要的影响。如抗癌、抗氧化、降低胆固醇、抑制和预防冠心病以及其他老年和妇科疾病等[18, 19]。因此, 类黄酮类化合物一直备受人们的重视, 被认为是一类极富医疗和保健价值的天然物质, 具有广泛的开发前景。类黄酮是植物苯丙烷类代谢途径的一类重要次生代谢产物, 其代谢途径和木质素代谢途径是苯丙烷类代谢途径的两大主要分支。
近年来研究证实2R-MYB转录因子广泛参与植物苯丙烷代谢途径[20, 21, 22, 23], 对类黄酮的生物合成有重要的调控作用[24, 25]。大豆是世界重要的油料作物, 也是类黄酮的重要来源。因此, 克隆和鉴定大豆中调控类黄酮生物合成的MYB转录因子基因、研究它们的调控机理具有重要的学术意义和广阔的应用前景。本研究在前期研究基础上[26, 27], 采用RT-PCR技术进一步分析了GmMYB042 (GmMYBZ2)基因在大豆不同组织和逆境胁迫下(ABA、PEG、NaCl、低温等)的表达模式; 基于PCR技术对该基因C端特殊的保守氨基酸基序(PDLNLELTIS)和锌指结构进行了一系列的序列删除突变, 并将各缺失突变体在烟草中过表达, 以验证它们的功能, 以期能为进一步阐明该基因调控类黄酮生物合成的分子机制提供实验证据。
烟草品种NC89、大肠杆菌(E. coli) DH5α 、农杆菌(Agrobacterium tumefaciens)菌株LBA4404、植物表达载体pCAMBIA2301均由本实验室保存。植物总RNA提取试剂TRNzol购于天根生化科技(北京)有限公司; 反转录试剂盒(PrimeScript 1st Strand cDNA Synthesis Kit)和限制性内切酶购于TaKaRa公司; 质粒提取试剂盒(EasyPure Plasmid MiniPrep Kit)、胶回收试剂盒(EasyPure Quick Gel Extraction Kit), pEASY-T1 Simple载体、普通Taq酶购于北京全式金生物技术有限公司; RQ1 RNase-Free DNase购于美国Promega公司; 实时荧光定量PCR试剂盒(SsoAdvanced Universal超混合液)购自Bio-Rad公司; 大豆苷元(Daidzein)标准品购于中国药品生物制品检定所; ABA、6-BA、NAA等激素购于Sigma公司; 卡那霉素、头孢拉定购于Amersco公司; X-Gluc购于Inalco公司。其他常规生化试剂均为国产分析纯。
高盐和干旱处理是分别将大豆幼苗置含300 mmol L-1 NaCl和10% PEG-8000的B5液体培养基中, 室温下分别于0、6、12、24、48和72 h时取样。低温处理是将大豆幼苗置4℃培养箱中, 分别于0、6、12、24、48和72 h时取样。激素处理是分别将大豆幼苗置含100 μ mol L-1 ABA、100 μ mol L-1 GA3、75 μ mol L-1NAA和75 μ mol L-1 6-BA的B5液体培养基中, 室温下分别于0、1、3、6、12和24 h时取样。液氮速冻所有样品, 于-80℃超低温冰箱保存备用。
1.2.1 qPCR法分析目的基因的组织表达特性
采用TRIzol法分别提取大豆不同组织(根瘤、根、茎、叶、花和未成熟种子)总RNA, 经DNase I处理去除RNA中残留的痕量基因组DNA, 根据TaKaRa公司的反转录试剂盒说明书合成第1链cDNA。使用SsoAdvanced Universal Mix (SYBR Green)试剂盒和Bio-Rad公司的CFX96 Touch荧光定量PCR仪进行Real-time PCR扩增。以反转录获得的cDNA为模板, 以大豆泛素基因Subi-1 (D16248)为内标基因(UBQ-qF: 5° -GACCCTTACGGGTAAGA CTATTAC-3° 和UBQ-qR: 5° -GTCCTTCCATCCTCTA GCTGT-3° ), 以基因特异引物MYB042-qF (5° -GCAA CTGCTGCAACTGTTACA-3° )和MYB042-qR (5° -CA AACCCAAACTGCAAACG-3° ) 进行Real-time PCR扩增。采用两步法反应程序, 95℃ 5 min; 95℃ 15 s, 61℃ 20 s, 40个循环; 绘制熔解曲线。设3 次重复, 取平均值, 采用2-Δ Δ Ct法计算基因在不同样品中的相对表达量。
1.2.2 RT-PCR法分析目的基因在胁迫诱导下的表达特性 同理, 分别提取大豆胁迫和诱导处理材料的总RNA, 并反转录合成第1链cDNA。以反转录获得的cDNA为模板, 预实验确定RT-PCR指数扩增循环数, 以保证在此循环数内PCR产物呈指数增长(28个循环)。以大豆泛素基因Subi-1 (D16248)为内标基因(UBQ-F: 5'-CTCTGACAGGGAAGACCGT AAC-3'和UBQ-R: 5'-GAGACCGTGCATAGCAAGC TA-3')对模板进行均一化处理。以基因特异引物MYB042-F (5'-CGGGGAGAACAGACAATGAAATA AA-3')和MYB042-R (5'-CAAACCCAAACTGCAAA CGAAAC-3') 进行PCR扩增, 检测目的基因在不同组织或胁迫处理下的表达模式。PCR程序为94℃ 5 min; 94℃ 30 s, 57℃ 30 s, 72℃ 30 s, 28个循环; 72℃ 10 min, 琼脂糖凝胶电泳法检测RT-PCR结果。
大豆RNA-Seq表达谱数据来源于共享数据[28]和SoyBase (http://soybase.org/AffyChip/)[29]。
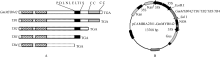
前期我们对GmMYB042基因C端保守的氨基酸基序和锌指结构进行了一系列的序列删除突变[28](图1-A), 此基础上, 本研究分别将目的基因及其突变体序列克隆到植物表达载体pCAMBIA2301上(前引物含有EcoR I酶切位点, 后引物含有SalI酶切位点), 构建相应的植物过表达载体p2301-35S:: GmMYB042, p2301-35S::TB1, p2301-35S::TB2, p2301- 35S::TB3和p2301-35S::TB4 (图1-B)。采用农杆菌LBA4404介导法, 将重组质粒和空载体(对照)分别转入烟草NC89, 利用Kan抗性筛选转基因抗性苗。
挑选生长良好的转基因Kan抗性苗, 剪取少许叶片浸入GUS染液进行组织染色(37℃放置过夜), 以75%乙醇脱色2~3次(以转空质粒和野生型的烟草为对照), Nickon SME 1000体视显微镜观察GUS染色结果。选择GUS染色为阳性的转化植株, 以TRIzol法提取叶片总RNA, 反转录获得的cDNA为模板, 利用基因特异引物(MYB042-F和MYB042-R, 同1.2)通过RT-PCR法检测转化苗。进一步经多代扩繁获得转基因T3代阳性株系, 并对T3代转基因植株和阴性对照(转化空载体)进行表型观察。
1.5.1 标准曲线的建立
大豆苷元标准品和样品以50%甲醇为空白, 在紫外分光光度计上200~700 nm范围内全波段扫描, 以确定标准品的最大吸收波长。精密称取大豆苷元标准品2.0 mg置25 mL容量瓶中, 以50%甲醇溶解定容(浓度为80 μ g mL-1); 制备一系列的标准品溶液(表1), 在最大波长处以50%甲醇为空白测定吸光度值, 以浓度(x)与吸光度(y)进行线性回归, 求得回归方程及相关系数。
| 表1 大豆苷元标准品的制备 Table 1 Preparation of daidzein standards |
1.5.2 样品的提取
植物材料经液氮中充分研磨后称取约0.1 g (3次重复), 按照0.1 g mL-1鲜重甲醇的比例加入预冷的色谱纯甲醇, 密闭、避光、超声波处理15 min, 7100 × g离心10 min, 吸取上清液; 0.45 μ m微孔膜过滤, 密闭, 4℃保存备用。
1.5.3 样品的测定
吸取0.5 mL样品转入15 mL比色管, 加5% NaNO2溶液1 mL, 摇匀, 静置6 min; 加5%的AlCl3溶液1 mL, 摇匀, 静置6 min; 再加4%的NaOH溶液5 mL, 用蒸馏水定容至10 mL, 静置15 min。在波长510 nm处测定吸收值。
分别设计类黄酮代谢途径关键酶基因PAL、C4H、4CL、CHS、CHI、F3H和FLS的特异引物(表2)。提取转基因植株的总RNA, 反转录获得总cDNA, 以烟草Actin基因(X63603)为内标基因, 设计基因特异引物N-Act-F和N-Act-R, 预实验进行模板均一化处理。以PCR法检测相关酶基因在转基因烟草中的表达量(方法同1.2)。
| 表2 烟草类黄酮合成途径关键酶基因的特异引物 Table 2 Primers of key enzyme genes in flavonoid biosynthesis pathway in tobacco |
2.1.1 GmMYB042基因在大豆中的组织表达特性
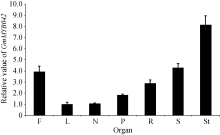
图2表明, 目的基因在大豆的根瘤、根、茎、叶、花、果荚皮和未成熟种子中均表达。其中, 在茎中的表达量最高, 比叶和根瘤中的表达量约高4倍; 在花和种子中的表达量也较高, 在根瘤和叶中的表达量则相对较低。
为进一步验证GmMYB042基因的表达特性, 我们还利用2组公共的大豆RNA-Seq表达谱数据分析了目的基因在大豆不同发育时期和组织中的表达模式。在第1组转录组表达谱数据中(图3), 目的基因在大豆根、茎尖分生组织、荚果皮、花、叶和毛状根中均有表达, 且在花中的表达量最高。此外, 目的基因在毛状根中的表达还受到大豆根瘤菌(Bradyrhizobium japonicum)的诱导(24 h), 说明该基因可能参与调控大豆根瘤的形成过程。
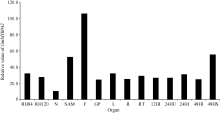 | 图3 GmMYB042基因在大豆RNA-Seq数据组1中的表达模式 RFig. 3 Expression patterns of GmMYB042 gene in soybean in the first RNA-Seq dataset |
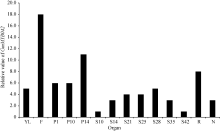
在第2组转录组表达谱数据中(图4), GmMYB042基因在大豆花、根和荚果皮中均有较高的表达量。
 | 图4 GmMYB042基因在大豆RNA-Seq数据组2中的表达分析Fig. 4 Expression profiles of GmMYB042 gene in soybean in the second RNA-Seq dataset |
同理, 目的基因在花中的表达水平明显高于其他组织, 说明该基因可能参与花的发育过程。此外, 目的基因在种子发育14~35 d的表达量比种子发育早期(10 d)和晚期(42 d)高, 暗示该基因可能与种子发育中期相关。
综上所述, qPCR法分析的结果与两组转录组数据的结果一致性较好, 均证明目的基因在大豆花中有较高的表达量。此外, 本研究还证明目的基因在大豆茎中的表达水平相对最高, 暗示目的基因可能还与茎的发育相关。
2.1.2 GmMYB042基因在紫外和红光诱导下的表达谱
如图5所示, 目的基因的表达量随着UV-B辐射处理时间的增加逐渐增高, 在3~6 h达到峰值, 此后又逐渐降低。在受红光诱导时, 则先减小, 后增加, 在12 h达到峰值。证明目的基因参与了植物对这2种光信号的应答反应, 且对UV-B的诱导相对更加敏感。因为类黄酮类化合物在植物中具有抗紫外辐射的作用, 暗示GmMYB042基因可能通过调控类黄酮类物质的合成来抵御紫外辐射对植物的伤害。
2.1.3GmMYB042基因受激素和环境因子胁迫诱导的表达情况
为探究GmMYB042基因受激素诱导的表达情况, 本研究分析了目的基因受ABA、GA3、NAA和6-BA 4种激素诱导的表达模式。结果如图6-A所示, 4种激素处理后目的基因的表达量没有发生明显变化, 说明该基因的表达不受这4种激素的诱导。
 | 图5 GmMYB042基因受UV-B和红光诱导的表达情况 Fig. 5 Expressions of GmMYB042gene induced by UV-B and red-light radiation |
同理, 本研究还分析了目的基因受高盐、低温和PEG诱导的表达情况。结果如图6-B所示, PEG-8000处理后, 目的基因的表达量在24 h最高; NaCl处理后在12 h的表达水平相对最高; 低温胁迫时, 基因的表达水平则在24 h达到峰值。说明该基因的表达受到PEG-8000、NaCl和低温的胁迫诱导。
提取转基因烟草阳性苗T3代叶片的总RNA, 反转录合成第1链cDNA, 分别对类黄酮代谢途径各关键酶基因的表达量进行RT-PCR检测分析(方法同1.2)。结果如图7所示, GmMYB042基因的导入明显提高了转基因烟草中类黄酮生物合成途径PAL、CHS、CHI和FLS酶基因的表达量。相反, 苯丙烷类代谢途径的另一主要支路, 木质素生物合成途径的CAD、CAOMT和OMT酶基因的表达量没有明显的变化。说明目的基因的导入提高了烟草中类黄酮代谢途径酶基因的表达量, 进而促进类黄酮化合物的生物合成。
 | 图6 GmMYB042基因受激素和非生物胁迫诱导的表达情况Fig. 6 Expression patterns of GmMYB042 gene induced by phytohormone and abiotic stresses |
如图7所示, GmMYB042基因各缺失突变体的转基因烟草中类黄酮代谢途径各关键酶基因的表达量则随着其C端序列的缩短而逐渐降低, 而木质素代谢途径相关酶基因的表达量则没有明显变化。进一步验证目的基因对类黄酮代谢途径PAL、CHS、CHI和FLS酶基因的表达有调控作用。
对转GmMYB042基因烟草的4个株系(MYB042- 2、MYB042-5、MYB042-16和MYB042-17)和对照NC89进行总黄酮含量的测定。每个株系测定3个植株, 每株重复测3次。方差分析结果表明处理间差异显著(结果未显示)。进一步利用LSD法进行多重比较分析表明, MYB042-16株系与对照总黄酮的含量差异显著; 其他3个株系虽然与对照差异不显著, 但也有明显提高(表3)。说明转基因植株的总黄酮含量均有提高, 进一步证明目的基因可能参与调控烟草中类黄酮的生物合成。
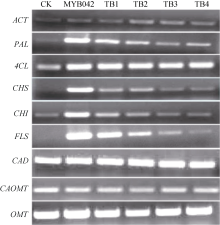 | 图7 GmMYB42基因及其C端缺失突变体的转基因烟草的类黄酮代谢途径酶基因的表达量Fig. 7 Expressions of flavonoid biosynthetic enzyme genes in transgenic tobacco lines ofGmMYB042 gene and its C-terminal mutations |
| 表3 GmMYB042转基因烟草总黄酮含量的多重比较分析 Table 3 Multiple comparison analysis of flavonoids in GmMYB042 transgenic lines |
将转基因烟草阳性苗及对照植株经炼苗后移栽到花盆中种植, 定期观察其表型。结果发现GmMYB042基因及其突变体TB1的转基因植株与对照NC89的表型没有明显差异。但是TB2~TB4突变体的转基因植株的表型与对照NC89有明显的差异(图8-A)。这3个突变体的转基因烟草均表现为节间增长、叶片变小、叶缘有明显的皱褶(图8-B), 暗示目的基因可能还参与叶的形态建成。
MYB转录因子基因在植物基因组数量庞大, 是植物中最大的转录因子家族之一。虽然目前已有很多MYB基因的功能已被证明, 如参与次生代谢调控、激素和环境胁迫的应答、器官发育等[6, 7, 8, 9, 10, 11, 12, 13, 14, 15], 但是这些研究进展主要集中在模式植物拟南芥中。拟南芥是研究基因功能的重要模式植物, 但是农艺性状差, 其研究结果的应用价值有限。相对于拟南芥, 在具有重要农艺性状的农作物中开展相关基因的挖掘和功能研究, 不仅具有重要的理论意义, 还具有重要的应用前景。类黄酮类化合物广泛分布于豆科植物中, 具有非常重要的医疗和保健价值[16, 17, 18, 19]。大豆是人类食物和类黄酮的主要来源, 因此挖掘和研究大豆中调控类黄酮生物合成的MYB转录因子基因、明确其功能, 可以为分子育种提高大豆类黄酮的含量提供重要的基因资源和理论参考。鉴于此, 本研究对从大豆中克隆得到的GmMYB042基因在类黄酮生物合成的调控作用进行了系统的研究。
目前, 绝大多数的MYB转录因子被证实在植物生长发育过程中起转录激活作用, 但也有少数起转录抑制作用。例如, 矮牵牛中的AmMYB308基因抑制C4H、4CL和CAD基因的表达[30], 拟南芥的AtMYB4基因抑制C4H基因的表达[31]等。前期, 我们对MYB基因家族在陆生植物中分子进化机制的系统研究发现, 该类基因属于一个在进化过程保守的S4亚家族。序列分析发现这类基因的C端均有一个保守氨基酸基序pdLNLD/ELXiG/S和一个锌指结构[32], 推测它们可能与该类基因的转录抑制作用有关。GmMYB042基因也属于S4亚家族, 其C端同样含有一个保守的氨基酸基序PDLNLELTIS和锌指结构(图1-A)。鉴于此, 我们前期基于PCR技术对目的基因的这两个结构域进行了序列删除突变(图1-A), 并通过酵母单杂交实验证明了该基序对目的蛋白的转录激活活性具有抑制作用[28]。为了进一步证实该基序的功能, 本研究在模式植物烟草中过表达了目的基因及其相应的缺失突变体序列。结果发现, GmMYB042基因及其突变体的过表达植株中类黄酮合成途径的PAL、CHS、CHI、FLS基因的表达量有明显的变化(图7); GmMYB042转基因植株的总黄酮含量明显高于对照植株。上述研究结果说明GmMYB042基因对类黄酮的生物合成具有正调控作用。因此, 我们推测GmMYB042基因可能是通过抑制苯丙烷类代谢途径中类黄酮代谢途径的竞争性分支(共用同一代谢底物, 如木质素代谢途径)相关酶基因的表达以提高类黄酮合成支路的代谢流量, 进而增加类黄酮的生物合成; 当GmMYB042蛋白因C端缺失PDLNLELTIS基序后, 其抑制作用降低, 代谢能量重新流向类黄酮合成途径的竞争性分支, 进而导致类黄酮代谢途径相关酶基因的表达量随之降低(图7)。以上结果为我们后续深入挖掘GmMYB042基因调控的下游靶基因, 利用定点突变技术研究该基序在目的蛋白抑制其下游靶基因表达的过程中的分子作用机制奠定了理论依据。
此外, 近年来有研究发现植物MYB转录因子广泛参与植物对激素和抗逆胁迫的应答过程[10, 11, 12, 13, 14, 15]。因此, 为了解析GmMYB042基因在大豆抗逆胁迫过程中的作用, 本研究还分析了目的基因在大豆中受激素和环境因子诱导的表达情况。结果证明GmMYB042基因的表达没有明显受到ABA、GA3、BA和NAA的诱导, 说明其不依赖于这4种激素的信号转导途径(图6-A); 但是其表达明显受到PEG、高盐、低温和UV-B辐射的诱导(图5和图6-B), 说明该基因可能参与植物的抗逆胁迫应答过程。本研究结果还表明GmMYB042基因的导入使烟草的叶形发生了明显的变化, 证明目的基因可能还参与调控植株叶的形态建成(图8)。本研究的相关工作主要是在模式植物烟草中完成的, 目的基因在大豆中的功能还有待我们进一步在大豆加以验证和解析。
GmMYB042基因在茎、花等组织中优势表达, 而且其表达受PEG、高盐、低温和UV-B的胁迫诱导, 证明该基因可能参与调控植物对这些环境因子的应答过程。GmMYB042基因及其突变序列的过表达明显影响转基因烟草中类黄酮合成途径酶基因的表达量, 且明显提高了转基因烟草总黄酮的含量, 证明该基因参与调控类黄酮的生物合成; 该基因C端保守氨基酸基序和锌指结构对其功能具有转录抑制作用, 影响其对类黄酮生物合成的调控作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|