第一作者联系方式: E-mail: yueaiqinnd@126.com, Tel: 0354-6289806
小麦 6-SFT是果聚糖合成的关键酶基因。以23份六倍体普通小麦(AABBDD)、5份D基因组材料(DD)为多样性代表群体材料, 通过测序分析小麦 6-SFT-D基因的序列多态性, 根据多态性开发 6-SFT-D基因的功能标记, 分析由154份六倍体普通小麦构成的自然群体的 6-SFT-D基因单倍型(haplotype)与表型性状的关联特性和基因累加效应。在28份多样性代表群体中, 共检测到 6-SFT-D基因的4个多态性位点, 均为单核苷酸多态性(SNP)位点, 构成3种 6-SFT-D基因单倍型; 而在自然群体中只检测到 6-SFT-D的两种单倍型。根据 6-SFT-D基因2850 bp位点的T/C变异开发等位变异特异PCR标记。关联分析表明, 6-SFT-D单倍型分别与灌溉条件下的千粒重和穗长显著关联, 单倍型 HapI是提高千粒重的优异等位变异; 在雨养和灌溉条件下, 同时具有 6-SFT-D与 6-SFT-A2优异等位变异小麦材料的千粒重显著高于其他基因型材料, 说明 6-SFT-D和 6-SFT-A2优异等位变异对于提高千粒重表现累加效应。
Gene 6-SFT encodes a key enzyme in fructan biosynthesis pathway in common wheat ( Triticum aestivum L.). In this study, we analyzed the single nucleotide polymorphism (SNP) on 6-SFT-D locus in a diversity population of 23 hexaploid wheat (AABBDD) accessions and five wheat relative species (DD) by means of direct sequencing. Functional markers were developed according to the sequence polymorphism. The correlation between 6-SFT-D haplotypes and phenotypic traits and the cumulative effect of 6-SFTalleles were analyzed using a natural population consisting of 154 historical wheat accessions. Four SNPs were detected in 6-SFT-D sequences in the diversity population, forming three haplotypes. However, only two 6-SFT-D haplotypes were identified in the natural population. We developed a pair of allele-specific PCR markers based on a polymorphism (T/C) at the 2850 bp site. The results of haplotype-trait association analysis showed that 6-SFT-Dwas significantly associated with thousand-grain weight (TGW) and spike length under well-watered conditions. Hap I was a superior allele in improving TGW. Under drought stress and well-watered conditions, wheat materials carrying both superior allele of 6-SFT-Dand 6-SFT-A2had significantly higher TGW than other genotypes, suggesting that 6-SFT-Dand 6-SFT-A2have cumulative effect on TGW improvement.
果聚糖是小麦茎秆重要的储藏性可溶性碳水化合物(water-soluble carbohydrates, WSC) [1]。小麦茎秆中的WSC含量达到最高值时, 果聚糖含量可占其85%。小麦茎秆中WSC含量有丰富的遗传多样性, 不同小麦材料茎秆中WSC的差异主要是由果聚糖含量造成的[1, 2]。研究表明, 茎秆中WSC与粒重和产量呈正相关[3, 4, 5, 6, 7], 果聚糖也是重要的渗透调节物质[8, 9, 10, 11]。蔗糖:果聚糖6-果糖基转移酶(sucrose-fructan 6-fructosyltransferase, 6-SFT)是小麦果聚糖合成过程中的关键酶之一。研究果聚糖代谢酶基因的多态性, 通过关联分析发掘优异等位变异, 对于提高小麦产量和抗旱性具有重要意义。
关联分析是一种将候选基因的遗传变异与表型性状联系起来的分析方法[12, 13], 是发掘优异等位基因的有效途径。利用该分析方法, 发现小麦Ppd-D1基因的不同单倍型(haplotype)与抽穗期、株高和千粒重呈显著或极显著相关[14], TaGW2-6A单倍型影响粒宽和粒重[15], 小麦TaSus2[16]、TaSAP1-A1[17]和TaSnRK2.10[18]的单倍型也显著影响千粒重等性状。单核苷酸多态性(single nucleotide polymorphism, SNP)广泛而稳定地存在于植物基因组中, 研究发现一些基因的SNP影响基因的功能[14, 15, 16, 17, 18]。本课题组在小麦中检测到6-SFT基因的3个拷贝, 根据其所在基因组分别命名为6-SFT-A1、6-SFT-A2和6-SFT-D, 其中6-SFT-A1和6-SFT-A2的多态性与小麦农艺性状有密切关系[19, 20]; 但是尚未对6-SFT-D基因的多态性及其与农艺性状的相关性开展研究, 另外, 6-SFT-D和6-SFT-A2之间的是否具有累加或互作效应, 尚不清楚。
本研究以23份六倍体小麦和5份粗山羊草为材料, 测序分析小麦6-SFT-D基因的多态性, 并根据测序结果开发基因分子标记。利用新开发的基因分子标记, 在普通小麦自然群体中检测6-SFT-D基因单倍型, 并通过关联分析探讨6-SFT-D多态性与农艺性状的关系, 同时发现了6-SFT-D与6-SFT-A2的累加效应。本研究结果是分子标记辅助聚合优异等位变异的重要依据, 为利用和改良小麦品种果聚糖代谢途径相关基因以提高千粒重提供研究思路。
本研究构建的自然群体由154份不同年代育成的普通小麦品种(系)组成。利用83对SSR标记对其进行群体遗传结构分析, 将154份材料分为4个亚群[21]。从各亚群中挑选典型的多样性材料23份, 与5份粗山羊草(Aegilops tauschii, DD)材料组成多样性代表群体, 用于直接测序, 检测目标基因的序列多态性。此外, 还利用了1份乌拉尔图小麦(Triticum urartu, AA)、1份拟斯卑尔脱山羊草(Aegilops speltoides, SS)和1份四倍体小麦(Triticum polonicum, AABB)材料。所有试验材料均由中国农业科学院作物科学研究所提供。
用Primer Premier 5软件, 参照NCBI公布的6-SFT序列(FJ228688), 设计通用引物F1/R1 (F1: 5′ -TACC AAACTCTCTTAGAGTTCACGAGGG-3′ ; R1: 5′ -CA CGAGTCCACTCTCCCAAACAACAATA-3′ )。根据6-SFT在A、B、D基因组的序列差异, 设计6-SFT-D特异引物F2/R2 (F2: 5′ -TACCAAACTCTCTTAGAGT TCACGAGGG-3′ ; R2: 5′ -CCAAACTATATCGATCCT ACA-3′ )。扩增产物在2850 bp位点存在一个核苷酸变异(T→ C), 据此开发等位变异特异PCR (allele-specific PCR, AS-PCR)引物F3/R3 (F3: 5'-CATACCAGCTTCT GCCAAGGT-3′ ; R3: 5′ -CCAAACTATATCGATCCTAC A-3′ )。为避免假阴性, 设计了在所有材料均能扩增出目标产物的引物F4/R4 (F4: 5′ -GCGCACAACCAGCT CTCC-3′ ; R4: 5′ -GCAGACCACACCGGTTCAC-3′ )。另外, 还设计了4条叠套测序引物SeqF1 (5′ -GTGCAGA TCCCAACGG-3′ )、SeqF2 (5′ -GTCACCTACCGCTCG C-3′ )、SeqF3 (5′ -TCAAGGAGAGCAGCGAC-3′ )和SeqR1 (5′ -AACTCATCGTGGCAGAAG-3′ )。
以供试材料基因组DNA为模板, PCR体系总体积为15 μ L, 含2.1 μ L DNA模板(20 ng μ L-1)、3.0 μ L 5× buffer、引物各0.3 μ L (10 μ mol L-1)、0.1 μ L dNTP (10 μ mol L-1)、0.3 μ LTransStart FastPfu (5 U)和8.9 μ L ddH2O。PCR程序为95℃ 5 min; 95℃ 1 min, 59℃ 45 s, 72℃ 3.5 min, 32次循环; 72℃ 10 min, 15℃保存。在1.2%琼脂糖凝胶中检测扩增产物, 回收目标片段, 利用6条叠套引物(F2、R2、SeqF1、SeqF2、SeqF3和SeqR1)在ABI 3730XL基因分析仪(Applied Biosystems, 美国)上直接测序, 3次重复。
用DNAStar软件分析6-SFT-D序列的SNP, 利用DnaSP5.10软件分析6-SFT-D基因多态性位点及单倍型, 并计算遗传多态性指数π 值。
2007— 2010年, 种植154份小麦材料于中国农业科学院作物科学研究所昌平试验基地, 设雨养和灌溉两种处理。每小区4行, 行长2.0 m, 行距0.3 m, 每行点播40粒种子。小麦收获时, 从每份材料随机取5株调查千粒重和穗长。
2010年小麦籽粒灌浆至成熟期间, 分6次取穗样, 每份材料随机取5株。前5次在灌浆期内, 取样日依次是5月20日、5月26日、6月2日、6月7日和6月11日, 样品烘干脱粒后称重, 计算千粒重; 最后一次取样在6月中旬(收获期), 其中雨养条件下为6月14日, 灌溉条件下为6月18日, 考种后计算千粒重。
利用AS-PCR标记检测自然群体材料的6-SFT-D基因单倍型。以个体Q值作为协变量, 用TASSEL软件[22]进行群体结构分析, 将6-SFT-D的单倍型和表型性状数据进行关联分析。用SPSS13统计软件计算不同单倍型的农艺性状值。
利用6-SFT全长引物F1/R1在4份不同倍性材料中扩增到基因的全长DNA序列, 二倍体野生近缘种和六倍体小麦序列比对结果如图1。在六倍体小麦中分离到3种6-SFT序列, 其中AABBDD-3序列与粗山羊草(DD)的序列相似度达到99%, 因此推测AABBDD-3序列来自于六倍体小麦的D基因组, 命名为6-SFT-D。利用6-SFT-D基因组特异引物F2/R2获得6-SFT-D序列(图1)。引物F2/R2在4份二倍体小麦、1份四倍体小麦和5份六倍体小麦中的扩增结果证实, 6-SFT-D序列位于D基因组(图2)。
 | 图1 六倍体小麦(旱选10号)及其近缘种6-SFT的序列比对Fig. 1 Sequence alignment of 6-SFT in hexaploid wheat (cv. Hanxuan 10) and its wild relative species |
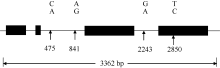
利用F2/R2扩增出的目标片段长度为3362 bp, 包括4个外显子、3个内含子及5′ 和3′ -UTR (图3)。外显子区域依次位于30~323、464~472、1126~1986和2487~3188 bp, 第2外显子与6-SFT-A1、6-SFT-A2序列[19, 20]相同, 均为5′ -ATCCCAACG-3′ ; 3个内含子分别位于324~463、473~1125和1987~2486 bp区段; 此外, 1~29 bp为5′ -UTR, 3189~3362 bp为3′ -UTR。
对23份六倍体小麦材料(AABBDD)与5份粗山羊草(DD)组成的多样性代表群体进行6-SFT-D全长测序, 分析其序列多态性。在扩增片段为3362 bp的6-SFT-D序列中共检测到4个多态性位点, 均为SNP位点, 没有InDel (图3), 其中3个SNP位于非编码区, 1个位于编码区, 平均每841 bp有一个SNP位点。这4个SNP位点包括3个转换(A↔ G、C↔ T)和1个颠换(A↔ C), 转换是主要碱基突变类型。与4A染色体上的6-SFT-A1和6-SFT-A2[19, 20]相比, 6-SFT-D的变异频率(1SNP/841 bp)显著小于6-SFT-A1(1SNP/234 bp)和6-SFT-A2(1SNP/242 bp), 进一步证明小麦的D基因组比较保守。6-SFT-D在二倍体小麦中的变异频率(1SNP/841 bp)大于在六倍体小麦(1SNP/3362 bp)中, 可能是六倍体小麦长期经受人工选择的缘故。
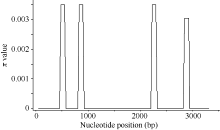
在28份材料中, 6-SFT-D的序列多样性呈现不均匀分布, 共检测出的4个SNP位点中, 其中3个位于内含子, 分别位于内含子2和3 (图4)。在外显子4检测到1个SNP, 并且属于同义突变。在6-SFT-D基因序列外显子1、2、3和内含子1中没有发现SNP。6-SFT-D基因全长的π 值为0.0004, 其π 值显著小于6-SFT-A1和6-SFT-A2基因的π 值0.00273和0.00218。
在28份材料中, 6-SFT-D序列聚类为3种单倍型, 分别是HapI、HapII和HapIII (图5), 分别对应SNP组合C/A/G/C、C/A/G/T和A/G/A/C (表1)。Hap II与Hap I之间有1个SNP位点存在差异, HapIII与HapI之间有3个SNP位点存在差异, HapII和HapIII之间有4个SNP位点存在差异。
23份六倍体小麦材料中, 仅Opata为HapIII基因型, 与5份二倍体材料聚在一类, 其他22份分为两种单倍型(图5)。其中, HapI基因型17份, 包括偃展1号、豫麦18、小齐麦、PANDAS、鲁麦14、晋麦47、旱选10号、大荔1号、春04 9th-5-1、中国春、长武131、长6878、北京8686、北京10号、白齐麦、白糙麦和安85中124-1; HapII基因型5份, 包括红和尚、W7984、沧州小麦、昌乐5号和霸王鞭。由于HapIII基因型六倍体小麦仅有1份, 因此本文仅分析HapI和HapII与农艺性状的关联情况。
为了区分6-SFT-D基因HapI与HapII, 根据2850 bp位点T/C变异设计AS-PCR引物F3/R3 (图6-A)。等位特异引物的正向引物F3根据2850 bp位点的T/C变异设计, 并依据引物错配原理在3′ 端第2位引入与A强错配的碱基G; 反向引物R3与6-SFT-D基因组特异引物R2相同。当2850 bp位点为T时扩增出500 bp左右的条带, 为C时无扩增条带。当等位基因特异PCR引物扩增结果是无带时, 则很难确定是PCR扩增确实没有目标带还是其他原因导致的检测不到扩增产物。为了增加实验的可靠性, 在此反应体系中加入了另一对引物F4/R4, 此对引物在所有的材料中都可检测到扩增产物。本试验中, 当2850 bp位点为T时扩增出两条带, 为C时扩增一条带(图6-B)。
| 表1 6-SFT-D序列的多态性位点 Table 1 Single nucleotide mutation in 6-SFT-D sequence |
2.6.1 6-SFT-D不同单倍型与千粒重的关联分析
用AS-PCR标记扫描自然群体, 分子标记与农艺性状的关联分析表明, 2009年和2010年在灌溉条件下6-SFT-D基因两种单倍型HapI和HapII与千粒重显著相关, 基因型HapI较HapII的千粒重平均值分别高2.13 g和2.84 g。因此, HapI为灌溉条件下影响小麦千粒重的优异单倍型(表2)。
| 表2 灌溉条件下6-SFT-D两种单倍型与小麦千粒重和穗长的关联分析 Table 2 Association analysis between 6-SFT-D haplotype and TGW in wheat under well-watered condition |
2.6.2 6-SFT-D两种单倍型千粒重的积累
在灌浆进程的不同时期取样表明, 在灌浆初期(5月26日) HapI基因型的千粒重与HapII的千粒重差异不显著, 灌浆后期(6月2日至11日) HapI的千粒重均高于HapII (图7)。因此认为, HapI的品种灌浆速率比HapII的品种快, 使小麦籽粒成熟后HapI的小麦品种的千粒重显著高于HapII小麦品种。
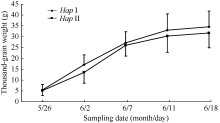 | 图7 灌浆期6-SFT-D两种单倍型材料的千粒重增长情况(2010年)Fig. 7 Thousand-grain weight of two 6-SFT-D haplotypes during grain filling period in 2010 |
2.6.3 6-SFT-D两种单倍型与穗长的关联分析
两年分析结果表明, 在灌溉条件下6-SFT-D两种单倍型与穗长显著相关, HapI基因型的穗长较大, 2009年和2010年分别比HapII基因型高0.37 cm和0.42 cm (表2)。
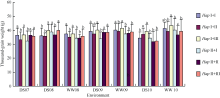
普通小麦中, 6-SFT-D基因分为两种单倍型, 其中HapI为高千粒重的优异等位变异。小麦的6-SFT- A2基因分为3种单倍型, 与千粒重显著相关, 其中HapIII为6-SFT-A2的高千粒重优异等位变异[20]。2007— 2010年连续4年分析6-SFT-D和6-SFT-A2不同单倍型组合基因型在雨养和灌溉条件下的表型性状, 发现同时含有基因优异等位变异HapI+III的小麦材料的千粒重平均值显著高于其他材料(图8); 而不带6-SFT-D与6-SFT-A2任何一个优异等位变异的HapII+I小麦材料, 其千粒重平均值低。如在2010年灌溉条件下, HapI+III小麦材料的千粒重平均值高达43.2 g, 含有任何一个基因优异等位变异小麦材料的千粒重平均值为39.3~41.1 g, 而没有优异等位变异的HapII+I和HapII+II基因型, 其千粒重平均值仅为39.2 g和36.6 g, 说明6-SFT-D和6-SFT-A2两个基因对千粒重的效应存在一定的累加作用。
6-SFT是小麦果聚糖合成过程中的关键酶基因, 在普通六倍体小麦中具有多个拷贝[20]。6-SFT-A1、6-SFT-A2和6-SFT-D是6-SFT在普通小麦中的不同拷贝。本课题组前期研究结果表明, 在小麦6-SFT-A1的3269 bp中有13个SNP和1个InDel, 频率为/1个SNP/251 bp和1个InDel/3269 bp [19]。小麦6-SFT-A2的3149 bp序列中共检测到11个SNP和2个InDel, 在所检测区域1个SNP/242 bp, 1个InDel/1333 bp [20]。本研究在六倍体小麦材料中发现6-SFT-D的3362 bp序列中仅有1个SNP, 没有InDel, 这与基因的基因组来源有关, 进一步研究证明普通小麦的3个基因组中, D基因组在进化上是最保守的[23]。
千粒重是小麦重要的产量构成因素。寻找影响千粒重优异等位变异并开发功能标记, 是开展小麦分子标记辅助选择育种、分子设计育种和转基因育种的前提。近年来研究表明开花期茎秆中WSC含量与粒重和籽粒产量均呈极显著正相关, 因此认为在茎秆中高WSC含量是改良千粒重和产量的重要性状之一[4, 24, 25, 26, 27]。本研究结果表明小麦果聚糖合成酶基因6-SFT-D影响小麦在灌溉条件下的千粒重, HapI为灌溉条件下影响小麦千粒重的优异单倍型, 为分子标记辅助选择育种奠定基础。
基于单核苷酸多态性在关联分析中的成功应用, 初步证明这是一种发掘优异等位基因的有效途径。目前关联分析策略主要集中于分析单个位点或单个基因与性状的关系, 仅能发现一部分单独效应显著的SNP位点。然而, 作物的许多重要性状都是由多个基因控制的数量性状, 控制同一性状的基因之间往往存在累加效应或联合效应。因此研究多个基因间的累加效应已经成为深入解析数量性状分子遗传机制的重要手段之一[28]。本研究发现, 不带有6-SFT-D和6-SFT-A2基因任何一个优异等位变异的小麦材料千粒重显著较低, 而同时含有两个基因优异等位变异组合(HapI+III)的小麦材料, 其千粒重显著高于其他变异组合的材料, 说明6-SFT-D和6-SFT-A2两个基因存在一定的累加效应。本文研究了小麦果聚糖合成过程中6-SFT基因2个成员之间的累加效应, 但是小麦千粒重是由多基因控制的数量性状, 目前有许多研究通过关联分析策略解析与千粒重相关的单个基因[14, 15, 16, 17, 18, 20], 进一步系统研究这些影响千粒重基因的不同组合方式对千粒重的影响, 对于聚合最优等位变异提高小麦千粒重将具有重要的指导意义。
在小麦材料中检测到6-SFT-D基因的4个SNP位点, 分为2种单倍型。根据6-SFT-D基因2850 bp位点的核苷酸变异T/C开发了AS-PCR标记。在灌溉条件下, 6-SFT-D单倍型分别与千粒重和穗长显著关联, 其中HapI是提高千粒重的优异单倍型。在雨养和灌溉条件下, 同时含有6-SFT-D与6-SFT-A2优异等位变异的小麦材料千粒重平均值显著高于其他材料, 说明6-SFT-D与6-SFT-A2的优异等位变异对于提高小麦千粒重具有累加效应。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|