第一作者联系方式: E-mail: zhoushenghui826@gmail.com
小麦苗期性状能够指示品种的耐盐性。本研究以小麦骨干亲本燕大1817与品系北农6号衍生的230个重组自交系为材料, 利用2013年3个不同时间的水培试验数据和已经构建的SSR和SNP高密度遗传连锁图谱分别对正常和盐胁迫条件下根数和最长根长等7个苗期性状进行QTL定位。利用完备复合区间作图法(ICIM)共检测到69个加性效应QTL (LOD≥2.5), 分布于除1A染色体外的所有20条染色体上, 单个QTL解释的表型变异率为2.70%~19.00%。有46个QTL的增效效应来自于燕大1817, 有23个QTL的增效效应来自于北农6号。有12个QTL能够在3个或3个以上的环境中被检测到, 在燕大1817中定位到稳定的多分蘖主效QTL QTn.cau-7BS.1和盐胁迫条件下特异表达的根数QTL QRn.cau-2A, 解析了小麦骨干亲本燕大1817的繁茂性和抗逆性遗传基础, 为解析小麦品种耐盐遗传机制和耐盐性的分子标记辅助选择提供了重要信息。
Seedling traits are known to be important indicators of salt tolerance in wheat ( Triticum aestivum L.). Quantitative trait loci (QTLs) mapping for wheat seedling traits under salt stress and normal hydroponics conditions were conducted at three times during 2013 using a set of 230 recombinant inbred lines (RILs) derived from a cross of Yanda 1817 × Beinong 6 and an available high-density integrated SSR and SNP genetic linkage map. A total of 69 putative QTLs associated with seven seedling traits were detected on 20 chromosomes except for 1A by inclusive composite interval mapping (ICIM) at LOD ≥ 2.5. A single QTL explained 2.70-19.00% of the phenotypic variation. Of which, 46 QTLs showed additive effects originated from Yanda 1817, whereas 23 QTLs showed additive effects derived from Beinong 6, indicating that the founder parent Yanda 1817 is an important genetic resource for salt tolerance in wheat. Twelve QTLs are considered to be stable QTLs because they were detected in at least three environments, including the major QTL QTn.cau-7BS.1 for tiller number and the salt-induced QTL QRn.cau-2A for root number, both originating from Yanda 1817. These results may explain the genetic bases of luxuriant growing habit and stress tolerance of Yanda 1817.
土壤盐渍化是最主要的非生物胁迫, 在全世界范围内威胁粮食生产和食品安全。盐胁迫不但阻碍植物对水分的吸收, 而且降低植物吸收营养物质的能力[1, 2]。在小麦生产中, 盐害主要表现为抑制植株营养生长和生殖发育过程, 从而降低籽粒产量[3]。除改良土壤外, 解析小麦耐盐性的遗传机制, 培育耐盐性小麦品种是抵御盐胁迫的有效途径。
植物耐盐性是同时受多基因和环境影响的复杂数量性状[4], 利用分子标记辅助选择(MAS)技术能够有效挖掘和利用耐盐遗传位点, 改善小麦的耐盐性[5]。小麦苗期性状可以很好地指示其耐盐性, 并且已有许多定位小麦苗期耐盐性QTL的研究。武玉清等[6]以小麦敏盐品种太空6号和耐盐品种德抗961杂交形成的F2和F2:3家系为试验材料, 利用复合区间法定位到位于5A、5B和5D染色体上的6个耐盐QTL, 与4个小麦苗期性状相关。任永哲等[7]利用小偃54× 京411的重组自交系群体, 在盐胁迫条件下共检测到25个调控小麦苗期性状的QTL, 贡献率在4.4%~25.5%。Garcia-Suarez等[8]使用114家系组成的小麦重组自交系群体, 分别在正常和盐胁迫水培条件下鉴定了3个和10个与苗期性状相关的QTL, 这些QTL主要分布在2B和1A染色体上。Xu等[9]利用由131个株系组成的重组自交系群体, 在正常和盐胁迫条件下检测到18个与小麦苗期性状相关的加性效应QTL。Genc等[10]利用小麦DH群体, 共鉴定出与7个苗期性状相关的40个QTL。
小麦苗期耐盐性状的QTL定位报道较多, 但多数是在一种环境条件下研究的, 因此其QTL的可靠性需要进一步验证。本研究在2013年的3个不同时期, 分别在正常和盐胁迫水培的条件下, 对以燕大1817和北农6号组配得到的重组自交系群体的7个苗期性状进行表型鉴定和QTL定位, 旨在发掘稳定调控小麦耐盐性的QTL, 为分子标记辅助选择育种提供分子标记或遗传位点。
将小麦燕大1817 (母本)和北农6号(父本)杂交, 后代经单粒传法得到230个F10或F11重组自交系(RIL)群体。燕大1817是我国小麦骨干亲本之一, 由原燕京大学作物改进场从山西省地方品种平遥小白麦系选而成, 以抗逆性著称, 具有耐旱、耐瘠、抗寒、分蘖力强等优良特性。北农6号是北京农学院在20世纪90年代培育的高产小麦品系。基于此群体, 本实验室已经构建了包含2431个SNP和128个SSR标记的高密度遗传连锁图谱[11]。
分别于2013年3月14日至4月9日(T1)、4月22日至5月19日(T2)和9月25日至10月26日(T3), 在中国农业大学温室对燕大1817、北农6号及其230个RIL株系进行水培试验, 设正常和盐胁迫处理, 共6个试验环境(时间和处理的组合)。水培桶由直径15 cm、高25 cm的不透明PV管制作而成, 每个桶盖上留有5个直径为3 cm的小孔。
小麦种子经10% H2O2水溶液浸泡5 min用无菌水冲洗干净, 置铺有发芽纸的培养皿中发芽5 d; 从每个株系挑选10株长势一致的幼苗, 用海绵固定在水培桶盖的小孔内, 桶中加满Hoagland营养液。每个株系培养两桶, 一桶为正常水培, 另一桶加入NaCl进行盐胁迫处理, NaCl浓度第1周为50 mmol L-1, 第2周为100 mmol L-1, 第3周到幼苗收获为200 mmol L-1。向培养液中不间断充气, 并且每周更新一次, 其pH值保持在6.0至6.2之间。
试验采用随机区组设计。取样后, 每个小麦苗的根和叶分别经无菌水冲洗并擦拭干净用于性状调查。调查性状包括苗高、分蘖数、最大根长、根数、地上部鲜重、根鲜重和总鲜重。利用Microsoft Excel 2010和SPSS 20.0软件统计分析数据, 利用SAS 9.3软件分析各性状的广义遗传力(h2), 遗传模型为h2 = VG/VP。
利用IciMapping 4.0软件的双亲群体中QTL定位功能(QTL mapping in biparental populations, BIP), 基于逐步回归的完备复合区间作图法[12](inclusive composite interval mapping, ICIM)进行加性效应QTL定位, 步移速度为1.0 cM, P临界值为0.001, QTL统计检验的阈值为LOD=2.5。
在正常和盐胁迫条件下, 两亲本间苗期生长差异明显(图1-A), RIL群体表型出现分离(图1-B)。燕大1817苗高、分蘖数、最大根长和根数4个性状的表型值在两种水培条件下都明显高于北农6号(表1)。从偏度和峰度值看, 大部分性状在多数环境下都呈现典型的正态分布, 而且群体中各性状在所有的环境下都存在明显的双向超亲分离现象, 表明为多基因控制的数量性状, 适合进行QTL定位。多数性状的广义遗传力中等或中等以下, 表明其受环境影响较大。
| 表1 燕大1817/北农6号RIL群体在不同环境下苗期性状的变异 Table 1 Variations of seedling traits in the Yanda 1817/Beinong 6 RIL population in different environments |
不论在正常还是盐胁迫处理下, 苗高、根数和生物量相关性状(地上部鲜重、根鲜重和总鲜重)两两之间有极显著的正相关性; 分蘖数与生物量相关性状都显著正相关; 最大根长与根鲜重显著正相关, 但与盐胁迫条件下的根数呈极显著负相关。3个不同观测时间的结果呈现相似的相关性(表2)。
| 表2 RIL群体各性状在不同环境中的相关系数 Table 2 Correlation coefficients of trait pairs in the RIL population in different environments |
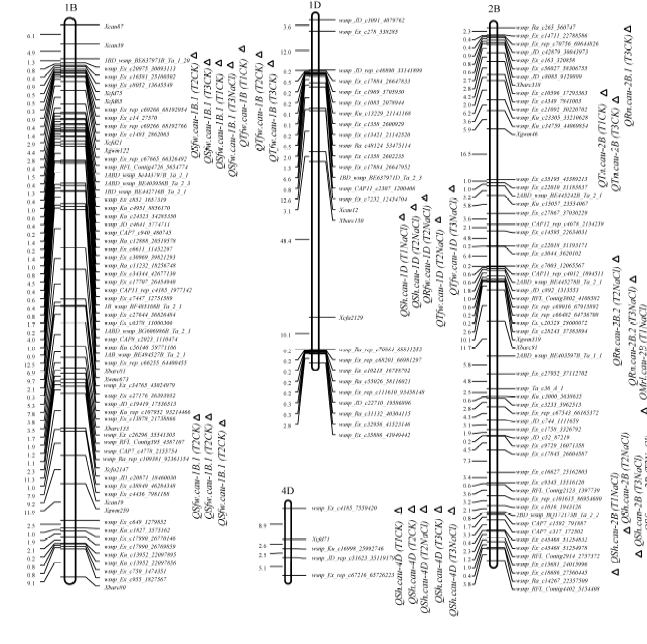
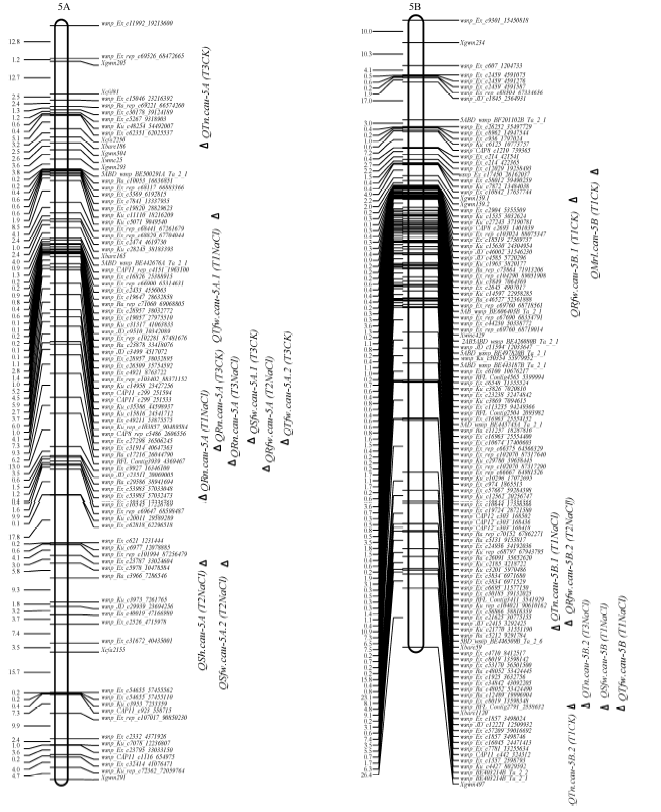
在6个不同的环境中总共检测到69个与小麦7个苗期性状相关的QTL, 分布在除1A外的所有20条染色体上(表3和图2), 其中有12个QTL在3个及3个以上环境中同时被检测到, 表明这些位点是相当稳定的QTL。单个QTL可解释2.70%~19.00%的表型变异, 最高LOD值为11.20。此外, 有46个QTL的增效效应来自骨干亲本燕大1817, 有23个QTL的增效效应来自品系北农6号。下面仅介绍稳定主效QTL。
| 表3 燕大1817/北农6号RIL群体苗期性状的QTL Table 3 QTLs for wheat seedling traits detected in the Yanda 1817/Beinong 6 RIL population |
共检测到11个控制苗高的QTL, 位于1D、2A、2B、4D、5A、6B、6D、7A和7B染色体上, 解释表型变异率2.98%~12.72%。有3个QTL在3个或3个以上环境中被检测到, 其中QSh.cau-4D在5个环境中被检测到, 其增加苗高的等位效应来自燕大1817; QSh.cau-2B和QSh.cau-7BS在所有盐胁迫条件下被检测到, 为盐胁迫条件下特异表达的QTL, 两者增加苗高的等位效应同样来自燕大1817。
共检测到13个控制分蘖数的QTL, 分别位于2B、2D、3B、4AL、4B、5A、5B、7A、7B和7D染色体上, 表型变异解释率为2.70%~19.00%。其中QTn.cau-7BS.1为稳定的主效QTL, 在所有环境中均被检测到, 解释5.31%~19.00%的表型变异, 其增效效应来自燕大1817。
共检测到10个控制最大根长的QTL, 分别位于2A、2B、3D、4A、5B、5D、6A、7A和7BS染色体上, 单个QTL解释3.17%~10.18%的表型变异。其中, QMrl.cau-2A、QMrl.cau-4AS、QMrl.cau-7A.2和QMrl.cau-7BS能够在两种正常水培条件下被检测到。
有6个控制根数的QTL被检测到, 分别位于染色体2A、2B、3A、5A和6B上, 单个QTL解释2.79%~9.96%的表型变异率。其中QRn.cau-2A是盐胁迫条件下特异表达的QTL, 在所有盐胁迫条件下均被检测到, 其增效效应来自于燕大1817; QRn.cau-5A在3种不同环境下被检测到, 其增效效应来自北农6号。
检测到12个显著控制地上部鲜重的QTL, 分别位于1B、2A、2B、3B、5A、5B、6B和7B染色体上, 单个QTL解释3.15%~12.48%的表型变异。其中, QSfw.cau-1B.1在4个环境(3个正常水培和1个盐胁迫)中被检测到, 其增效效应也来自燕大1817; QSfw.cau-1B.2和QSfw.cau-6B.1在3个不同环境中被检测到, 增效效应都来自北农6号。
有8个显著控制根鲜重的QTL被检测到, 分别位于1D、2A、3B、5A、5B和7B染色体上, 单个QTL解释3.67%~13.14%的表型变异。其中QRfw.cau-7BS在3个、QRfw.cau-7BL在2个盐胁迫条件下被检测到, 表明两者为盐胁迫条件下特异表达QTL, 其增效效应分别来自北农6号和燕大1817。
共检测到9个控制总鲜重的QTL, 分别位于1D、1B、2A、2B、5A、5B、6B和7B染色体上, 单个QTL解释4.46%~11.87%的表型变异。其中, QTfw.cau-1B在所有正常水培条件下均被检测到, 其增效效应来自于燕大1817; 另外QTfw.cau-6B能够在3个不同的环境条件下被检测到, 其增效效应来自北农6号。
植物的耐盐性是受多基因控制和环境影响的数量性状, 其遗传与调控机制非常复杂[4, 17, 18, 19], 其中SOS途径、水杨酸途径和脱毒反应系统等参与了植物对盐分的感知和抗性[20, 21]。用来评价品种耐盐性的鉴定指标多种多样, 如海水胁迫下小麦发芽率和芽长[22]、植株的K+/Na+比例[23, 24]。本研究观测了小麦正常水培和盐胁迫条件下的7个苗期性状, 发现大部分苗期性状在RIL群体中呈现标准的正态分布(偏度和峰度值的绝对值小于1), 多数性状表现连续变异, 并有明显的超亲分离现象。这进一步说明小麦品种对盐胁迫的响应受多个遗传位点控制, 利用全基因组高密度遗传连锁图谱可以定位与盐胁迫抗性相关的基因/QTL。在7个苗期性状中, 有5个性状在盐胁迫条件下的遗传力小于对照条件下的遗传力, 表明在盐胁迫条件下, 这些性状受环境条件的影响更大。本研究鉴定出少数稳定表达的耐盐主效QTL, 可进一步进行遗传剖析和精细定位, 并在分子育种中加以利用; 而更多位点只在单一环境中被检测到, 且多数为微效QTL, 也为耐盐性的遗传解析提出了挑战。
小麦苗期耐盐性状相关QTL的定位多数是在一种环境条件下进行正常或盐胁迫处理[9, 16, 25]。本研究利用正常和盐胁迫水培条件, 在2013年的3个不同时间段重复实验, 评价同一群体的苗期耐盐性, 不但对发现的耐盐性QTL的真实性进行了验证, 而且还可以判断这些QTL是否为正常或盐胁迫条件下具有特异调控作用的位点。在玉米[26]和水稻[27]上也曾报道过不同环境条件下的特异表达QTL。我们把在多个环境下检测到的QTL分为3类, 第1类是在正常水培和盐胁迫条件下均表达的QTL, 例如与苗高相关的QSh.cau-4D和与分蘖数相关的QTn.cau-7BS.1, 它们分别在5个和6个环境中被检测到, 说明其可能是与生长发育相关的稳定表达QTL, 对盐胁迫的响应比较迟钝, 应予以重点关注; 第2类是只在盐胁迫条件下表达的QTL, 包括与苗高相关的QSh.cau-2B和QSh.cau-7BS、与根数相关的QRn.cau-2A及与根鲜重相关的QRfw.cau-7BS, 这些位点与盐胁迫抗性有关, 值得深入研究; 第3类是只在正常水培条件下表达的QTL, 如与总鲜重相关的QTfw.cau-1B, 可能是对盐胁迫敏感的位点。本研究检测到的上述QTL在不同的环境条件下对苗期盐胁迫具有不同的反应, 提示在小麦耐盐性育种中应考虑不同性状或土壤条件的实际情况, 选择更适宜的分子标记用于辅助育种。
(图2)

(图2)
(图2)
本研究将控制苗高的一个主效位点QSh.cau-4D定位在4D染色体短臂的末端, 该位点也同时控制燕大1817× 北农6号RIL群体成熟期株高(未发表), 表明其对株高的影响在苗期就已经发挥作用。吴儒刚等[14]在两个环境中定位到控制苗高的主效位点QSH4D, 遗传贡献率分别为17.90%和22.96%, 也位于4D染色体短臂的末端, 可能与本研究定位的QSH4D是同一个QTL。由于小麦4D染色体末端存在控制株高的主效基因Rht-D1, 推测苗高位点QSh.cau-4D是该矮秆基因的作用。另外, Huang等[13]在2BL染色体臂的末端定位到一个控制株高的QTL, 与QSh.cau-2B可能是同一个位点。分蘖数位点QTn.cau-7BS.1能够在所有的6个环境中被检测到, 可解释5.31%~16.96%变异率, 是一个稳定的主效QTL, 在已有的报道中无论是苗期还是成熟期都没有在该区间发现分蘖数相关的QTL, 所以此位点很可能是一个控制小麦分蘖数的新QTL。Huang等[13]也在3B染色体上定位到一个控制分蘖数的QTL, 同样与标记Xgwm533.2紧密连锁, 表明与QTn.cau-3B.2是同一个控制分蘖数的QTL。Zhang等[15]在7BS定位到一个控制最长根长的QTL, 在5A染色体上定位到一个控制根数的QTL, 分别与QMrl.cau-7BS和QRn.cau-5A位于相同的遗传区间内, 表明它们可能是相同的QTL。在正常水培环境下, 控制生物量(总鲜重)的QTL QTfw.cau-1B被定位在1BS末端; 北农6号是1BL/1RS染色体易位系, 从1B染色体的遗传连锁图谱和这个QTL的位置判断, 该生物量相关QTL来源于黑麦1RS染色体, 这与1BL/1RS染色体易位系具有高的生物量和产量潜力相一致。Masoudi等[16]也在1B染色体上定位到2个控制小麦苗期生物量的QTL, 但其所在的遗传区间分别为125.7~139.1 cM和184.4~194.3 cM, 位于1B染色体的长臂上, 与本研究定位到的QTL不同, 但是Masoudi等[16]在6B上定位到的QTL (72.3~77.9 cM)与QSfw.cau-6B.1位于相同的遗传位置, 可能为同一个位点。本研究在3个盐胁迫条件下检测到稳定位点QSh.cau-7BS和QRfw.cau-7BS, 位于相同的染色体区间, 分别控制苗高和根鲜重, 可能为相同位点, 并且是一个未曾报道的耐盐性新QTL。另外, 分别与苗高和根数相关的QSh.cau-2B和QRn.cau-2A也未见报道, 是本研究新定位的QTL。
来源于地方品种的燕大1817是著名的小麦育种骨干亲本之一[28], 具有抗寒、耐旱、耐瘠、生长繁茂、成穗多、适应性强等特点[29]。胜利麦× 燕大1817杂交组合是在20世纪50年代选育出品种最多、适应性较广的杂交组合, 是北部冬麦区小麦品种遗传改良的基础组合, 其后代分布于北方冬麦区, 特别是北部冬麦区, 具有繁茂、抗逆性好的特点。利用全基因组SSR标记对胜利麦× 燕大1817杂交组合后代衍生品种进行遗传贡献率分析发现, 不论在全基因组水平还是在部分同源群不同染色体组水平, 胜利
麦对其后代衍生品种遗传贡献率(43.6%)均高于燕大1817 (26.8%)[30]。胜利麦除了提供抗锈性之外, 还更多地贡献了早熟和丰产性, 而燕大1817的部分染色体或基因组区段对其后代衍生品种抗逆性可能具有较大的贡献。本研究共定位69个与盐胁迫相关的QTL, 在其中2/3的位点(46个)上, 增效效应来自燕大1817, 说明燕大1817具有更好的抗逆性; 此外, 还发现一个源自燕大1817的控制小麦多分蘖数的新主效QTL (QTn.cau-7BS.1), 可能与燕大1817及其后代衍生品系较好的繁茂性有关。来自燕大1817的其他多个耐盐性QTL, 如QSh.cau-7BS、QRfw.cau-7BS、QSh.cau-2B和QRn.cau-2A, 与该骨干亲本分蘖多、根多和根生物量大(根鲜重高)的表型相符, 是其繁茂性好、抗逆性强的遗传基础。
利用骨干亲本燕大1817与高产小麦品系北农6号杂交育成重组自交系群体及其构建的高密度遗传连锁图谱, 采用完备复合区间作图法, 在6个时间-处理环境中共定位了69个控制小麦苗期形态学性状及响应盐胁迫的QTL, 其中有12个为稳定QTL, 在至少3个环境中被重复检测到, 还发现一些环境特异性表达的QTL, 为进一步解析耐盐相关性状遗传机制及分子标记辅助选择育种奠定了基础。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|




