第一作者联系方式: E-mail: 15620071109@163.com
植酸是植物源食品中的主要抗营养成分, 降低植酸含量可有效提高大豆的营养利用率。本文根据大豆密码子使用偏好性, 对无花果曲霉植酸酶 phyA基因进行密码子优化, 人工合成了适合在大豆中表达的 phyA(b)基因。以pCAMBIA3301为骨架, 构建由大豆凝集素基因启动子和信号肽序列调控的植物表达载体pCBPS- phyA(b)。用农杆菌介导法遗传转化吉林35大豆子叶节。PCR检测表明目的基因已初步整合至大豆基因组中; bar试纸条表明所有阳性植株中均能检测到 bar基因的蛋白产物; 除草剂叶片涂抹显示野生型的叶片出现黄化或枯萎现象, 而转基因植株叶片表现正常, 具除草剂抗性; 以半定量RT-PCR共筛选到13株转 phyA和19株转 phyA(b)阳性转基因大豆植株。通过对转基因大豆T3种子中植酸酶活性、无机磷和植酸磷含量等检测, 证明人工基因 phyA(b)比 phyA在大豆种子中所表达的植酸酶具有更高的活性, 说明密码子优化有利于提高外源基因的表达。
Phytic acid is the main anti-nutritional components in the plant origin food. Reducing the phytic acid content of transgenic plants is an effective way to improve the nutrient utilization rate of soybean. In this research, the codons of Aspergillus ficuum phyA were optimized according to the codon usage bias in soybean. The phyA(b)gene with scheming DNA sequence was synthesized chemically, which was suitable for expression in soybean. The plant expression vector pCBPS- phyA(b)was constructed. In the vector, phyA(b) gene was driven by promoter of soybean lectin gene and signal peptide sequence, and transformed into Jilin 35 via Agrobacterium-mediated method. PCR detection indicated that the target gene was successfully integrated into soybean genome. The protein product of bar gene could be detected in all positive plants by LibertyLink strip analysis. Herbicide leaf painting showed that leaves of wild-type plants were lesioned, while there of transgenic plants remained green. In total, 13 phyA transgenic plants and 19 phyA(b) transgenic plants were verified by semi quantitative RT-PCR. The detection results of phytase activity, inorganic phosphorus content and phytic acid content in T3 transgenic soybean seeds, showed that the artificial phyA(b) gene was successfully expressed in soybean, and the phytase activity in phyA(b)gene transforming plants was significantly higher than that in phyAgene transforming plants. It is suggested that codon optimization can significantly improve the expression of foreign genes.
植酸(phytic acid, PA), 又称肌醇六磷酸, 是植物种子中磷的主要储存形式[1]。植酸有12个可解离的氢原子, 极易与矿质元素(如磷、钙、铁、锌、镁等)和蛋白质(如淀粉酶、脂肪酶等)螯合形成难溶性物质, 是影响植物源食品中矿质元素和蛋白质吸收的主要抗营养成分[2]。植酸酶(phytase)是催化植酸及其盐类分解成肌醇和无机磷酸盐的一类磷酸酶, 可以将磷、钙、镁等矿物元素和肌醇从植酸盐中释放出来, 可解除植酸的抗营养作用[3]。
20世纪90年代开始, 有关植酸酶植物基因工程的研究已有很多报道, 如大豆、油菜、木豆、玉米等[4, 5, 6, 7, 8, 9, 10]很多植物中都表达了重组的真菌植酸酶。2008年, Chen等[8]利用玉米种子特异性globulin-1启动子, 将黑曲霉phyA基因转化玉米, 转基因玉米种子中植酸酶的表达为2200 U kg-1, 比对照增加了近50倍。2009年和2011年, Li等[4]和Yang等[5]分别将根特异启动子pyk10和组成型启动子35S-35S调控下的无花果曲霉植酸酶(Aspergillus ficuum3.4322) phyA基因转化大豆, 结果表明phyA可以在大豆中表达, 表现出较高的植酸酶活性[4, 5]。
植酸的生物合成可能发生在细胞质或内质网中, 然后转运至蛋白体, 最后在液泡中积累[11]。高等植物细胞中, 细胞质的pH值(一般为7.0~7.5)高于液泡内的pH值(一般为5.5), 目前鉴定的各种来源的植酸酶中, 除百合花粉植酸酶外, 均为酸性植酸酶, 最适pH值在2~6之间, 如大肠杆菌appA植酸酶最适pH值为4.5, 无花果曲霉植酸酶phyA最适pH为5.5 [12]。所以, 利用液泡定位表达信号肽, 如大豆凝集素基因信号肽, 将外源植酸酶定位至液泡中, 可能会更好地提高植酸酶活性, 降低种子内的植酸水平。Coello等[11]将大肠杆菌的植酸酶appA基因连同一段液泡定位表达信号肽序列, 在胚特异性启动子的控制下转化拟南芥, 在转基因植株干种子中检测到植酸酶的活性, 且内部植酸的水平有所降低, 无机磷酸盐的含量相对提高。
生物体内普遍存在同义密码子非均衡使用的现象, 这种现象会导致外源基因在宿主细胞中的表达量降低。使用转基因受体系统偏爱密码子是提高外源基因表达水平的一种有效手段[11]。陈惠等[13]根据毕赤酵母偏爱密码子, 将来源于黑曲霉N25的植酸酶基因phyA改造, 结果表明密码子优化的酵母转化子中植酸酶活性为对照的2倍。目前, 有些植物中利用密码子优化的外源基因已获得了重组蛋白高表达的转基因植株[14, 15, 16, 17], 但还未见有通过人工优化真菌植酸酶基因, 提高受体植物植酸酶表达水平的报道。
本研究根据大豆密码子偏好性, 对无花果曲霉phyA基因优化改造, 以原始phyA基因和人工phyA(b)基因分别转化大豆, 通过转基因植株后代种子植酸酶活性、无机磷和植酸磷含量等检测, 以验证密码子优化合成的植酸酶基因的正确性及在大豆中的表达效率, 并为种子特异性表达植酸酶获得低植酸大豆奠定良好的基础。
大肠杆菌(Escherichia coli) DH5α 、根瘤农杆菌(Agrobacterium tumefaciens) LBA4404、载体pCAMBIA3301由本实验室保存。无花果曲霉(Aspergillus ficuum 3.4322) phyA基因由南开大学生命科学学院李明刚教授提供。大豆品种吉林35由河北农业大学农学院提供。各种限制性内切酶、连接酶等分子生物学操作试剂购自TaKaRa公司。激素、抗生素等生化试剂购自Sigma公司。所用培养基及其成分参见文献[4-5]。
利用CUTG网站http://www.kazusa.or.jp/codon/, 查找大豆密码子频率的相关数据, 选用1207个基因CDS (495 060 codons)分析大豆中每个氨基酸的密码子频率, 获得大豆密码子使用情况表。通过在线密码子分析软件Graphical Codon Usage Analyser (http://gcua.schoedl.de/), 分析无花果曲霉(Aspergillus ficuum 3.4322)植酸酶phyA基因(登录号为AF537344)在大豆中表达时每一密码子的使用频率, 在保证氨基酸序列完整性的前提下, 按照大豆对密码子的偏好性特点, 优化设计phyA序列, 交由生工生物工程(上海)股份有限公司合成全序列。
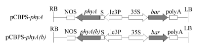
根据NCBI公布的大豆凝集素(Le3)基因启动子和信号肽序列(登录号为EU070415), 设计特异性引物, 以大豆基因组DNA为模板, 进行PCR扩增。扩增产物经纯化回收, 与T-Vector pMD19连接, 获得克隆载体pMD19-Le3PS, 测序验证。以pCAMBIA3301为骨架, 利用In-Fusion HD EcoDry Cloning Plus kits (TaKaRa), 将大豆凝集素基因启动子和信号肽序列(Le3PS)和植酸酶基因串联在一起, 构建植物胚特异性表达载体pCBPS-phyA和pCBPS-phyA(b), 筛选标记为草胺膦乙酰转移酶基因(phosphinothricin acetyltransferase, bar)(图1)。
采用农杆菌介导的子叶节法进行大豆遗传转化[4, 5]。将已构建好的植物表达载体pCBPS-phyA和pCBPS-phyA(b), 通过电击法转入根癌农杆菌LBA4404。大豆干种子经氯气灭菌后, 无菌水浸泡8~10 h, 切取子叶节并在农杆菌菌液中浸泡15 min; 取出外植体并转入共培养培养基; 28℃暗培养2~3 d后, 将外植体转入不定芽诱导培养基(含50 mg L-1 Basta); 培养2周后, 转入芽伸长培养基; 继代2~3次, 待抗性芽长至约3 cm左右时, 将其剪下插入生根培养基诱导生根, 根长2 cm左右时驯化移栽。
1.5.1 PCR检测 采用Plant DNA Isolation Reagent (TaKaRa)提取大豆苗基因组DNA, phyA基因引物为phyA-F: 5° -ATGCTGGCAGTCCCCGCCTCG- 3° 和phyA-R: 5° -CTAAGCAAAACACTCCGC-3; phyA(b)基因引物为phyA(b)-F: 5° -ATGCTTGCAGTTCCTG CTTC-3° 和phyA(b)-R: 5° -CTAAGCAAAACACTCC GCCCA-3° 。PCR反应条件为95℃ 5 min; 95℃ 30 s、58℃ 30 s、72℃ 80 s, 35个循环; 72℃ 5 min。
1.5.2 转基因检测试纸条法 取少量叶片放入1.5 mL EP管中, 研碎后加入0.1 mL抽提液并搅拌均匀, 将LibertyLink (bar)试纸条插入混合液, 5 min后观察结果。
1.5.3 除草剂叶片涂抹法 100 mg L-1 Basta中加入0.1%的Tween-20, 用毛笔涂抹植株的半片叶子, 另半片叶子用记号笔标记作为对照, 3~5 d后观察叶片反应。
1.5.4 半定量RT-PCR检测 采用MiniBEST Plant RNA Extraction Kit (TaKaRa)提取叶片总RNA, PrimeScript RT Reagent Kit (TaKaRa)反转录为cDNA, 利用半定量RT-PCR分析外源基因的表达情况。phyA基因引物为phyA-F: 5° -ATGCTGGCAGTCCCCG CCTCGAG-3° 和phyA-R: 5° -GGCTGAGCACGAGG ATCC-3° 。phyA(b)基因引物为phyA(b)-F: 5° -ATGCT TGCAGTTCCTGCTTCTAG-3° 和phyA(b)-R: 5° -GGC TGAGCTCTAGGATCT-3° 。内参基因Actin (登录号为V00450.1)引物为Actin-F: 5° -CTCAACCCAAAG GTCAACAG-3° 和Actin-R: 5° -TCTAGGGCAACATA TGCAAG-3° 。
2.1phyA基因的密码子优化
利用CUTG和Graphical Codon Usage Analyser对大豆密码子使用频率和无花果曲霉phyA密码子使用情况分析比较(图2)。
由图2可以看出, 有6个密码子在大豆中表达时偏好性较强, 表达效率小于50%, 很可能影响产物表达。如编码精氨酸Arg的CGG (29%)、CGC (45%)和CGT (45%), 编码脯氨酸Pro的CCG (27%), 编码丝氨酸Ser的TCG (36%)和编码缬氨酸Val的GTC (46%)。为实现无花果曲霉植酸酶基因phyA在大豆中的高效稳定表达, 在氨基酸序列保持不变的前提下, 替换上述6个密码子, 将CGC、CGG和CGT替换为AGA, CCG替换为CCT, TCG替换为TCT, GTC替换为GTT, 共改变85个碱基, 涉及76个密码子, 改变率为16.93%。新基因G+C含量更靠近大豆内源基因G+C含量, 由55.7%下降至49.8%, 比原始含量降低了5.9%。改造后的phyA(b)基因具有大豆基因的密码子特征。
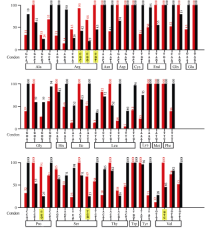 | 图2 大豆密码子使用频率(黑色)和无花果曲霉phyA基因密码子使用频率(红色)Fig. 2 Comparison of codon usage frequency of soybean (black) and that ofphyAgene in Aspergillus ficuum(red) |
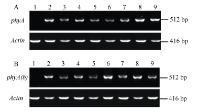
转化的大豆品种吉林35经过抗性芽诱导、伸长、生根和移栽等一系列过程(图3), 获得T0代Basta大豆抗性苗58株, 其中转phyA基因抗性苗25株, 转phyA(b)基因抗性苗33株。对抗性苗基因组DNA进行PCR扩增, 13株转phyA基因大豆和19株转phyA(b)基因大豆中能检测到1350 bp的目的片段, 说明目的基因已初步整合至大豆基因组中(图4-A); 使用PAT/bar转基因试纸条对上述PCR阳性植株进一步检测表明所有植株中均能检测到bar基因的蛋白产物(图4-B); 除草剂叶片涂抹试验表明, 野生型对照的叶片出现黄化或枯萎现象, 而转基因大豆植株叶片表现正常, 呈现除草剂抗性(图4-C)。
提取T0转基因大豆叶片的总RNA, 反转成cDNA进行RT-PCR分析(图5), 结果表明, 转基因植株能够扩增出大小一致但亮度不一的目的条带, 野生型对照没有出现相应条带, 表明外源基因在转基因大豆体内可以正常表达, 不同植株体内外源基因的表达水平不同。选取外源基因表达量高的植株, 包括转phyA基因的A2、A8、A9株系和转phyA(b)基因的b2、b6和b8株系的T3代, 测定植酸酶活性、无机磷和植酸磷含量。
根据RT-PCR结果, 分别测定3个转phyA基因和3个转phyA(b)基因的T3代大豆种子中的植酸酶活性、无机磷和植酸磷含量(表1)。结果表明, 与野生型相比, 3个转phyA基因株系和3个转phyA(b)基因株系的T3种子中植酸酶活性均有显著提高。而且, 转phyA(b)基因株系的植酸酶活性普遍高于转phyA基因株系, 表明密码子优化有利于提高外源基因的表达。在转phyA基因株系中, AL8-3的植酸酶活性最高, 为91 μ mol mg-1 min-1; 在转phyA(b)基因株系中, bL6-1的植酸酶活性最高, 达到116 μ mol mg-1 min-1, 比AL8-3提高了27.48%。
| 表1 转基因大豆T3种子的植酸酶活性、植酸磷和无机磷含量性状分析 Table 1 Phytase activity, Pi, and phytate content of transgenic soybean T3 seeds |
与野生型相比, 3个phyA(b)株系和3个phyA株系T3代种子中的植酸磷含量显著降低, 无机磷含量显著提高, 总磷含量变化不明显。其中转phyA(b)基因株系bL6-1的植酸磷含量为1.36 μ g mg-1, 仅为野生型4.83 μ g mg-1的28.16%, 比AL8-3的2.11 μ g mg-1降低了35.55%; bL6-1株系无机磷含量比野生型对照净增6.9倍, 达4.11 μ g mg-1, 是AL8-3株系的1.24倍。
此外, 试验表明各株系植酸酶的含量与各自的外源基因表达水平(半定量RT-PCR结果)相关, 表达量越高的植株, 植酸酶活性也越高, 相应其植酸含量降低的也越明显。对照和6个转基因株系的植酸酶活性为bL6-1> bL8-2> bL2-3> AL8-3> AL9-5> AL2-2> WT。推断转基因植株中植酸酶活性受到外源植酸酶基因表达水平的影响, 增加植株体内的植酸酶活性, 降低种子中的植酸含量。本试验中, 人工基因phyA(b)比未改造的phyA基因在大豆种子中所表达的植酸酶具有更高的活性, 表明密码子优化有利于提高外源基因的表达。
在长期的进化过程中, 对于一个特定氨基酸的同义密码子, 不同物种会形成不同的偏爱性。由于外源基因与转基因受体系统在密码子偏爱上的不同, 经常造成外源基因难以有效翻译。因此, 适当地将外源基因的密码子替换成为受体系统偏爱的密码子, 可以提高外源基因在该系统中的表达水平[14, 15, 16, 17]。近几年来, 虽然关于密码子优化的研究多为在大肠杆菌或酵母中的异源表达, 但在玉米、水稻、番茄等植物中, 也有成功报道。Jabeen等[16]研究表明, 密码子优化的cry1Ab基因在植物原生质体中的表达水平提高了4~6倍。Tang等[19]以密码子优化的Cry1A(c)基因转化水稻, 转基因水稻叶片中Cry1A(c)蛋白含量达到1.38 μ g g-1, 田间和室内抗虫实验都显示对鳞翅目害虫有很好的毒杀效果。上述研究为我们探讨优化改造无花果曲霉植酸酶基因, 提高转基因大豆中植酸酶的活性, 提供了参考依据和理论基础。
本试验按照无花果曲霉phyA蛋白的氨基酸序列和大豆偏爱密码子, 优化并人工合成了phyA(b)基因, 转phyA(b)基因株系bL6-1的植酸酶活性比转phyA基因的AL8-3株系提高了27.48%, 植酸磷含量降低了35.55%, 无机磷含量增加并达到AL8-3的1.24倍。证明本试验采取的优化并改造密码子提高外源基因表达水平的策略有效, 为优化改造微生物基因转化植物的研究奠定了基础, 并丰富了植物转基因分子育种的基因资源。
基因工程育种的目的是不改变植物原有优良性状, 并获得相应的目的性状。植酸在种子发育和萌发过程中具有非常重要的生理作用。2006年, Nunes等[20]利用RNAi技术敲除GmMIPS1表明, 阻断植酸的生物合成会对种子萌发产生显著的副作用。种子贮藏蛋白基因启动子(如大豆凝集素基因启动子)的转录功能具有显著的组织和发育时期特异性, 仅在种子成熟过程的中期至后期指导其下游基因的表达[11]。Bilyeu等[10]将大肠杆菌植酸酶appA基因置于大豆凝集素基因启动子的调控下转化大豆, appA基因在发育中的子叶细胞质中高水平表达。因此, 本试验将phyA和phyA(b)基因连同一段液泡定位表达信号肽序列(大豆凝集素基因信号肽), 在胚特异性启动子(大豆凝集素基因启动子)的控制下转化大豆。结果却在获得的转基因材料后代中, 植酸酶活性虽有不同程度提高, 但不同株系植酸酶活性、植酸磷含量及无机磷含量却不同。今后需进一步研究这些转基因材料的其他农艺性状, 如种子萌发率和种子干重等, 以筛选获得植酸含量显著降低、种子萌发率和种子干重不受显著影响的转基因大豆材料, 从而为低植酸转基因大豆育种奠定基础, 以实现从源头避免植酸的抗营养作用, 提高大豆源食物或饲料营养成分的有效利用率。
通过对无花果曲霉植酸酶phyA基因的密码子优化, 人工合成了适合在大豆中表达的phyA(b)基因。以phyA和phyA(b)基因分别转化大豆证明, phyA(b)比phyA在大豆种子中所表达的植酸酶活性更高, 密码子优化有利于提高外源基因的表达。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|