第一作者联系方式: E-mail: 1099908163@qq.com
角质层蜡质与植物适应逆境胁迫有关。本研究以甘蓝型油菜中双11为试材, 在五叶期分别对其进行200 μmol L-1水杨酸(SA)溶液、1-氨基环丙烷-1-羧酸(ACC)溶液以及100 μmol L-1茉莉酸甲酯(MeJA)溶液浇灌处理, 分析油菜叶角质层蜡质组分含量、结构以及角质层渗透性的变化。结果表明, MeJA处理7 d后, 烷类、二级醇类、酮类、醛类含量以及蜡质总量与对照相比均显著增加, 而处理14 d后, 所有蜡质组分含量及蜡质总量与对照相比均显著减少; SA与ACC处理早期对叶片蜡质沉积无显著影响(SA处理14 d后, 一级醇类、醛类及未知组分含量显著减少)。SA、MeJA和ACC处理21 d后均显著诱导油菜叶片角质层蜡质的沉积, 蜡质组分中烷类、酮类、醛类显著增加, 其中C29烷、C29酮、C30醛是被SA、MeJA和ACC诱导的主要蜡质组分, 暗示烷类、酮类、醛类可能与这些信号分子介导的抗(耐)性反应密切相关。扫描电镜结果显示, SA处理减少叶表皮蜡质杆状结构, 且部分区域熔融; MeJA与ACC处理增加油菜叶表皮蜡质的晶体结构密度。角质层蜡质的沉积与结构变化降低角质层渗透性, 减缓叶片的水分散失, 其中C29烷的特异性增加可能是造成叶片失水率降低的主要原因。
Cuticular waxes are related to plant adaptation to environment stress. In the current study, Brassica napus cv. Zhongshuang 11 grown in the soil treated with adding solutions of SA (200 μmol L-1), MeJA (100 μmol L-1), and ACC (200 μmol L-1) wax, were sampled at the five-leaf stage to clarify the effects of SA, MeJA and ETH on adjusting plant cuticular wax deposition. The leaves were used to analyze the amounts of total cuticular wax and wax constituents, wax crystal structure, and cuticular permeability. The amounts of n-alkanes, secondary alcohols, ketones, aldehydes and total cuticular waxes increased significantly when compared with the control at seven days after MeJA treatment, whereas the amounts of all wax constituents and total cuticular waxes significantly decreased at 14 days after MeJA treatment. The application of SA and ACC had no significant influence on cuticular wax deposition at 7 and 14 days after treatments, except for an amount reduction of primary alcohol, aldehyde and unknown constituents for SA treatment at 14 days after treatment. At 21 days after SA, MeJA, and ACC application, the amounts of total cuticular wax, n-alkanes, ketones and aldehyde significantly increased. C29 n-alkane, C29 ketone, and C30 aldehyde were the main cuticular wax constituents induced by SA, MeJA, and ACC application, implying that n-alkane, ketone and aldehyde might be related to the resistance to stresses induced by these signal molecules. Scan electric microscope analysis indicted that the rod-shape structure of cuticular wax in leaf surface reduced and some rods melted under SA treatment. MeJA and ACC application increased the distribution density of wax crystalloids. The cuticular wax deposition and crystal structure alteration reduced the cuticular permeability and delayed the leaf water loss. The specific increase of C29 n-alkane might be the main reason for reducing leaf water loss in B. napus.
植物在发育过程中经常会遭受各种生物和非生物胁迫, 对于抵抗和适应这些逆境胁迫, 植物进化中形成了一套复杂的防御网络。植物激素在这个防御网络中起到了十分重要的作用, 当遇到逆境胁迫时, 植物体内的激素水平会发生变化以启动和调节某些与逆境适应相关的生理生化过程来诱导抗(耐)逆性的形成。植物角质层是植物与外界环境的第一接触面, 是植物应对生物和非生物逆境的重要屏障, 其中的角质层蜡质是由堆积在角质层最外面有独特三维结构的表皮蜡质和填充于角质中的内部蜡质组成, 具有多种生理和生态学功能。环境因素如水分胁迫、NaCl、紫外线辐射、低温、病害胁迫等会导致植物蜡质含量和结构的改变[1, 2, 3, 4]。角质层蜡质的沉积也受植物激素的调控。例如, 乙烯(ETH)能够诱导柑桔表皮蜡质含量的增加及结构变化, 阻止Penicillium digitatum入侵[5]。ETH合成受抑制时, 延迟了苹果表皮中特定蜡质组分的合成[6]。脱落酸(ABA)诱导了独行菜叶片中大于C26的脂肪族物质含量的增加, 其耐旱性随之增强[7]。水分胁迫下, ABA通过上调转录因子MYB96的表达而促进拟南芥几个蜡质合成基因的表达, 最终促进了蜡质的积累[8]。这些结果表明, 植物激素作为信号分子可能通过介导角质层蜡质的沉积而影响植物对逆境胁迫的响应。
ETH是一种重要的植物激素, 在植物对生物胁迫和非生物胁迫的耐受性和抗性中发挥重要作用。水杨酸(SA)与茉莉酸类物质(JAs)是广泛存在于高等植物体内的一种新型植物生长调节物质, 在调节植物生长发育、光合特性、抗逆反应中起着重要的作用。本研究分析了SA、茉莉酸甲酯(MeJA)和乙烯合成促进剂1-氨基环丙烷-1-羧酸(ACC)处理对油菜叶角质层蜡质组分含量、结构以及角质层渗透性的影响, 初步揭示了这些信号分子与植物角质层蜡质沉积的关系。
甘蓝型油菜中双11, 由西南大学油菜工程中心提供。采用盆栽, 每盆(7 cm × 8 cm)装土0.2 kg [草炭土与弱酸性黄壤1∶ 1 (w/w)], 移栽1株幼苗, 于网室种植, 常规管理, 保证土壤相对含水量不低于60%。待幼苗长出5片真叶时进行激素处理。
用1%的MS溶液分别配制浓度为200 μ mol L-1的SA溶液、ACC溶液以及100 μ mol L-1的MeJA溶液。当幼苗长至5片真叶时, 分别取上述溶液浇灌于土壤中, 每2 d一次, 每次浇灌20 mL。对照用1%的MS溶液浇灌。在激素处理的7、14和21 d后分别取其叶片分析蜡质组分含量; 在处理21 d后取叶片以扫描电镜观察蜡质结构及检测角质层渗透性。
采集植株自上而下第2片展开叶片, 置含30 mL氯仿的培养皿浸提30 s, 氯仿中预先加入已知浓度的C16烷作为内标。用氮吹仪蒸干浸提液, 再于80℃下用100 μ L的BSTFA衍生1 h, 将BSTFA在氮吹仪中蒸干后, 将产物溶于100 μ L正己烷中。用气相色谱仪(福立9790II, 浙江)分析测定蜡质组分及含量。具体程序及参数设置参考倪郁等[2]方法。根据FID的峰面积对蜡质定量, 同时利用GC-MS (岛津GC2010MS, 日本)鉴定蜡质组分, 参考内标正十六烷计算各蜡质组分的实际含量。用单位叶面积的微克数(μ g cm-2)表示蜡质含量。利用数字化扫描仪(EPSON V750)和WinFOLIA叶片专业图像分析软件(Regent Instrument Inc., Canada)测定并记录叶面积。每处理4个重复。
采集植株自上而下第3片展开叶片, 干燥后从距中间叶脉0.1 cm处剪取样品, 用碳导电胶布固定在载物台上, 再将样品放入金属离子溅射仪(E1010, Hitachi)内喷镀导电膜, 材料镀金后于扫描电子显微镜(S3000-N, Hitachi)下观察形态。每处理4个重复。
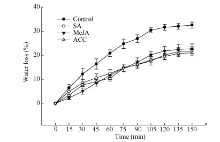
参考Kosma等[1]方法, 将各处理材料于黑暗环境中培养6 h, 以使气孔关闭, 采集植株叶片于蒸馏水中黑暗处理1 h, 称其重量, 作为叶片饱和重量。然后将叶片放入20℃的培养箱(黑暗), 每15 min取出叶片称重一次。150 min后将叶片取出放在70℃的烘箱中干燥24 h, 称其干重。水分损失率 = (饱和重量 - 每个时间点的重量)/叶片含水量, 叶片含水量 = 饱和重量 - 干重。每处理8个重复。
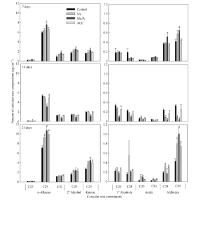
表1表明, SA处理7 d后, 角质层各蜡质组分含量与蜡质总量均与对照无显著差异; 处理14 d后, 一级醇类、醛类及未知组分含量显著减少, 其中蜡质优势组分C24酸、C28醛、C30醛含量显著降低, 但蜡质总量无显著变化; 处理21 d后, 烷类、酮类、醛类含量以及蜡质总量均比对照显著增加, 其中蜡质优势组分C29烷、C29酮、C24酸、C28醛、C30醛含量增加显著(图1)。
| 表1 SA、MeJA和ACC对油菜叶角质层蜡质含量的影响 Table 1 Effects of SA, MeJA, and ACC treatment on amounts of leaf cuticular wax in Brassica napus (μ g cm-2) |
Data followed by asterisk in the same column and the same day are significantly different from the control at P < 0.05.
MeJA处理7 d后, 烷类、二级醇类、酮类、醛类含量以及蜡质总量均比对照显著增加, 其中蜡质优势组分C29烷、C31烷、C29二级醇、C29酮、C28醛、C30醛含量增加显著(表1和图1); MeJA处理14 d后, 所有蜡质组分含量及蜡质总量均比对照显著减少; 而在处理21 d后, 烷类、酮类、酸类、醛类含量以及蜡质总量显著增加, 其中蜡质优势组分C29烷、C29酮、C20酸、C30醛含量增加显著。
ACC处理7 d、14 d后, 角质层各蜡质组分与蜡质总量与对照相比均无显著变化(表1和图1); 处理21 d后, 烷类、酮类、醛类以及蜡质总量均比对照显著增加, 其中蜡质优势组分C29烷、C29酮、C24酸、C28醛、C30醛增加显著。
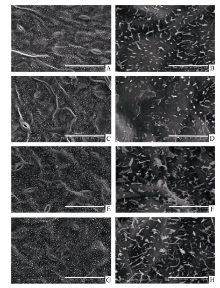
甘蓝型油菜中双11叶表皮蜡质结构类型以杆状、颗粒状(小型片状)为主(图2)。SA处理(21 d)后, 叶片表皮蜡质杆状结构减少, 部分区域熔融, 晶体结构边界不清晰。MeJA与ACC处理(21 d)后, 叶表皮蜡质的晶体结构密度增加, ACC处理后杆状结构长度增加(图2)。
甘蓝型油菜叶角质层蜡质主要由长链脂肪酸(C> 18)和由长链脂肪酸衍生而来的醛、一级醇、二级醇、烷、酮、酯等组成, 其中由蜡质脱羰途径生成的C29烷、C29酮与C29二级醇是主要的蜡质组分。这与十字花科拟南芥(A. thaliana)、甘蓝(B. oleracea)等角质层蜡质组成相似[9]。植物角质层蜡质的组分、含量等会随着植物组织器官及发育时期的变化而改变。例如, 瑞士石松(Pinus cembra)的蜡质沉积随着叶片的发育而减少[10]。本研究中, 虽然蜡质总量随着叶片发育而减少, 但烷类、二级醇类、酮类、醛类等在蜡质总量中所占的比重随叶片的发育而呈增加趋势。
植物激素作为植物体内的痕量信号分子, 调节着植物体对环境的应答。近年来发现SA、JAs和ETH广泛参与调控植物防御反应与植株形态发育相关的多种生物学过程, 从而影响着植物应对不良环境的能力[11, 12, 13]。本研究结果表明, 外源SA、MeJA和ACC处理能够诱导油菜叶片角质层蜡质的沉积, 降低角质层渗透性, 而蜡质组分的变化可能是造成其水分散失减缓的主要原因。SA、MeJA、ACC处理21 d时, 油菜叶角质层中烷类、酮类、醛类显著增加, 其中C29烷、C29酮、C30醛是被SA、MeJA、ACC诱导增加的主要蜡质组分, 暗示烷类、酮类、醛类可能与这些信号分子介导的抗(耐)性反应密切相关。Seo等[8]研究发现, 拟南芥角质层蜡质中烷类和醛类物质的增加提高了植株的抗旱能力。番茄ps突变体果实表皮蜡质中几乎不含烷类和醛类, 而果实表面失水率比野生型快5~8倍[14]。乙烯信号的转导最后以乙烯响应因子激活或抑制相关基因的表达, 参与防卫反应的诱导[15]。拟南芥乙烯响应类型的转录因子WIN1/SHN1在转基因植株中超表达时诱导蜡质脱羰基途径产物(烷类、二级醇类、酮类)的特异性增加, 增强植株的耐旱性[16, 17]。SA、MeJA和ACC诱导的油菜叶片角质层中烷类、醛类的增加也可能与生物胁迫抗性有关。菌核病菌侵染甘蓝型油菜时, 油菜叶表皮蜡质中醛类含量显著增加[18]。Kosma等[19]研究认为C21~C27烷类、醛类、C22和C24脂肪酸及伯醇是小麦抗黑森瘿蚊侵扰的重要成分。拟南芥表皮蜡质缺失突变体cer6和cer2中, SA信号途径标志基因— — 病程相关蛋白PR基因的表达显著降低[20], 暗示植物抗性基因的转录水平与蜡质组分密切相关。
本研究中, 油菜叶片蜡质含量在MeJA处理7 d、21 d时均显著增加, 而在处理中期(14 d)显著减少, 这可能与MeJA对植物生长发育的复杂调控有关。茉莉酸类能够调节植物生长发育的很多方面, 包括抑制幼苗叶片与主根的生长[21]、促进侧根和根毛的产生[22]、诱导表皮毛的形成等[23]。叶片蜡质的沉积变化应该是一个受茉莉酸类调控的综合效应, 可能与MeJA处理时间、浓度、植物发育阶段等有关。
C29烷是甘蓝型油菜含量最高的蜡质组分[24]。本研究中, SA、MeJA和ACC处理21 d后, C29烷含量与对照相比分别增加30%、50%和39%, 而叶片失水率在150 min时与对照相比分别减少33%、30%和35%, 说明C29烷的积累在SA、MeJA和ETH介导的植株抗旱性中可能承担着重要作用。Weng等[25]发现, C29烷严重缺失的拟南芥lacs1、lacs2双缺失突变体与野生型相比, 角质层渗透性高, 失水率快, 对干旱更为敏感。负责烷类物质合成的CER1在拟南芥中超表达促进了C29烷的积累, 角质层渗透性降低, 增强了植株对干旱的耐受力[26]。蒺藜苜蓿乙烯响应类型转录因子WXP1在拟南芥中超表达时, 促进C29、C31和C33烷类的合成, WXP转基因植株表现出耐旱性增强[27]。
Oliveira等[28]认为角质层结构和蜡质组成是决定植物抗逆性的关键因素。ETH诱导的柑桔表皮蜡质结构的变化, 阻止了Penicillium digitatum入侵[5]。本研究扫描电镜结果显示, 甘蓝型油菜中双11叶表皮蜡质结构类型以杆状、颗粒状(小型片状)为主。SA、MeJA和ACC处理不同程度地改变了油菜叶表皮蜡质结构。MeJA与ACC处理使油菜叶表皮蜡质的晶体结构密度增加, 这与蜡质含量分析的结果相一致。表皮蜡质层厚度的增加可降低植株失水率, 提高其对干旱的耐受力[29]。SA处理后, 叶表皮蜡质杆状结构减少, 且部分区域熔融(图2)。植物角质层蜡质包含角质层内部蜡质与表皮蜡质, SA所诱导的叶片蜡质含量的增加可能主要是来自角质层内部蜡质的沉积。在对番茄蜡质研究中发现, 蜡质组成特别是内表皮蜡质起着主要的蒸腾屏障作用[30]。SA与MeJA、ACC所诱导的表皮蜡质结构的差异也可能与它们介导的不同抗逆信号途径有关。一般而言, 在抗病反应中, 依赖于SA的防卫反应主要针对活体营养型病原菌, 依赖于JA和ETH的防卫反应主要针对腐生营养型病原菌[31, 32]。
外源SA、MeJA及ACC处理能够诱导甘蓝型油菜中双11叶片角质层蜡质的沉积, 降低角质层渗透性, 减缓叶片的水分散失, 其中C29烷的特异性增加是造成叶片失水率降低的主要原因。蜡质组分中烷类、酮类以及醛类可能与SA、JA和ETH所介导的抗(耐)性反应密切相关。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|