第一作者联系方式: E-mail:xuyunji19881004@163.com
本研究旨在探明根系分区交替灌溉对玉米强、弱势粒灌浆及其相关生理特性的影响。以高产玉米品种登海11为材料, 自抽雄至成熟设置常规灌溉(CI)和根系分区交替灌溉(PAI) 2种灌溉方式, 观察植株穗位叶的光合特性、衰老特性、茎鞘非结构性碳水化合物(NSC)运转、强势粒和弱势粒中乙烯和多胺含量、籽粒灌浆特征及淀粉积累特性等变化。结果表明, 与CI相比, PAI显著增加了籽粒产量, 提高了灌浆后期穗位叶的光合性能, 延缓了叶片衰老, 促进了玉米茎鞘NSC的运转, 增加了弱势粒中亚精胺(free-Spd)和精胺(free-Spm)含量, 降低了弱势粒中腐胺(free-Put)含量和乙烯释放速率。PAI对强势粒多胺含量、乙烯释放速率以及灌浆速率和淀粉积累速率无显著影响。相关分析表明, 籽粒灌浆速率和淀粉积累速率与内源free-Spd和free-Spm含量呈极显著正相关, 与乙烯释放速率呈显著或极显著负相关。表明灌浆期较强的叶片光合能力、较高的茎鞘NSC运转率、弱势粒中较高的free-Spd和free-Spm水平以及较低的乙烯释放速率是PAI促进弱势粒灌浆和提高产量的重要原因。
This study investigated whether and how post-tasseling alternate irrigation in partitioned roots could enhance the filling of inferior caryopses in maize. A high-yielding maize cultivar, Denghai 11, was grown in a glasshouse, and two irrigation treatments, conventional irrigation (CI) and alternate irrigation in partitioned roots (PAI), were applied from tasseling to maturity. Kernel filling rates and starch accumulation rates of superior and inferior caryopses and changes in ethylene evolution rate and polyamine contents in caryopses, photosynthetic and senescence characteristics of the ear leaf and non-structural carbohydrates (NSC) in stems were determined. The results showed that, compared with CI, PAI significantly increased kernel yield, strengthened photosynthetic characteristics of the ear leaf during late kernel-filling period, delayed leaf senescence, promoted NSC remobilization from stems plus sheath, and increased free-spermidine (free-Spd) and free-spermine (free-Spm) contents, whereas declined the free-putrescine (free-Put) content and ethylene evolution rate in inferior caryopses. No significant effect of PAI on the kernel filling of superior caryopses was detected. Correlation analysis showed that kernel-filling rates and starch accumulation rates were very significantly and positively correlated with free-Spd and free-Spm contents, and significantly and negatively correlated with ethylene evolution rate. The results indicate that PAI enhances the filling of inferior caryopses and increases kernel yield through increasing photosynthetic ability of the ear leaf, remobilization of NSC from stems, and free-Spd and free-Spm contents, and decreasing ethylene evolution rate in inferior caryopses during the grain-filling period.
玉米是我国种植面积最大的粮食作物, 其产量直接关系到我国粮食供应的安全(国家粮食局, http://nongye.cntv.cn/20121017/102023.shtml)。籽粒重量是玉米产量的重要组成部分, 籽粒充实的优劣直接关系到粒重和产量的高低。禾谷类作物的粒重因其在穗上着生位置的不同而有较大差异[1, 2, 3, 4, 5]。一般来说, 将灌浆快、充实好、粒重高的籽粒称为强势粒; 将灌浆慢、充实差和粒重低的籽粒称为弱势粒[1, 2, 3, 4, 5]。但对于玉米等禾谷类作物强、弱势粒灌浆差异的机制, 目前尚不清楚。
乙烯和多胺是两类重要的植物生长调节物质, 在植物生长发育中起着重要的调控作用[6]。在高等植物组织中, 多胺主要包括腐胺、亚精胺和精胺。据报道, 相对于弱势粒, 水稻[7, 8, 9]和小麦[10]的强势粒具有较低的乙烯释放速率和腐胺浓度及较高的亚精胺和精胺浓度。水稻和小麦籽粒中乙烯释放速率和多胺浓度与籽粒灌浆关系密切。较低的乙烯释放速率和腐胺浓度或较高的亚精胺和精胺浓度有利于弱势粒灌浆和粒重增加[9, 10]。但有关玉米籽粒中乙烯或多胺含量变化及其与强、弱势粒灌浆关系的研究较少。能否通过灌溉等措施调节玉米籽粒中乙烯和多胺水平, 进而促进弱势粒灌浆?尚未见研究报道。
作物根系分区交替灌溉是一种新的节水灌溉方法[11, 12]。该技术的主要特点是使作物部分根系生长在干燥土壤中, 另一部分根系生长在湿润的土壤中, 通过分区交替灌溉, 使根系生长环境 “ 干、湿” 交替[12]。作物根系分区交替灌溉作为农田节水新技术, 多适用于玉米、棉花、高粱等宽行距作物或果树[13, 14, 15]。有研究表明, 作物根系分区交替灌溉技术可以减少棵间蒸发和作物蒸腾耗水, 对光合产物的积累不会产生严重的负面影响, 从而可以提高灌溉水利用效率和植物水分利用效率[13, 14, 15, 16]。但是, 玉米根系分区交替灌溉能否以及如何影响强、弱势粒灌浆?缺乏研究。深入研究这一问题, 对于进一步阐明玉米强、弱势粒灌浆差异机理和建立促进弱势粒灌浆的技术途径有重要意义。因此, 本文研究根系分区交替灌溉对玉米籽粒灌浆及其粒重的影响, 并观察叶片光合性状和衰老性状、茎鞘非结构性碳水化合物(NSC)运转、强势粒和弱势粒中乙烯和多胺水平对根系分区交替灌溉的响应, 以期阐明该技术影响玉米籽粒灌浆的生理机制。
2012年和2014年在扬州大学江苏省作物遗传生理重点实验室试验农场的温室种植玉米杂交种登海11。土壤类型为沙壤土, 土壤含有机质22.7 g kg-1、速效氮96.5 mg kg-1、速效磷20.4 mg kg-1、速效钾120.0 mg kg-1。3月28日播种, 株行距为37 cm× 55 cm, 三叶期间苗定苗至4.91万hm-2。播种前施用尿素、过磷酸钙和氯化钾, 分别折合纯氮42 kg hm-2, P2O576 kg hm-2和K2O 95 kg hm-2。在大喇叭口期和吐丝期分别追施尿素折合纯氮27 kg hm-2和63 kg hm-2, 温室的屋顶为透明玻璃, 四周通风, 全生育期温室内日平均温度比大田高0.85℃, 白天平均光照强度为大田试验的92%。两试验均在7月19日收获。其他管理措施同当地玉米高产栽培。
自抽雄至成熟人工浇灌自来水, 设置2种浇灌方法: (1)常规灌溉(CI), 即均匀灌溉每条沟, 充分供水, 土壤水势保持在(-30± 10) kPa; (2)根系分区交替灌溉(PAI), 即对相邻的两个沟交替灌溉, 本次灌溉的沟下次不灌, 本次干旱的沟下次灌溉; 而且当本次干旱区的土壤水势下降至-60 kPa时才供水灌溉, 本次灌溉区的土壤水势也需下降至-60 kPa时再供水, 以此交替灌溉。本实验中, 当土壤水势在-30 kPa和-60 kPa时, 土壤含水量分别为0.168 g g-1和0.145 g g-1。在CI处理中, 确定水势为(-30± 10) kPa的生理依据是植株生长正常, 叶片光合速率较高, 是目前玉米高产栽培中常用的水分管理方法。在PAI处理中, 确定水势为-60 kPa的生理依据是穗位叶光合作用不受到严重抑制, 植株的水分状况在夜间可以恢复。用土壤水分张力计(中国科学院南京土壤研究所生产)监测土壤水势, 小区面积为7.05 m× 5.50 m, 重复2次。通过在灌溉管道上安装流量表记录灌水量。
1.3.1 籽粒灌浆动态 吐丝期从各处理选择同日吐丝且健壮一致的玉米80株并挂牌标记(每小区挂40株)。从吐丝至成熟期每隔6 d取挂牌果穗6个(每小区3个), 将果穗分为上、中、下三部分, 去除各分界处的边际籽粒后, 将中、下部籽粒混合作为强势粒, 玉米上部籽粒作为弱势粒。各取强、弱势粒30~60粒测定乙烯释放速率。再各取强、弱势粒50~60粒置液氮冷冻5 min后放入-70℃冰箱保存, 用于测定多胺含量。而剩下的籽粒经105℃杀青30 min, 80℃烘至恒重后称重, 测定籽粒增重动态。参照朱庆森等[17]方法用Richards方程[18]拟合籽粒灌浆的增重动态。
W = A/(1 + Be-kt)1/N (1)
对方程(1)求导, 得到籽粒灌浆速率(G)。
G= AkBe-kt/N(1 + Be-kt)(N+1)/N (2)
式中, W为籽粒重量, A为最大籽粒重, t为吐丝后的时间(d), B、k和N为方程参数。从籽粒重量A的5% (t1)到95% (t2)定义为活跃灌浆期(D), D= 2(N+2)/K。活跃灌浆期内籽粒增加的重量除以活跃灌浆期为籽粒平均灌浆速率(Gmean)。
1.3.2 籽粒淀粉积累量及其积累速率 将上述测定完籽粒增重动态的烘干籽粒粉碎后采用双波长比色法[19]测定直链淀粉和支链淀粉积累量, 淀粉积累量为测得直链淀粉和支链淀粉之和。用Rn=(Wn+6 - Wn-6)/12计算淀粉积累速率, 其中n为吐丝后天数, Rn为第n天的淀粉积累速率, Wn+6为第n+6天的淀粉含量, Wn-6为第n-6天的淀粉含量。
1.3.3 穗位叶水势 分别于吐丝期、吐丝后12 d、24 d、36 d和48 d, 选择6株挂牌植株的穗位叶, 于当天9:00— 11:00采用压力室法测定叶片水势(模型3000, 土壤水分仪器公司, Santa Barbara, CA, USA)。因玉米叶片较大, 不同叶片部位叶片水势可能存在差异。因此, 本试验选择测定上、中、下3个部位水势, 取平均值代表整个穗位叶的水势。各处理重复测定6叶。
1.3.4 叶绿素仪读数(SPAD值) 分别于吐丝期、吐丝后12 d、24 d、36 d和48 d, 选择8株挂牌植株的穗位叶, 用日本产的SPAD-502叶绿素仪于当天9:00— 11:00测定穗位叶上、中、下部SPAD值取平均值, 每个处理取测定的8张叶片的平均值。
1.3.5 穗位叶光合速率、蒸腾速率和蒸腾效率
分别于吐丝期、吐丝后12 d、24 d、36 d和48 d, 使用美国LI-COR-6400便携式光合测定仪(Li-Cor 6400 portable photosynthesis measurement system, Li-Cor, Lincoln, NE, USA)测定挂牌植株穗位叶的光合速率和蒸腾速率, 测定部位为叶片中部。测定时间为上午9:00— 11:00, 使用红蓝光源, 光量子通量密度(PFD)为1600 μ mol m-2 s-1, 叶室CO2浓度为380 μ mol mol-1, 对每个处理测定6张叶片。其中蒸腾效率按照下式计算:
蒸腾效率=光合速率/蒸腾速率
1.3.6 穗位叶超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量 分别于吐丝后12 d、24 d、36 d和48 d, 将用于测定籽粒灌浆的挂牌穗位叶置液氮冷冻5 min后放入-70℃冰箱保存待用。将冷藏的鲜样叶去除中部叶脉, 剪碎混匀后称取0.5 g, 加5 mL硫酸妥缓冲溶液(pH 7.8)及少量石英砂, 冰浴研磨至匀浆, 4℃离心20 min (12 000转 min-1), 上清液即为酶提取液。采用NBT光化还原法[20]测定超氧化物歧化酶(SOD)活性, 以抑制NBT光化还原50%的酶量为1个酶活力单位; 采用硫代巴比妥酸法[21]测定MDA含量。重复3次, 取平均值。同时采用称重法测定上述取样的穗位叶含水量。不同灌溉方式处理的叶片含水量存在差异, 为减少该差异的影响, 本试验以干重计算SOD活性和MDA含量。
1.3.7 茎鞘贮存非结构性碳水化合物(NSC)及其运转率 在吐丝期和成熟期分别选取3株玉米植株茎秆与叶鞘 (下文简称茎鞘, 除去顶端雄穗部分)为样品, 经105℃杀青30 min, 80℃烘干至恒重后称重, 经粉碎混匀后采用硫酸-蒽酮比色法[22]测定茎鞘NSC含量。重复3次, 取平均值。NSC包括可溶性碳水化合物和淀粉。按下式计算:
茎鞘NSC运转率(%) = (吐丝期茎鞘NSC-成熟期茎鞘NSC)/吐丝期茎鞘NSC× 100
1.3.8 乙烯 参照Beltrano等[23]的方法, 分别取强、弱势粒各10~20粒(灌浆前中期粒数多, 后期粒数少), 置两层潮湿的滤纸间30 min, 以去除籽粒摘下时受损伤所产生的乙烯的影响。然后避光置15 mL青霉素瓶中, 以橡皮塞密封。在室温下(27℃)避光放置12 h。用气密性好的注射器从瓶中抽出1 mL气体注入HP5890型气相色谱仪测定乙烯浓度, 色谱柱为Propark Q (0.3 cm× 200.0 cm, 50~80目), 检测器为氢火焰检测器(FID)。进样口温度为140℃, 柱温为80℃, 检测器温度为200℃。以N2作为载气, 以每分钟30 mL的速度进气, H2和空气作为FID的燃气, 其进气速度分别为30 mL min-1和300 mL min-1。用nmol g-1DW h-1表示乙烯的释放速率。
1.3.9 多胺 参照Flores等[24]方法。取0.5~1.0 g籽粒于预冷的研钵中, 加入3~5 mL 5%高氯酸研磨成匀浆, 置4℃下1 h后以25 000× g离心20 min, 将上清液收集起来, 待苯甲酰化后参照DiTomaso等[25]方法用HPLC测定游离多胺含量。用10 μ L甲醇溶解(60%)样品, 色谱柱为C18反向柱, 4.6 mm× 250.0 mm, 5 μ m, 流速为0.6 mL min-1, 进样体积为20 μ L, 柱温25℃, 检测器为Perkin-Elmer LC-95, 吸收峰为254 nm波长。Spd、Spm和Put为标准品, 1, 6-己二胺作为内标, 每次测定重复3次, 取平均值, 单位为nmol g-1DW。
成熟期取10个挂牌果穗分别考察穗行数、行粒数以及百粒重。按各小区实收计产。
采用Microsoft Excel 2003和SPSS16.0统计软件分析试验数据, 用SigmaPlot 10.0作图。
用最小显著差法(LSD0.05)检验平均数。
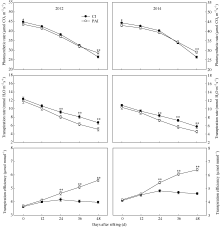
穗位叶水势自吐丝至吐丝后48 d呈下降趋势(图1)。与CI相比, PAI处理下穗位叶水势虽然表现出降低的趋势, 但差异不显著。两年的结果趋势相同。
因灌溉处理从抽雄期开始, 故灌溉方式对单位面积穗数和每穗粒数无显著影响(表1)。与CI相比, PAI处理主要因增加百粒重, 而显著提高了玉米籽粒产量(表1)。
| 表1 抽雄后根系分区交替灌溉对玉米产量及其构成因素的影响 Table 1 Effect of post-tasseling alternate irrigation in partitioned roots on kernel yield and its components of maize |
PAI处理的抽雄后灌溉水量均显著少于CI (表2)。抽雄后PAI处理的平均灌溉水量在2012年和2014年分别较CI处理减少了37.65%和39.24%。与CI相比, PAI处理显著提高了灌溉水利用效率(籽粒产量/玉米整个生长期灌水量)。两年的结果趋势相同。表明抽雄后根系分区交替灌溉既可提高水分利用效率又可增加产量。
| 表2 抽雄后根系分区交替灌溉对玉米水分利用效率的影响 Table 2 Effect of post-tasseling alternate irrigation in partitioned roots on water use efficiency of maize |
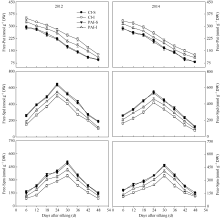
玉米强、弱势籽粒增重动态以及由Richards生长方程拟合的籽粒灌浆速率曲线绘于图2, 籽粒灌浆特征的部分参数列于表3。由图2和表3可知, 无
论是CI处理还是PAI处理, 强势粒的粒重、最大灌浆速率、平均灌浆速率和活跃灌浆期均显著高于弱势粒。与CI相比, PAI显著提高了弱势粒的最终粒重、最大灌浆速率和平均灌浆速率, 对弱势粒的活跃灌浆期和达最大灌浆速率的时间影响不显著, 而对强势粒的以上指标数值均没有显著影响。两年试验结果相一致(图2和表3)。
| 表3 抽雄后根系分区交替灌溉对玉米强、弱势籽粒灌浆特征参数的影响 Table 3 Effect of post-tasseling alternate irrigation in partitioned roots on parameters of kernel-filling characteristics of superior and inferior caryopses of maize |
与籽粒灌浆速率相一致, 玉米强势粒的淀粉积累量及其积累速率显著高于弱势粒(图3)。在两种灌溉方式间比较, PAI显著增加了玉米弱势粒活跃灌浆期内的淀粉积累量、最大淀粉积累速率和平均淀粉积累速率。灌溉方式对强势粒的淀粉积累无显著影响(图3)。
自吐丝至吐丝后48 d, 穗位叶的SPAD值表现
为一直降低的趋势。与CI相比, PAI显著提高了灌浆后期穗位叶的SPAD值(图4), 显著增加了灌浆后期穗位叶的净光合速率(图5), 这与SPAD值(叶绿素含量)的变化趋势相一致(图4)。自吐丝至吐丝后48 d, 穗位叶的光合速率和蒸腾速率在不断降低, 蒸腾效率则呈现出增加的趋势。同时, PAI处理又显著降低了灌浆期穗位叶的蒸腾速率, 进而大幅度地增加了穗位叶的蒸腾效率(图5)。
由图6可知, 随籽粒灌浆进程, 穗位叶SOD活性呈现降低的趋势, 而MDA含量逐渐增加。与CI相比, PAI处理显著提高了SOD活性, 降低了MDA的含量(图6)。说明PAI可以延缓叶片衰老, 进而提高灌浆后期的光合速率(图5)。
在吐丝期, 茎鞘NSC含量在处理间无显著差异(表4)。但在成熟期, PAI显著降低了茎鞘NSC含量。PAI较CI显著提高茎鞘NSC运转量和运转率, 2012年分别高出16.59%和19.30%, 2014年分别高出16.48%和20.00% (表4)。
| 表4 抽雄后根系分区交替灌溉对玉米茎鞘非结构性碳水化合物(NSC)及其运转率的影响 Table 4 Effect of post-tasseling alternate irrigation in partitioned roots on NSC in stem plus sheath and its translocation rate in maize |
由图7可知, 籽粒中乙烯释放速率在灌浆早期很高, 然后急剧下降, 吐丝24 d后缓慢降低。在相同灌溉方式下, 弱势粒的乙烯释放速率显著高于强势粒。与CI相比, PAI显著降低了弱势粒的乙烯释放速率。灌溉方式对强势粒的乙烯释放速率无显著影响, 两年试验结果一致(图7)。
玉米灌浆期籽粒中腐胺(free-Put)含量随着灌浆进程逐渐降低(图8)。在相同灌溉方式下, 弱势粒中的free-Put含量显著高于强势粒。与CI比较, PAI显著降低了弱势粒中free-Put含量, 对强势粒free-Put含量无显著影响。灌浆期籽粒中亚精胺(free-Spd)和精胺(free-Spm)含量均呈单峰曲线变化, 到达峰值含量后又下降, 它们到达峰值的时间分别在吐丝后24 d和30 d。强势粒中的free-Spd和free-Spm含量均显著高于弱势粒。与CI相比, PAI显著提高了弱势粒中free-Spd和free-Spm含量, 对强势粒中free-Spd和free-Spm含量没有明显影响。两年试验结果相同(图8)。
相关分析表明(表5), 籽粒灌浆速率和淀粉积累速率与乙烯释放速率呈显著或极显著负相关(r= -0.42* ~ -0.60* * ), 与free-Put相关性不明显(r = -0.19~ -0.37), 与free-Spd和free-Spm含量呈极显著正相关(r = 0.49* * ~0.90* * ), 表明提高灌浆期free-Spd和free-Spm含量或降低乙烯释放速率, 有利于促进籽粒灌浆和淀粉积累, 进而增加粒重。
| 表5 玉米灌浆期籽粒乙烯释放速率和多胺含量与籽粒灌浆速率及淀粉积累速率的相关系数 Table 5 Correlation coefficients of ethylene evolution rate and polyamine contents with kernel filling rate and starch accumulation rate of caryopses during the kernel filling period of maize |
关于玉米根系分区交替灌溉对产量和水分利用效率影响的研究, 前人已有报道[13, 26, 27]。本试验中玉米抽雄后应用该技术较常规灌溉在产量和水分利用率上在2012年分别增加4.16%和21.59%, 2014年分
别增加5.63%和23.63% (表1和表2)。产量的增加主要在于弱势粒灌浆的改善和粒重的提高。但有关根系分区交替灌溉对玉米强、弱势粒灌浆的影响及其生理机制的研究, 尚未见报道。我们建议将玉米抽雄后根系分区交替灌溉作为促进玉米弱势粒灌浆、提高产量的一项高产节水技术。
为什么玉米抽雄后根系分区交替灌溉可以促进弱势粒灌浆, 进而提高产量?本研究认为, 一个重要原因是延缓了穗位叶的衰老。李国强等[28]提出, 玉米穗位叶面积、鲜重、干重与产量均呈正相关, 其中叶干重与产量呈显著正相关。灌浆结实期叶片光合性能的强弱, 尤其是穗位叶光合产物的多寡, 对籽粒产量具有主导作用。以往的研究表明, 玉米籽粒灌浆物质主要来源于吐丝期至成熟期光合产物的积累(主要是叶片的光合作用)以及吐丝前茎鞘贮存的非结构性碳水化合物(NSC)向籽粒的运转[29]。有报道指出, 玉米籽粒产量与穗位叶的SOD活性呈极显著正相关, 与MDA含量呈极显著负相关[30]。说明玉米穗位叶的衰老程度直接影响籽粒产量。本研究结果显示, 与CI相比, PAI显著提高了穗位叶的SOD活性, 降低了穗位叶MDA含量, 说明PAI延缓了叶片的衰老进程, 进而提高穗位叶灌浆后期叶绿素含量(SPAD值)和光合速率, 加大了光合产物向籽粒特别是弱势粒的供给量。抽雄后根系分区交替灌溉促进弱势粒灌浆的另一个重要原因是促进了茎鞘中储存的光合同化物向籽粒转运。本研究表明, 与CI相比, PAI显著提高了吐丝至成熟期茎鞘NSC的运转量以及运转率, 表明PAI能够促进光合同化物向籽粒转运, 进而促进籽粒特别是弱势粒的灌浆。
从籽粒内部因素分析, 抽雄后根系分区交替灌溉促进弱势粒灌浆还与内源植物激素或植物生长调节物质密切相关。乙烯和多胺是植物生长的重要激素或调节物质, 对植物的生长发育具有重要调控作用[6]。大量研究表明, 内源乙烯和多胺浓度与水稻、小麦的籽粒灌浆密切相关[8, 9, 10, 31]。本研究观察到, 玉米灌浆期强势粒的乙烯释放速率或free-Put含量显著低于弱势粒, 而free-Spd和free-Spm含量显著高于弱势粒; 与CI相比, PAI显著降低了弱势粒中乙烯释放速率和free-Put含量, 显著增加了free-Spd和free-Spm含量。相关分析显示, 籽粒灌浆速率或淀粉积累速率与乙烯释放速率呈极显著负相关, 与free-Spd和free-Spm含量呈极显著正相关。Chen等和Yang等在水稻[31]和小麦[10]上也有类似的研究结果。说明内源乙烯和多胺的相互作用调控禾谷类作物的籽粒灌浆。在PAI条件下, 乙烯释放速率的降低和free-Spd和free-Spm含量的增加促进了玉米弱势籽粒的灌浆, 提高了弱势粒的粒重。
乙烯和多胺是如何调节籽粒灌浆的?其机制尚未明确。有人提出, 乙烯可能是促进了细胞分裂素的降解, 从而抑制胚乳细胞分裂[32, 33]。Yang等[33]观察到, 水稻籽粒中较高的乙烯和1-氨基环丙烷-1-羧酸(ACC, 乙烯生物合成的前体)水平能抑制胚乳细胞分裂, 导致籽粒灌浆充实较差。有学者报道[34], 乙烯能够促进H2O2的产生, 进而抑制植物组织的生长发育。Wang等[9]报道, 乙烯通过抑制水稻籽粒中蔗糖-淀粉代谢途径关键酶活性, 降低淀粉积累速率以及籽粒灌浆速率, 而内源Spd和Spm可以增强水稻籽粒中上述关键酶活性, 从而促进籽粒灌浆。也有人认为, 在乙烯和亚精胺、精胺生物合成过程中, 共享同一个合成前体— — S-腺苷甲硫氨酸(SAM), 增加亚精胺和精胺生物合成就很可能影响乙烯合成速率[35]。乙烯和多胺的拮抗作用调控籽粒灌浆[9, 10]。对于乙烯和多胺调节玉米籽粒灌浆的机制, 仍然需要深入研究。本研究还观察到, 灌溉方式对玉米强势粒的乙烯和多胺浓度、灌浆速率和粒重没有显著影响。其可能原因是强势粒对环境的响应较弱势粒钝感。在本试验条件下, PAI处理未能改变强势粒内源激素水平, 进而不能调节强势粒灌浆。对于玉米强、弱势粒内源乙烯和多胺对PAI响应差异的机制, 亦有待深入探讨。
作物的根系是水分和养分吸收的最主要器官, 其形态和生理特性与地上部的生长发育以及产量和品质密切相关[36, 37, 38, 39, 40]。以往有关根系分区交替灌溉方式对作物根系生长的影响已作了大量研究, 基本明确了在根系分区交替灌溉条件下根系的分布特点、根源脱落酸(ABA)产生及其对植株地上部生长发育的调控作用[41, 42, 43]。本研究由于试验的小区较小, 挖根取样需要损害较多的植株, 故未对根系观察研究。今后需要系统深入研究玉米抽雄后根系分区交替灌溉对根系形态和生理的影响及其与籽粒灌浆的关系。
玉米抽雄后根系分区交替灌溉可以促进弱势粒灌浆, 进而提高产量和水分利用效率。根系分区交替灌溉对强势粒灌浆无显著影响。在根系分区交替灌溉条件下, 弱势粒灌浆的改善和粒重的增加主要得益于穗位叶光合功能期的延长, 茎鞘中NSC向籽粒转运的增加, 弱势粒free-Spd和free-Spm含量的增加及乙烯释放速率的降低。抽雄后根系分区交替灌溉可作为促进玉米弱势粒灌浆的一项调控技术。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|