第一作者联系方式: E-mail: wulinkun6a19@163.com
地黄种植过程中存在严重的连作障碍问题, 连作导致块根无法正常膨大、产量品质下降、土传病害严重等。本研究以正、重茬地黄块根为试验材料, 通过差异蛋白质组学技术分析连作下地黄块根蛋白质表达谱变化, 并进一步采用qRT-PCR技术对锁定的差异蛋白质表达量变化进行验证分析。研究结果发现, 连作导致与块根重要生理代谢过程和主要成分合成相关的蛋白质都下调表达, 与蛋白质折叠相关的伴侣素(chaperonin)在重茬地黄块根中全部下调表达; 连作下与胁迫响应、抵御相关的蛋白质(如pathogenesis-related protein 10, cytochrome P450, Type IIIa membrane protein cp-wap13等)均上调表达。qRT-PCR定量分析证实重茬地黄块根中 PR-10基因表达量显著高于正茬地黄; PR-10基因在尖孢镰刀菌病原菌侵染下能够明显被诱导表达, 表达量随着侵染时间的增加而逐渐升高, 验证了差异蛋白质组学分析的结果。可见连作胁迫对地黄块根蛋白质表达谱有显著影响, 导致蛋白质表达紊乱, 连作植株生理代谢过程异常, 碳水化合物和能量代谢缓慢, 产生连作障碍效应。
Rehmannia glutinosa L. is widely applied in Chinese medicine. However, consecutive monocropping of this plant results in serious decline in both biomass and quality of underground tubers, with poor field performance and insufficient resistance to disease and pest. In the present study, the tuber roots from the newly planted (NP) and consecutively monocropped (SM) R. glutinosa were used through comparative proteomics analysis to study the response of R. glutinosa to consecutive monocropping and the underlying mechanisms of replanting disease. Comparative proteomics analysis showed that these proteins involved in important physiological processes and biosynthese of main components in tuber roots were significantly down-regulated under consecutive monocropping regime. It was also found that chaperonins related to protein folding was down-expressed with the extended monocropping. However, these proteins related to stress response/defense such as pathogenesis-related protein 10, cytochrome P450 and Type IIIa membrane protein cp-wap13 were up-regulated in consecutively monocropped R. glutinosa. Quantitative analysis by qRT-PCR confirmed the up-regulation of PR-10 responding to consecutive monocropping or the infection of pathogenic Fusarium oxysporum.Moreover, PR-10was gradually up-regulated with the increasing days of infection. In conclusion, consecutive monocropping of R. glutinosa greatly affects the expression profile of proteome in tuber roots. These abnormally expressed proteins might lead to the metabolic disturbances and low energy production. Moreover, the limited energy is applied to resist the external environmental stresses, resulting in significant decline in the growth of tuber roots and the accumulation of active ingredients.
连作障碍(consecutive monoculture problem), 也称为自毒作用、重茬问题或土壤病, 是指即使正常的田间管理措施下, 连续多年种植相同或相似植物于同一地块会造成生长发育不良、病虫害严重、产量品质下降的化学生态学现象。目前, 随着现代农业的发展, 规模化、集约化、单一化连续种植模式十分普遍, 其造成的损失也是十分巨大的, 而且这一趋势正逐年严重。长期困扰我国农业生产的连作障碍问题, 在地黄、人参等中药材栽培生产中表现尤为严重, 约70%的块根类药用植物都存在不同程度的连作障碍问题[1]。地黄(Rehmannia glutinosa Libosch.)为玄参科地黄属多年生草本药用植物, 其药用历史悠久, 有重要药用价值。但地黄连作导致药用部位— — 块根无法正常膨大, 产量、品质严重下降, 甚至造成绝收。通常每茬收获后同一地块需间隔8~10年后方可再种, 这严重制约了我国中药资源的可持续发展与利用。更为严重的是, 在连作障碍机制尚不清楚的情况下, 农户往往通过滥施化肥、滥用农药来试图维持产量, 但是效果不佳, 而且带来了中药材农残超标、污染环境等一系列问题。因此, 探究药用植物连作障碍发生的机理和寻求克服或缓解措施已成为亟待解决的问题。
国内外有关植物连作障碍机制的研究主要聚焦于土壤养分匮乏或失调; 根系分泌物的化感自毒作用; 根际微生物群落结构失衡3个方面。但是越来越多的研究结果认为, 土壤肥力不是主要因素, 而且许多研究结果表明连作土壤主要营养元素的含量并不随着种植年限的增加而下降, 这也在我们对地黄连作的研究中得到了证实[2]。至于根系分泌物的化感自毒效应方面, 先前的研究都主要采用生测法来直接评价对靶标受体植物生长的影响, 此方法不仅忽略了土壤物理化学因素对根系分泌物活性的影响如土壤吸附迁移等过程, 还忽视了土壤微生物的加工、转化及降解等过程[3]。近年来, 越来越多的研究认为连作障碍是由根系分泌物介导下的根际微生态结构恶化造成[4], 地黄连作同样也造成根际微生物群落结构失衡, 导致病原菌大量生长, 引发障碍效应[2, 5]。
根际微生态环境恶化势必影响地黄块根的正常生理代谢及胁迫响应过程, 研究地黄块根连作下的蛋白质表达谱变化反之可为揭示地黄连作障碍的形成机理提供根据。前人研究表明, 单一化栽培模式下, 地黄植株能够通过miRNAs调控因子来调控靶基因的表达模式, 以应对源自土壤中的环境胁迫因子[6]。但是, 蛋白质才是细胞活性和功能的最终执行者, mRNA与蛋白质之间并不是一一对应的关系, 初始mRNA转录物经过加工与修饰后才能形成成熟的mRNA。迄今, 有关地黄响应连作胁迫的块根蛋白质表达谱变化的研究未见报道。因此, 本研究基于前期优化确定的最佳地黄块根总蛋白提取与分离方法, 对正、重茬地黄块根蛋白质表达谱差异进行分析, 以锁定关键蛋白质, 并通过qRT-PCR技术验证分析在分离筛选的特异病原微生物作用下关键蛋白质表达量的变化趋势, 以进一步研究土壤环境灾变(如土传病原菌)对地黄植株生长发育的影响以及地黄响应连作逆境胁迫的生物学过程。研究结果可为揭示地黄连作障碍的形成机制及探究植物-微生物根际互作等提供理论依据。
以广泛种植的温85-5怀地黄为试验材料。在道地产区河南省焦作市温县农业科学研究所(34o56° N, 112o58° E)进行试验。设置正茬(头茬种植, 对照组)与重茬(连作2年, 试验组) 2个处理。在同一地块的不同小区中种植对照组与试验组, 以保证土壤质地、微气候条件等相同。地黄整个生长发育期间, 水分、肥料等措施管理保持一致。地黄块根膨大中期取块根样品, 洗净剪碎后立即用液氮速冻, 放入-80℃冰箱保存备用。
基于前期优化确定的最佳地黄块根总蛋白提取与分离方法[7], 对正、重茬地黄块根蛋白质进行提取与分离。设置3次生物学重复, 基于银染图谱进行差异表达统计分析(n=3), 基于考染图谱进行差异蛋白点质谱鉴定。
采用胰岛素酶酶解差异蛋白点, 采用MALDI TOF-TOF MS进行二级质谱鉴定。参照李奇松等[8]的方法。比对数据库时, 参数设置如下: 数据库为NCBInr全库, 胰酶消化, 最大允许漏切位点为1, 母离子质量偏差容忍度为100× 10-6, MS/MS二级肽段质量偏差为0.6 Da, 固定修饰为半胱氨酸酰胺甲基化, 可变修饰为甲硫氨酸氧化。
成功鉴定的蛋白质根据KEGG (Kyoto Encyclopedia of Genes and Genomes, http://www.genome. jp/kegg/)数据库进行功能归类, 进一步借助Uniprot (http://www.uniprot.org/)数据库进行Gene Ontology (GO)注释分析, 并用WEGO (http://wego.genomics. org.cn/cgi-bin/wego/index.pl)工具制图[9]。
取正重茬地黄块根各100 mg用RNAprep Pure Plant Kit试剂盒(TIANGEN, 北京)按照说明书提取总RNA, 用Nanodrop 2000C Spectrophotometer (Thermo Scientific, USA)测定浓度。取等量总RNA用TIANScript RT Kit试剂盒(TIANGEN, 北京)分别进行逆转录, 合成cDNA第1链。
经差异蛋白质组学及蛋白功能分析, 锁定2个连作胁迫下发生显著差异表达的蛋白质, 即病程相关蛋白(pathogenesis-related protein 10, PR-10蛋白, 序列已登入NCBI)和S-adenosylmethionine (SAM)合成酶, 进一步运用实时荧光定量PCR (qRT-PCR)技术进行表达量变化验证。PR-10蛋白特异引物序列为PR-F (5'-GCCGGAATTCATGGGTATCACCAAAC ACATCC-3')和PR-R (5'-TTACTCGAGGGCGCAGA CATTAGGATTGGCAT-3')。以Actin作为内参基因, 引物序列为AT-F (5'-CAACCCCAAGGCAAACAGA -3')和AT-R (5'-GGCAAGATCCAAACGCAAG-3')。荧光定量PCR体系含2× SuperRealPreMix Plus (含SYBR Green I) 7.5 μ L、引物各0.6 μ L、cDNA模板0.45 μ L、RNase-Free ddH2O 5.85 μ L。荧光定量PCR扩增条件为95℃预变性10 min, 95℃变性10 s, 64℃退火20 s, 72℃延伸30 s, 40个循环, 在每个循环的延伸阶段检测荧光信号。SAM合成酶基因qRT-PCR分析的特异引物及扩增程序参考范华敏等[10]。采用2-Δ Δ Ct法计算正重茬PR-10与SAM合成酶基因表达量差异。
课题组前期从地黄连作土壤和发病植株中高频筛选到多株尖孢镰刀菌病原真菌[5], 本研究将分离到的一株专化型尖孢镰刀菌活化培养后, 接种至地黄组培瓶中(离苗根部1.5 cm处接种), 动态观察尖孢镰刀菌对地黄组培苗的侵害。同时, 动态取地黄组培苗样品以验证分析尖孢镰刀菌侵染下地黄PR-10基因表达量的变化趋势。总RNA提取、逆转录、qRT-PCR步骤同1.5。
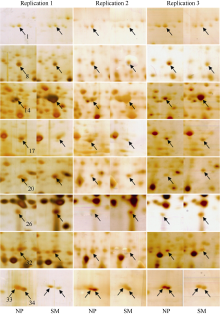
基于优化建立的双向电泳体系, 分别构建了正、重茬地黄块根蛋白质表达图谱(图1)。Scatters Plot分析发现正重茬地黄块根蛋白图谱的平均相关系数达0.812, 可见正重茬地黄块根具有相似的蛋白质点分布信息, 二者的主要差异在于蛋白质表达量的变化。
采用生物统计学方法, 分析正重茬块根蛋白质表达丰度, 共发现37个蛋白质点的相对丰度显著变化(表1和图2)。与正茬相比, 重茬块根中有6个蛋白质上调表达, 31个蛋白质下调表达。经MALDI TOF-TOF MS质谱分析, 共成功鉴定出34个蛋白质(表1)。
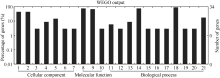
Gene Ontology (GO)分析发现, 所有成功鉴定的蛋白质按细胞组成(cellular component)、分子功能(molecular function)、生物过程(biological process)可分别分为7类、3类和11类。细胞组成中, 细胞和细胞组分所占的比例最高; 分子功能中, 结合和催化所占的比例最高; 生物过程中, 细胞过程和代谢过程所占的比例最高(图3)。
进一步, 运用KEGG数据库对成功鉴定的蛋白质进行功能归类, 共分为10类(表1): (1)碳水化合物/能量代谢(5个, 蛋白点2、5、13、28、31); (2)氨基酸代谢(8个, 蛋白点3、17、18、19、21、24、32、34); (3)核酸代谢(1个, 蛋白点29); (4)淀粉代谢(3个, 蛋白点11、12、25); (5)萜类代谢(1个, 蛋白点4); (6)蛋白质代谢(9个, 蛋白点7、8、9、10、15、16、27、30、33); (7)异源物质代谢(1个, 蛋白点20); (8)胁迫响应(3个, 蛋白点14、22、26); (9)信号传导(1个, 蛋白点23); (10)未知功能(2个, 蛋白点1、6)。其中, 蛋白质代谢相关的差异蛋白点所占比例最大, 为26.5%, 其次为氨基酸代谢相关(23.5%)和碳水化合物代谢相关(14.7%)蛋白质(图4)。
| 表1 正重茬地黄块根差异蛋白质质谱鉴定结果 Table 1 Differentially expressed proteins identified by MS or MS/MS |
结合蛋白点相对表达丰度可以看出, 连作下, 地黄块根中与碳水化合物代谢、氨基酸代谢、核酸代谢、淀粉代谢、萜类代谢、蛋白质代谢相关的蛋白质几乎都下调表达, 尤其发现与蛋白质折叠相关的伴侣素(chaperonin)在重茬块根中全部下调表达。然而, 重茬块根中与异源物质代谢相关、胁迫响应相关、信号传导相关的蛋白质全部上调表达, 尤其发现一个病程相关蛋白(pathogenesis-related protein, PR蛋白)显著上调表达(表1)。可见, 地黄块根受到连作胁迫因子的影响, 与胁迫响应相关的蛋白质(如PR蛋白)上调表达, 而与块根重要生理代谢过程相关(如与能量代谢、氨基酸、蛋白质代谢相关)和与块根主要成分合成相关的蛋白质(如与淀粉合成、萜类合成相关)都下调表达。
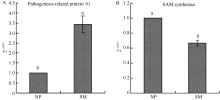
基于地黄PR-10基因(GenBank登录号为EU526395.1)和Actin基因(GenBank登录号为EU526396.1)序列, 设计了qRT-PCR定量分析的特异引物, 由图5可以看出, PR-10基因的引物(PR-F、PR-R)与Actin基因的引物(AT-F、AT-R)特异性均较好, 无其他非特异性条带, 扩增产物测序后均显示序列正确, 故适合qRT-PCR分析。差异蛋白质组学分析发现, 重茬块根中PR-10蛋白的表达丰度显著高于正茬地黄, 约是正茬的4倍(表1), 而qRT-PCR结果与之类似, 在转录水平上, 重茬地黄块根中PR-10基因的表达量约是正茬的3.4倍(图6)。同样, S-adenosylmethionine (SAM) synthetase的qRT-PCR定量分析结果也与差异蛋白质组学结果表现一致, 均出现下调表达。
 | 图5 地黄PR-10基因(A和B)和Actin基因(C和D)qRT-PCR扩增曲线与熔解曲线Fig. 5 Amplification and dissolving curves for PR-10(A and B) and Actin genes(C and D) |
前期分离筛选的专化型尖孢镰刀菌能够快速侵害地黄组培苗生长, 侵染第7天时, 发现组培苗植株开始表现轻微病害症状, 即出现轻微的发黄枯萎现象; 第9天时, 茎出现倒伏, 叶片严重黄化; 之后症状不断加重, 并且发病植株上有大量尖孢镰刀菌菌丝出现(图7)。
通过qRT-PCR技术对尖孢镰刀菌侵染下地黄PR-10基因表达量动态分析, 发现随着侵染时间的增加, 地黄组培苗中PR-10基因的表达量也不断增加(图8), 再次验证了蛋白质组学的结果, 说明连作胁迫(如病原菌侵染)下PR-10蛋白显著上调表达, 参与了地黄连作胁迫的响应, 推测田间连续种植模式下PR-10蛋白上调表达可能与连作地黄的根际微生态结构失衡、病虫害加重有关。
植物根部是“ 植物-土壤-微生物” 微生态系统中的一个重要参与者, 是连接植物地上部与地下部的关键部位, 是土壤微生物影响植物生长的重要介质, 也是植物感应土壤理化性质及生物学特性变化的窗口。研究植物根系在逆境胁迫(如连作胁迫)下的蛋白质表达谱变化, 可为揭示药用植物连作障碍形成的机制及其探索合理有效的消减策略或是进行遗传改良等提供一定的理论依据。
本研究基于前期优化建立的块根蛋白质提取及分离方法, 分别构建了正、重茬地黄块根蛋白质表达图谱, 进一步通过差异蛋白质组学技术分析发现, 连作下地黄块根蛋白质表达谱明显变化, 涉及碳水化合物、淀粉代谢、萜类代谢、氨基酸代谢、核酸代谢、蛋白质代谢、胁迫响应以及信号传导等代谢途径(表1)。本研究共鉴定到5个碳水化合物和能量代谢相关的蛋白质, 分别涉及糖酵解(如phosphoglycerate mutase、phosphoglycerate kinase等)、三羧酸循环(malate dehydrogenase)和氧化磷酸化(NADH-ubiquinone oxidoreductase)。它们在重茬地黄块根中的表达量都显著低于正茬地黄。同时, 发现3个淀粉合成和分解代谢相关的(如UDP-glucose 6-dehydrogenase、phosphoglucomutase等)和1个萜类化合物合成相关的蛋白质(4-hydroxy-3-methylbut- 2-enyl diphosphate synthase)在重茬地黄块根中都下调表达。化学成分分析表明, 地黄块根中富含甙类化合物, 其中又以环烯醚萜甙类(属于单萜类化合物)为主[11]。本试验鉴定到一个与萜类化合物骨架合成相关的蛋白质在连作地黄块根中其表达量显著下降, 这可能也是连作下地黄块根药效成分含量下降、品质降低的一个重要原因。
本研究还鉴定到1个核酸合成相关蛋白质(UDP-glucose 4-epimerase)和大部分氨基酸代谢相关的蛋白质(如serine hydroxymethyltransferase、methionine synthase、S-adenosylmethionine synthase、betaine aldehyd dehydrogenase等), 除Glutamate dehydrogenase 2外, 它们在重茬地黄块根中都下调表达。尤其发现, 鉴定到的3个S-腺苷甲硫氨酸合成酶(S-adenosylmethionine synthase)全部下调表达(表1和图6)。S-腺苷甲硫氨酸合成酶是植物细胞代谢过程中十分关键的一个酶, 能催化甲硫氨酸和ATP反应生成S-腺苷甲硫氨酸(SAM)。SAM具有很多重要的生物学功能, 是细胞生化反应的主要甲基供体, 涉及植物的转甲基、转氨丙基、转硫反应等重要的生理代谢过程, 这些反应对细胞结构和功能发挥都至关重要。SAM也是乙烯及多胺生物合成的前体, 众所周知乙烯是植物生长调节剂, 参与调控很多的生理生化反应, 而多胺在控制植物形态建成、调节植物生长发育、提高植物抗逆性、延缓衰老等方面发挥重要功能[12]。与此同时, 本研究还发现大量与蛋白质代谢, 如蛋白质翻译后加工(mitochondrial processing peptidase)、蛋白质折叠相关的蛋白质(如chaperonin CPN60-1、heat shock 70 kD protein、chaperonin containing t-complex protein 1、T-complex protein 1 subunit等)在重茬地黄中全部下调表达。伴侣素(chaperonin)是分子伴侣(chaperone)中的一种, 它可以和部分折叠或没有折叠的蛋白质分子结合, 稳定它们的构象, 并能引导蛋白质正确折叠, 形成具有功能的成熟蛋白质。伴侣素表达异常, 可导致很多蛋白质无法正确折叠而失去正常功能, 或者在胁迫条件下出现热休克或失活无法及时在分子伴侣的协助下恢复到其自然状态, 这就造成细胞内很多关键蛋白质表达异常或者失去功能, 从而引发不良生理响应。可见, 连作下参与植物体内重要生理代谢过程的蛋白质, 如能量代谢、淀粉合成、萜类合成、核酸合成、氨基酸代谢、蛋白质代谢相关的蛋白质都下调表达, 导致植物细胞生理生化反应异常, 影响生命活动的重要过程和核心途径, 这与连作地黄植株生长缓慢、根系活力降低、块根无法正常膨大、药效成分含量下降等连作症状相吻合。
然而, 重茬块根中与异源物质代谢相关(cytochrome P450)、胁迫响应相关(如pathogenesis-related protein、xylose isomerase、Type IIIa membrane protein cp-wap13、glutamate dehydrogenase 2)、信号传导相关的蛋白质(auxin-induced protein)全部上调表达。细胞色素P450 (cytochrome P450)是一类血红素— — 硫铁蛋白, 对内源性和外源性物质, 尤其是对环境有害化学物质具有氧化代谢作用, 它在保护植物免受有害物质侵害方面具有重要作用。研究也发现, 机械损伤、杀虫剂、重金属离子等环境毒物以及病原菌对植物细胞色素P450有明显的诱导作用[13]。Li等[14]研究发现, 小麦受到病原菌Fusarium asiaticum侵染时, 其细胞色素P450基因表达量极显著上调, 并且发现这与病原真菌产生的毒素DON有关, 可见细胞色素P450在植物解毒与抵御生物、非生物胁迫方面发挥着重要作用。本研究还发现2个与植物细胞壁合成相关的基因(xylose isomerase、Type IIIa membrane protein cp-wap13)都上调表达。Mao等[15]发现, 铝毒诱导下, 木糖异构酶(xylose isomerase)显著上调, 该酶能够催化D-木酮糖转化为D-木糖, 而D-木糖是半纤维素的主要成分, 这与铝毒诱导下植物细胞壁中半纤维素沉积的现象表现一致。研究也报道, 细胞壁中的半纤维素和果胶乙酰化对植物抵御病原菌侵害有重要作用[16]。另一个与细胞壁合成相关的蛋白— — Type IIIa membrane protein cp-wap13属于reversibly glycosylated polypeptide (RGP)家族, 该蛋白与细胞壁多糖合成相关, 研究发现, 接种Trichoderma harzianum T22的玉米幼苗中该蛋白表达量上调, 推测这可能与细胞壁沉积变厚从而把真菌限制在外表层有关[17]。与此同时, 本研究还鉴定到一个病程相关蛋白(pathogenesis-related protein 10, PR-10)在重茬地黄块根中其表达量显著上调。PR蛋白是指由植物寄主基因编码, 在病理或病理相关的环境条件下诱导表达的一类蛋白质, 已发现的PR蛋白可归为17类, 即PR-1到PR-17, 其中PR-10具有体外核酸酶活性和抗菌活性[18]。PR蛋白的产生与积累是植物体响应外界生物、非生物胁迫的重要特
征与途径[19]。已有研究表明, PR-10基因与植物抗病、次生代谢等密切相关[20], 同时具有配体(如细胞分裂素、植物固醇等)结合能力, 被认为在信号传递中发挥作用[21]。连作下, 地黄块根中PR-10蛋白表达量上调可能与重茬地黄根际的微环境恶化、病虫害加重等有密切关系。本研究还进一步运用qRT- PCR技术在转录水平上对PR-10蛋白的表达量变化加以验证, 发现重茬地黄块根中的PR-10基因表达量显著高于正茬地黄(图6)。课题组前期研究确实发现, 地黄连作下土壤微生态结构恶化, 造成病原微生物(如尖孢镰刀菌)大量生长[2, 5], 所以本研究也分析了病原菌— — 尖孢镰刀菌侵染下地黄组培苗体内PR-10基因表达量的变化, 结果显示组培苗PR-10基因能够明显被病原菌诱导表达, 且表达量随着侵染时间的增加而逐渐升高(图8), 验证了差异蛋白质组学分析的结果。
前期分离筛选的专化型尖孢镰刀菌对地黄组培苗有严重的侵染致病作用, 同时发现地黄连作胁迫对块根蛋白质表达谱有显著影响。连作下地黄块根由于受到了胁迫因子的影响, 如病原菌侵染等, 导致与胁迫响应、抵御相关的蛋白质(如pathogenesis- related protein、cytochrome P450、Type IIIa membrane protein cp-wap13等)上调表达, 而与块根重要生理代谢过程相关(如能量代谢、氨基酸、蛋白质代谢)和与块根主要成分合成相关的蛋白质(如淀粉合成、萜类合成)都下调表达, 尤其与蛋白质折叠相关的伴侣素(chaperonin)在重茬地黄块根中全部下调表达, 这可能造成连作地黄生理代谢过程表现异常, 细胞活性下降, 碳水化合物和能量代谢缓慢, 而且有限的能量都用于抵御外界环境胁迫, 块根无法膨大, 药效成分无法积累, 品质下降, 最终表现出障碍效应。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|