第一作者联系方式: E-mail: yuailimail@126.com
CIPK是一类丝氨酸/苏氨酸蛋白激酶, 该蛋白在植物响应逆境胁迫过程中发挥重要作用。本文利用生物信息学方法从谷子基因组中鉴定出2个 CIPK基因, 命名为 SiCIPK6和 SiCIPK16。序列分析表明 SiCIPK6基因组序列长1994 bp, 编码451个氨基酸; SiCIPK16基因组序列长1885 bp, 编码473个氨基酸, 2个基因均无内含子和可变剪切。生物信息学分析显示这2个基因在蛋白质序列和结构上与其他物种 CIPK基因一样非常保守。实时定量PCR分析表明 SiCIPK6和 SiCIPK16在ABA、低温、高温、干旱、高盐诱导下表达量均有所上调, SiCIPK6基因在ABA、干旱和盐处理时表达量上调幅度较大, 而 SiCIPK16基因在低温、干旱和高温处理时表达量上调幅度较大。半定量PCR检测结果表明 SiCIPK6和 SiCIPK16两个基因在拔节、孕穗、灌浆期时均有表达, 在相应生育时期受到干旱胁迫时它们表达量均有所提高。推测 SiCIPK6和 SiCIPK16基因在谷子的干旱或其他逆境胁迫中起一定作用。
CIPK (CBL interacting protein kinase) is a type of serine or threonine protein kinases, which plays an important role in response to stress. In this study, we identified two CIPKgenes designated as SiCIPK6and SiCIPK16from foxtail millet ( Setaria italica) genome using bioinformatics methods. The sequence analysis showed that SiCIPK6 has a length of 1994 bp in the genome, encoding 513 amino acids residues, and SiCIPK16 is 1885 bp, encoding 473 amino acids residues. These two genes have no alternative splicing and intron. The characters predicted based on the bioinformatics analysis revealed that the protein sequences and structure of the two SiCIPK genes were very conservative just like CIPKgenes in other species. Real-time PCR analysis discovered that the expression of SiCIPK6 and SiCIPK16 was up-regulated by ABA, cold, heat, drought and salt stress, respectively. The expression was strongly induced by ABA, drought and salt treatments for SiCIPK6, and by cold, drought and heat treatments for SiCIPK16. The semi-quantitative PCR analysis showed that SiCIPK6 and SiCIPK16 were expressed at the jointing, booting and filling stages, and induced by drought stress in the corresponding growth period. Foxtail millet CIPKgenes reported in this study would enrich CIPK members in plant kingdom and provides important information for further elucidating the function and mechanisms of the CBL/CIPK network system responsive to stresses in foxtail millet.
谷子[Setaria italica (L.) P. Beauv.]起源于我国黄河流域, 由狗尾草经人工选择和进化而来, 在我国已有8500多年的栽培史, 目前是我国干旱和半干旱地区广泛种植的区域性特色资源作物[1]。谷子是C4作物, 种子发芽需水少、蒸腾系数低、净光合强度和水分利用效率高, 具有抗逆性强、适应性广等特点, 而且谷子基因组小, 高度保守、稳定, DNA重复度低, 是抗逆遗传和分子生物学研究的理想材料[2, 3]。近年来随着国内外谷子测序工作的完成以及谷子全基因组序列的公布, 谷子耐逆关键基因发掘和逆境应答调控机制逐渐成为研究热点。
非生物逆境下胁迫会严重影响植物的萌发、幼苗存活、生物产量、叶片展开度、光合作用强度以及生长发育, 严重的还会导致植株死亡[4, 5]。研究表明非生物逆境胁迫中的干旱、盐渍、低温对植物的影响最为明显, 是制约农作物产量和品质的主要限制因素[6]。在非生物逆境胁迫下植物不仅要感知逆境, 而且要把逆境信号传递下去, 激活下游的信号通路来应对不利环境。Ca2+是众所周知的第二信使, 能够感知逆境的发生并且能够传递信息启动逆境应答机制[7, 8]。CBL (calcineurin B-like protein)是一类钙离子感应蛋白, 能够感知细胞内钙离子浓度变化, 然后与其靶蛋白CIPK (CBL-interacting protein kinase)互作, 构成的复合物能够把胁迫信号传递下去, 启动细胞内相关应答基因的转录和翻译来应对胁迫[9]。
CIPK是一类丝氨酸/苏氨酸蛋白激酶, 在植物体内以多基因家族方式存在, 在苔藓、蕨类、裸子植物以及单子叶和双子叶植物中都发现有CIPK和CBL家族基因存在[10, 11, 12]。CIPK基因在响应逆境胁迫、病原体与防御反应、营养元素吸收与平衡、激素应答等植物生长和发育过程中发挥着重要的作用, 尤其与非生物逆境胁迫的信号传导密切相关[13]。拟南芥AtCIPK24 (SOS2)参与盐胁迫应答信号途径, SOS2通过与钙结合蛋白AtCBL4 (SOS3)互作, 分别在液泡膜和质膜上行使各自功能保护植株免受盐胁迫的伤害[14, 15, 16, 17, 18, 19]。AtCBL1/AtCBL9-AtCIPK23和AKT1互作通过磷酸化/去磷酸化机制调控质膜K+通道的活性和细胞K+吸收从而维持胞内K+平衡[20, 21]。AtCIPK8被高浓度硝酸盐快速诱导, 通过控制硝酸盐转运体CHL1和NRT2.1的表达水平正调控硝酸盐的低亲和应答, Atcipk8突变后抑制硝酸盐响应基因及硼转运体BOR1的表达[22]。小麦TaCIPK14、TaCIPK29和玉米ZmCIPK21被报道在盐胁迫条件下会在钠离子转运、ROS代谢, 钾离子平衡和ABA信号传导方面起一定作用[23, 24, 25]。水稻OsCIPK23和OsCBL1已被证实能激活水稻OsAKT1[26], 另外葡萄中的VvKT1.1和VvKT1.2也被证明在灌浆期会受到CBL和CIPK的调控[27, 28]。ZmCIPK16被证明在盐胁迫条件下能够部分代替AtCIPK24的功能[29]。到目前为止针对CBL和CIPK开展的主要研究领域聚焦在证明CBLs和CIPKs的互作以及他们互作的位置和突变体在不同逆境胁迫下的表型分析, 因此解析CBLs和CIPKs功能要基于对CIPK和CBL组成的信号网络系统的充分了解, 首先要清楚CIPKs参与了哪些逆境胁迫应答, 在哪些逆境信号通路中起作用。
已有研究表明CBL/CIPK信号网络系统在植物对逆境应答过程中起重要作用, 加之谷子是我国典型的抗旱耐瘠特色作物, 因此研究谷子的CIPK基因, 发掘谷子抗逆相关基因在分子水平上阐明谷子耐逆机理和调控机制具有重要的理论意义和广阔的应用前景。目前在许多作物中均发现了CIPK基因家族, 谷子中仅有CBL被报道[30], CIPK基因尚未见被报道。本文通过生物信息学方法从谷子数据库中得到2个谷子CIPK基因, 我们对这2个基因的结构、序列特征进行了预测和分析, 研究了它们在幼苗期不同逆境胁迫下的动态表达模式及在拔节、抽穗、灌浆等生育时期受到干旱胁迫时的表达情况, 旨在为进一步分析CIPK基因在谷子逆境应答中的功能和机制提供一些有益线索。
以豫谷1号为试验材料, 当幼苗生长至三叶期时按照已有研究描述的方法[31, 32, 33]分别进行ABA (100 μ mol L-1)、低温(4℃)、高温(42℃)、干旱、盐(250 mmol L-1 NaCl)处理, 在处理的0、1、3、6、12和24 h取整株幼苗。另外, 当植株生长至拔节、抽穗、灌浆期时, 采用自然控水方式至植株叶片微卷、叶色由鲜绿色变为灰色呈现缺水状态时取处理及对照样品叶片, 立即在-80℃冰箱中速冻备用。试验设2次生物学重复, 所用TRIzol、Real-time PCR试剂盒、逆转录酶、LA Taq DNA聚合酶和RNA酶抑制剂购自宝生物工程有限公司; 引物由生工生物工程(上海)有限公司合成; 其他试剂购自生工生物工程(上海)有限公司。
参照TRIzol试剂盒使用说明用TRIzol试剂提取所有材料总RNA, 参照《分子克隆》第3版配制其他所需试剂[34]。根据SiCIPK、SiGAPB转录序列, 用软件Primer Primer 5.0设计SiCIPK、SiGAPB的Real-time PCR和半定量PCR特异性引物。
利用玉米中已鉴定CIPK基因序列进行比对, 在JGI谷子数据库(Ver. 2.1)发现了2个CIPK基因(SiCIPK6、SiCIPK16)。利用ExPASy中ProtParam pI/Mw在线工具对蛋白序列的理化性质、氨基酸组成等一级结构进行预测; 利用SignalP 4.1 Server进行信号肽分析; 利用ProtScale进行疏水性/亲水性预测、Profun 2.2 Server进行功能预测; 利用Psort在线工具对编码蛋白亚细胞定位进行预测, GOR IV对蛋白进行二级结构预测; 使用Blast工具在NCBI上查找氨基酸同源性序列。利用ClustalX1.83对候选基因序列比对分析, 利用Mega4.1软件构建不同物种CIPK基因进化树并比较分析[35]。
用半定量RT-PCR检测SiCIPK基因在不同生育期干旱胁迫下的表达情况。用分光光度计定量测定每个样品总RNA的浓度和质量。总RNA经反转录后对PCR条件进行预实验和优化, 根据预试验中基因PCR产物的线性增长范围确定循环数27, 反应体积25 μ L, PCR反应程序为94℃ 3 min; 94℃ 30 s, 57℃ 30 s, 72℃ 30 s, 27个循环; 72℃ 5 min。以谷子持家基因3-磷酸甘油醛脱氢酶基因B亚基(SiGAPB, Si035707m)为RT-PCR对照。反应产物(15 μ L)经琼脂糖凝胶电泳分离。
将TRIzol法提取总RNA样品反转录合成cDNA, 均一化后作为实时定量PCR模板, 以SiGAPB作为内参基因。经预实验优化后PCR反应程序为: 50℃ 2 min; 95℃ 2 min; 94℃变性30 s, 61℃退火30 s, 读版65℃ 1 s, 读板, 40个循环; 72℃延伸5 min; 绘制熔解曲线, 0.2℃ s-1。试验设计3次重复, 采用相对定量2-Δ Δ Ct方法计算基因在某种逆境处理下某个时间点相对于对照的转录水平变化[36]。
通过NCBI数据库比对从谷子数据库中得到2个谷子CIPK基因, 序列比对结果显示这2个基因和玉米、水稻CIPK基因家族中的CIPK6和CIPK16同源性较高, 因此分别暂时命名为SiCIPK6和SiCIPK16。SiCIPK6基因组序列长1994 bp, CDS序列1356 bp, 编码451个氨基酸; SiCIPK16基因组序列长1885 bp, CDS序列1422 bp, 编码473个氨基酸(表1), 2个基因均无可变剪切和内含子。功能域分析显示2个基因蛋白都含有NAF结构域(与CBL蛋白互作的必需), 另外还含有丝氨酸/苏氨酸激酶域、ATP结合位点、蛋白磷酸化位点和信号转导位点等多个CIPK基因的特征结构域。因此推断SiCIPK6和SiCIPK16是谷子CIPK家族中的2个成员。
| 表1 SiCIPK6, SiCIPK16和他们的同源基因参数及研究背景 Table 1 Paremeters and research background of SiCIPK6, SiCIPK16 and their homologous genes |
2.2.1 SiCIPK蛋白参数分析 SiCIPK6蛋白分子式为C2149H3453N641O628S16, 分子量为48.83 kD, 等电点(pI) 9.14, 平均疏水性(GRAVY) -0.197, 脂肪系数(AI) 86.08。SiCIPK16蛋白分子式为C2266H3620N664O664S18, 分子量为51.37 kD, 等电点(pI) 8.81, 平均疏水性(GRAVY) -0.125, 脂肪系数(AI) 87.27。GOR IV软件预测2个蛋白无规则卷曲所占的比例最高, 其次是α -螺旋和延伸链, 不含β -螺旋。根据SignalP 4.1 Server软件预测结果可推测SiCIPK6和SiCIPK16基因所编码的蛋白不存在信号肽为非分泌蛋白, 它们在细胞质中合成后可能不被运转。ProtScale软件预测2个蛋白均为弱亲水性蛋白。Psort软件预测SiCIPK6蛋白据其概率大小依次可能存在于质膜、高尔基体、内质网(膜)、微体(过氧物酶体); 而SiCIPK16蛋白可能存在于内质网(膜)、质膜、微体(过氧物酶体)、叶绿体类囊体膜。
2.2.2 谷子SiCIPK基因启动子区域顺式元件分析和功能预测 顺式元件分析发现在SiCIPK6和SiCIPK16启动子区域主要包括激素类应答元件, 逆境类应答元件, 光应答元件以及其他类元件, 包括厌氧诱导必需(ARE)、细菌激发应答(Box-Wi)、分生组织特异性激活(CCGTCC-box)、胚乳表达(GCN4-motif、SKn-1 motif)、昼夜节律(circadian)元件(表2)。Profun 2.2 Server软件预测显示SiCIPK6和SiCIPK16可能参与调控转录调控、信号转导、逆境应答、免疫应答等生理过程, 也可能参与生长因子、激素、离子通道蛋白、受体、结构蛋白等代谢途径。
| 表2 SiCIPK6、SiCIPK16基因启动子区域顺式元件预测 Table 2 Putative cis-elements in the promoter of SiCIPK6 andSiCIPK16 |
图1所示在5种胁迫处理下2个基因在不同时间点表达量不尽相同, 总的来看在诱导过程中表达量均有所上调。SiCIPK6基因在ABA、干旱和NaCl处理时表达量上调幅度较大, 分别在1、24、1 h达到表达量的最大值, 相对表达量分别是对照的4.65、6.42、7.46倍。SiCIPK16基因在低温、干旱和高温处理时表达量上调幅度较大, 在1、24、1 h达到表达量的最大值, 相对表达量分别是对照的4.39、4.19、2.56倍。
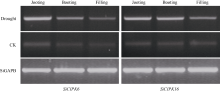
分别在豫谷1号生长至拔节、孕穗、灌浆期时采用自然干旱方法取对照和干旱处理样品叶片提取总RNA, 合成cDNA经均一化和半定量PCR后, 检测SiCIPK6和SiCIPK16样在不同生育期干旱胁迫下的表达情况。检测结果表明SiCIPK6和SiCIPK16两个基因在拔节、孕穗、灌浆期对照中均有表达, 而在相应生育时期受到干旱胁迫时它们表达量均有所提高(图2)。
本研究通过生物信息学方法得到抗旱耐瘠作物谷子的2个CIPK基因, SiCIPK6基因编码451个氨基酸, SiCIPK16基因编码473个氨基酸, 2个基因内部没有内含子和可变剪切。在NCBI数据库中进行序列比对发现它们与植物中的CIPK基因有较高同源性, 同时含有CIPK基因的标志结构域NAF-motif。功能域分析显示SiCIPK6、SiCIPK16含有CIPK蛋白C端调控域、丝氨酸/苏氨酸激酶催化域等CIPK蛋白特有的保守功能域, 因此推断这2个基因属于谷子CIPK家族中的2个成员。用ClustalX1.83比较不同物种中CIPK蛋白序列, 发现SiCIPK6、SiCIPK16与拟南芥、水稻和玉米中同源CIPK基因同源性非常高, 而且具有非常保守的序列和结构。如图3所示所有CIPK基因在C端调控域、N端激酶域、NAF结构域、激活环结构域、磷酸化和自磷酸化位点处序列高度一致, 非常保守。分析发现SiCIPK6与ZmCIPK6、OsCIPK6一致性分别为77.73%和72.17%, 与AtCIPK6一致性为52.49%; SiCIPK16与ZmCIPK16、OsCIPK16一致性分别为78.73%和74.55%, 与AtCIPK16一致性为45.33%。谷子中CIPK与水稻、玉米一致性要比谷子CIPK与拟南芥CIPK一致性高, 这与谷子与玉米、水稻亲缘关系相对较近的现象是一致的(谷子、玉米、水稻同属禾本科单子叶作物, 拟南芥属十字花科双子叶作物)。系统发育进化树中SiCIPK6、SiCIPK16分别和玉米、水稻相应基因聚在一起也验证了这一结论, 另外发育树中除小立碗藓中的PpCIPK6外, 其他物种的CIPK6和CIPK16大都聚集在一起, 这也说明CIPK6和CIPK16这2个基因的祖先在单双子叶植物分离之前就已存在。这些证明我们发现的SiCIPK6、SiCIPK16是植物CIPK家族中的2个成员, 它们和其他植物CIPK基因一样具有非常保守的序列和结构。SiCIPK6、SiCIPK16和玉米、水稻中相应基因同源性较高一方面说明谷子和玉米、水稻具有较近的亲缘关系, 另一方面也暗示它们在逆境应答或其他信号通路中可能有相似的功能。
另外, 我们对这2个基因的生物信息学特征进行了系统的预测和分析, 希望能够发掘对研究它们的功能有帮助的信息。预测结果显示SiCIPK6和SiCIPK16很多性状和参数非常接近类似, 这些结论不仅验证了它们同属CIPK基因家族, 而且预示SiCIPK6和SiCIPK16可能共同参与或调控某些信号途径。顺式元件分析和功能预测结果显示SiCIPK6和SiCIPK16基因可能会参与ABA或其他激素介导的生理生化过程, 预测的部分功能和已证实的不同物种中CIPK基因功能是相吻合的, 已有研究结果也表明CIPK基因在逆境应答中起重要作用[9, 12, 13, 41], 因此我们用ABA (100 μ mol L-1)、低温(4℃)、高温(42℃)、干旱、高盐(250 mmol L-1 NaCl)处理谷子豫谷1号幼苗, 用Real-time PCR分析他们在不同处理下的表达情况。结果表明2个谷子SiCIPK基因在5种胁迫处理下不同时间点其表达量均有所上调或下调, 但具体动态表达模式不尽相同, 例如SiCIPK6基因在ABA胁迫下, 表达量在1 h迅速增加到最大值, 为对照的4.65倍, 随后3~24 h表达水平逐渐下降; 在干旱诱导胁迫下1 h表达量快速增加, 3 h表达量急剧减少, 6 h又明显上升, 12 h有所减少, 在24 h又反弹到最高值, 为对照的6.42倍。整体来看SiCIPK6基因在ABA、干旱和NaCl处理时表达量上调幅度较大, 相对表达量最高时分别是对照的4.65、6.42、7.46倍。SiCIPK16基因在低温、干旱和高温处理时表达量上调幅度较大, 相对表达量在最高点时分别是对照的4.39、4.19、2.56倍。这些试验结果与它们在拟南芥、水稻和玉米中的同源基因有着相似的结论, 在拟南芥中AtCIPK6表达量受盐、渗透胁迫和ABA诱导, AtCIPK16对盐有强烈应答, 进一步研究表明AtCIPK6参与了盐、渗透胁迫以及ABA应答过程, AtCIPK16在细胞内Na+外排方面起一定作用[37, 38, 39]。水稻中的同源基因OSCIPK6受干旱、ABA和低温诱导, OSCIPK16受NaCl、ABA、PEG、Cold诱导, 分析表明它们可能参与干旱、低温、盐等逆境胁迫和ABA应答[41]。玉米中的同源基因ZmCIPK16受NaCl、20%PEG、高温、ABA、干旱的强烈诱导, 但却不受低温胁迫诱导, 进一步试验表明, ZmCIPK16在盐胁迫条件下能够部分代替AtCIPK24的功能, 在盐胁迫下转基因植株能部分互补野生型植株表型[29]。这些结论可能暗示SiCIPK6和SiCIPK16与其他物种中的同源基因有相似或部分相似的功能, 可能参与了干旱、低温、盐、高温以及ABA的应答, 但在不同的逆境应答过程中具体参与调控模式有所不同。
由于SiCIPK6和SiCIPK16均在干旱诱导下表达量上调幅度较大, 因此我们进一步用半定量方法研究了SiCIPK6和SiCIPK16在拔节、孕穗、灌浆期期干旱胁迫下的表达情况。如图所示, SiCIPK6在拔节、孕穗、灌浆期对照中均有表达, 表达量为拔节期> 孕穗期> 灌浆期, 在受到干旱胁迫时, SiCIPK6表达量受诱导迅速增加, 表达量为拔节期> 孕穗期> 灌浆期。SiCIPK16在拔节、孕穗、灌浆期对照中也均有表达, 在3个时期表达量基本一致, 在受到干旱胁迫时, SiCIPK16表达量受诱导迅速增加, 拔节期和孕穗期表达量上调幅度较大, 灌浆期上调幅度稍微小一些。SiCIPK6和SiCIPK16在不同生育时期受到干旱胁迫后表达量迅速上调说明SiCIPK6和SiCIPK16基因可能参与了谷子在拔节、孕穗、灌浆期的干旱应答。这些试验结论与我们的顺式元件预测和功能预测分析结论以及其他物种中相应同源基因报道是一致的(表1)。另外在2个基因启动子区域还发现茉莉酸甲(CGTCA-motif、TGACG-motif)、植物激素(TGA)、水杨酸(TCA-element、胚乳表达(SKn-1 motif)、玉米醇溶蛋白代谢调控(O2-site)、缺氧特异性诱导(GC-motif)、分生组织表达(CAT-box)、分生组织特异性激活(CCGTCC-box)、细菌激发应答(Box-Wi)、厌氧诱导必需(ARE), 这些顺式元件的存在暗示SiCIPK6和SiCIPK16可能参与相应的生理生化过程。值得一提的是在启动子区域还发现了大量的光应答元件和昼夜节律调控(circadian)核心元件, 众所周知谷子是光温敏感性作物, 预示SiCIPK6和SiCIPK16可能参与调控谷子的光温应答调控。尽管这些推测都需要严谨的试验证明, 但还是为我们今后的功能研究提供了一些线索。
本文报道的谷子SiCIPK基因丰富和完善了植物CIPK成员, 为进一步阐明CBL/CIPK信号系统在谷子逆境应答中的功能、机制提供了试验依据。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|