第一作者联系方式: E-mail: wttmrzf@163.com, Tel: 15195987620
WRKY转录因子参与调节植物生长发育、生物与非生物胁迫应答等多种过程, AtWRKY28是拟南芥中与抗病和耐逆相关的重要转录因子。为探讨大豆中一个 AtWRKY28同源基因 GmWRKY28-like(Glyma.14G028900)的生物学功能, 本文对该基因进行了克隆、生物信息学分析、亚细胞定位、组织表达等试验, 并对其在ABA、PEG、NaCl胁迫下的表达水平进行了分析。结果显示, GmWRKY28-like基因的编码区(CDS)为1008 bp, 编码335个氨基酸。GmWRKY28-like蛋白具有保守的WRKY结构域, 含有22个丝氨酸(Serine)、1个苏氨酸(Threonine)、2个酪氨酸(Tyrosine), 不含跨膜结构与信号肽; 进化树分析表明大豆GmWRKY28-like与菜豆( Phaseolus vulgaris) WRKY28的相似性最高; 亚细胞定位显示GmWRKY28-like定位在细胞核中。该基因在根、种子中表达量很低, 在真叶、花、及茎尖分生组织表达量较高。 GmWRKY28-like启动子中含有多种与生物和非生物逆境胁迫应答相关的元件, 如MBS、W-box、ABRE、Box-W1等, 且表达受到ABA、PEG、NaCl的诱导。此外, 过表达 GmWRKY28-like显著增强了拟南芥的耐盐性。
WRKY transcription factors play important roles in regulating plant growth and development, and participate in plant response to abiotic and biotic stresses. Arabidopsis WRKY28 is an essential transcription factor for plant response to necrotrophic pathogen and abiotic stress. To explore the function of the homologues gene of AtWRKY28 in soybean, we cloned GmWRKY28- like(Glyma.14G028900) and performed bioinformatics analysis. Its sub-cellular localization and tissue expression patterns were further investigated. We also analyzed the expression levels of GmWRKY28-likeunder ABA, PEG, and NaCl stress treatments. Our results showed that the coding DNA sequence (CDS) of GmWRKY28-like gene is 1008 bp in length, encoding 335 amino acids. GmWRKY28-like contains a conserved WRKY domain with 22 serine, one threonine and two tyrosine, without any transmembrane domain or signal peptide. Phylogenetic analysis showed that the WRKY28 from Phaseolus vulgaris was most similar to GmWRKY28-like. GmWRKY28-like was verified to be located in the nucleus. This gene expressed at low levels in root and seed while high levels in true leaf, flower and shoot apical meristem. The 1500 bp upstream region of GmWRKY28-like contains avariety of cis-elements, such as MBS, W box, ABRE, and box-W1, which are involved in the response to biotic and abiotic stresses, and its expression was induced by ABA, PEG, and NaCl treatments. In addition, overexpressing GmWRKY28-likein Arabidopsis thalianaenhanced plant tolerance to NaCl. This study would provide reference basis to further study the functions of GmWRKY28-like in soybean tolerance to abiotic stresses.
植物在生长发育过程中会受到多种多样的逆境影响, 因此植物通过调节一系列复杂的信号通路来改变许多基因的表达以适应逆境。 植物在逆境胁迫下基因表达量上调的转录因子有很多, 例如DREB、NAC (NAM、ATAF1、ATAF2和CUC2)、ZF-HD、AREB/ABF、MYC和MYB、WRKY和HSF等[1, 2, 3, 4]。其中, WRKY转录因子是植物中最大的转录因子家族之一, 如拟南芥中含有74个WRKY家族成员[5], 粳稻和籼稻基因组中也分别鉴定到98个和102个WRKY家族成员[6]。WRKY转录因子在N端都有一个由60个氨基酸残基组成的WRKY结构域, 并含有一个保守的WRKYGQK序列, 同时在C端有一个锌指状结构域CX4-7-CX23-28-HX1-2-(H/C)。根据WRKY结构域数目和锌指状结构特征可以将WRKY转录因子分为3类[7], I类含有2个WRKY结构域, 其锌指结构为C2H2型(C-X4-5-C-X22-23-H-X1-H, 其中X为任意氨基酸); II类只含1个WRKY结构域, 锌指结构为C2H2型, 与I类相似, 在拟南芥中, 该类又进一步分成IIa、IIb、IIc、IId和IIe亚类, 如AtWRKY28含有1个WRKY结构域, 其锌指结构为C2H2型, 属于第II大类WRKY蛋白家族中的d亚类[8]; III类虽也只含有1个WRKY结构域, 但其锌指结构模型为C2-HC型(C-X7-C-X23-H-X1-C)。WRKY通过结合启动子上保守的W box顺式元件来调节目标基因的表达[9]。
WRKY转录因子广泛参与到植物的生长发育及次生物质代谢途径中, 如毛状体发育、内种皮中单宁酸生成、根系发育、胚胎发生、种皮生成、衰老等[10, 11], 同时该家族还参与植物应答多种环境信号刺激, 调节防御病原体感染系统的复杂信号网络, 响应低温、高盐、干旱等非生物胁迫[12, 13]。水稻中过表达OsWRKY13可以增强对白叶枯病菌(Xanthomonas oryzae pv.oryzae Xoo)和真菌(Magnaportha grisea)的抗性[14, 15]。棉花(Gossypium hirsutumL.)中的GhWRKY15可被真菌感染强烈诱导, 过表达GhWRKY15 的烟草具有较高的抗病毒和真菌能力[16]。GhWRKY40受机械损伤和细菌Ralstonia solanacearum感染的诱导表达[17]。拟南芥中的WRKY8可以调控ABI4等相关基因参与对烟草花叶病毒的防御反应, 并可能介导ABA和乙烯信号传导途径中的交联反应[18]。在拟南芥中过表达OsWRKY77则可抑制丁香假单胞菌(Pseudomonas syringae pv. Tomato DC3000)的生长[19]。
WRKY转录因子通过组成正、负反馈环调节植物的多项生理过程[5]。OsWRKY62在水稻防御中起到负调节作用, 过表达时会降低水稻基础防御功能, 并会降低Xa21基因介导的对白叶枯病菌Xoo的抗性, 抑制防御基因的表达[20]。在拟南芥中进行的基因功能缺失和功能获得研究表明[21], AtWRKY7、AtWRKY11、AtWRKY17、AtWRKY18、AtWRKY23、AtWRKY25、AtWRKY27、AtWRKY38、AtWRKY40、AtWRKY41、AtWRKY48、AtWRKY53、AtWRKY58、AtWRKY60、AtWRKY62在植物免疫上都起负调控作用; 而AtWRKY34、AtWRKY33、AtWRKY53和AtWRKY70在植物抵抗腐殖营养的病原真菌, 如葡萄孢菌(Botrytis cinerea)和链格孢菌(Alternaria brassiciola)中, 则发挥着积极作用[22, 23, 24]; AtWRKY46、AtWRKY70、AtWRKY53在抗病原菌丁香假单胞菌(Pseudomonas syringae)方面也起着积极作用, 并在基础防御方面作用相互重叠、协同作用[25]。
WRKY28与众多WRKY家族基因一样, 能同时参与调控多种生理过程, 在多种生物和非生物逆境下起重要作用。WRKY28基因受ABA、高盐、机械损伤而诱导表达[26], 并很可能通过水杨酸途径或茉莉酸信号通路参与对葡萄孢菌的免疫应答反应[27]。WRKY28表达量在低磷胁迫下显著升高, WRKY28通过正调控PHO1和PHT1; 4响应低磷胁迫[28]。过表达AtWRKY28的转基因株系对草酸和菌核病(Sclerotinia sclerotiorum)都表现出抗性增强的现象, 表明拟南芥中AtWRKY28是该防御反应的正调控因子[29]。
大豆是一种重要的油料作物和植物蛋白质来源, 在生长过程中, 受到多种环境因素的影响, 生物和非生物逆境均可造成大豆减产。本实验通过克隆大豆中一个WRKY28-like基因, 研究其在非生物胁迫条件下的表达水平, 以期为研究大豆中的WRKY28基因在耐逆方面的功能提供借鉴。
大豆(Glycine max)品种科丰1号由南京农业大学国家大豆改良中心提供; 引物合成及测序均由上海英骏生物技术有限公司完成; pJIT166-GFP载体由南京农业大学国家大豆改良中心提供; 其他试剂类未经特别说明者均为国产; PCR仪器为Biometrad的070-851型; 实时荧光定量PCR仪为Roche公司的LightCycler 480II型; 激光共聚焦显微镜是Zeiss的LSM780型。
利用Phytozome (http://www.phytozome.net/)查找大豆中与拟南芥WRKY28 (At4g18170.1)相似的基因。选择相似度最高的基因, 登录NCBI发现其基因注释为WRKY28-like (XP_003545146.1), 确定其为研究对象。用总RNA提取试剂盒(TIANGEN)提取正常条件下生长的科丰1号叶片总RNA, 利用反转录试剂盒(TaKaRa)合成cDNA第一链作为模板扩增基因。根据WRKY28-like的CDS序列设计引物, 以cDNA为模板进行扩增。由于该基因的5° 端序列在大豆中存在2个拷贝, 因此利用Primer Premier 5.0设计3对引物(引物序列如表1), 即14g-F和14g-REV1、14g-REV2、14g-REV3, 进行3次扩增。
PCR体系含cDNA 5 μ L、5× PS GXL缓冲液10 μ L、引物STAR GXL DNA聚合酶(TaKaRa) 1 μ L、2.5 mmol L-1 dNTPs 4 μ L、20 μ mol L-1引物各1 μ L、ddH2O 29 μ L。反应程序为: 95℃ 5 min; 95℃ 30 s, 56℃ 30 s, 72℃ 1 min, 35个循环; 72℃ 10 min。产物经1%琼脂糖凝胶电泳检测, 并回收目的条带, 经3次扩增回收(AXYGEN), 获得完整的CDS片段。将其与pMD19-T载体(TaKaRa)连接, 转化大肠杆菌DH5α 感受态细胞(TIANGEN), 涂布在含有氨苄(Sangon Biotech)抗生素的平板上, 过夜培养, 挑斑, 菌液PCR、质粒酶切验证来筛选阳性克隆, 测序验证。将正确克隆命名为T-GmWRKY28。
用在线软件ExPASy (http://cn.expasy.org/tools/pi_tool.html)和SOPMA (http://nhjy.hzau.edu.cn/kech/ swxxx/jakj/dianzi/Bioinf7/Expasy/Expasy8.htm)分析蛋白质的物理和化学性质, 并预测二级结构。利用DNAMAN和TMHMM Server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM/)跨膜预测。利用SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP/)分析信号肽; 选择参数: Eukaryotes; Default; PNG (inline); Standard; Input sequences do not include TM regions。利用NetPhos 2.0 Server程序分析磷酸化位点 (http://www.cbs.dtu.dk/services/NetPhos/)。利用SMART (http://smart.embl-heidelberg.de/)和NCBI的保守结构域(CDD)数据库(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测基因的保守性功能域。
利用PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测GmWRKY28-like基因上游1500 bp区域的顺式作用元件。应用BlastP (http://blast.ncbi.nlm.nih.gov/)和Phytozome查找与GmWRKY28-like同源性高的序列(每个物种保留同源性最高的一条序列), 用DNAMAN比对氨基酸序列; 用MEGA 5.0软件中的邻近相连法(NJ)构建系统进化树, 校验参数BootStrap重复1000次。
用WoLF PSORT (http://www.genscript.com/psort/wolf_psort.html)预测亚细胞定位。并同时构建GmWRKY28-like与GFP的融合表达载体, 转入拟南芥原生质体进行亚细胞定位。以T-GmWRKY28为模板, 扩增、回收目的片段。使用Sal I和BamH I (NEB)分别酶切目的片段和载体pJIT166-GFP, 连接酶切产物, 使GmWRKY28插入GFP, 将连接后的载体转入DH5α 感受态细胞中。挑取单克隆测序。使用TaKaRa无内毒素大提质粒试剂盒提取质粒, 采用PEG-4000介导的方法[30]将质粒转染入拟南芥(野生型Col-0)的叶片原生质体中, 培养15~20 h后, 在激光共聚焦显微镜下观察。
挑选籽粒圆润饱满、大小较为一致的科丰1号种子, 以1% NaClO浸泡1 min, ddH2O冲洗干净, 黑暗中沙萌3 d, 取根尖; 其余移入蛭石中在室温下培养, 16 h光照/8 h黑暗, 每3 d浇一次改良的1/2 MS营养液。待真叶自然舒展开后, 取真叶。再分别取14 d苗龄的茎尖分生组织、18 d苗龄的三出复叶和茎、开花盛期的花组织、鼓粒盛期的绿荚、成熟的种子。将样品迅速保存于液氮冷冻备用。
挑选籽粒圆润饱满、大小较为一致的科丰1号种子, 以1% NaClO浸泡1 min, ddH2O冲洗干净, 黑暗中沙萌3 d后, 于光照培养箱里采用改良的1/2 Hoagland营养液(pH 5.8)培养。每500 mL烧杯内放3株苗, 每3 d更换一次新鲜营养液, 水培温度26℃/24℃ (L/D), 16 h光照/8 h黑暗, 湿度70%, 光强600 μ mol m-2 s-1。在培养11 d后进行相应胁迫处理, 参考钟贵买等[26]的做法, 同时结合预试验结果, 在营养液中分别添加100 μ mol L-1ABA、20% (质量体积比) PEG-6000、200 mmol L-1 NaCl, 对照组仍采用改良的1/2 Hoagland营养液。处理0、3、6、12、24、48和72 h后, 取舒展的最上端三出复叶的中间一片叶作为叶样, 取根尖1 cm组织作为根样, 将3株样等量混和, 迅速置液氮中冷冻备用, 生物学重复3次。
用总RNA快速提取试剂盒(TIANGEN, 北京)提取叶片和根的总RNA。使用PrimeScript 1st Strand cDNA Synthesis Kit试剂盒(TaKaRa公司)反转录合成cDNA第1链。参照SYBR Premix Ex Taq II操作说明书进行qRT-PCR (表1)。以大豆ACT11为内参基因对GmWRKY28-like基因在不同组织下的表达进行qRT-PCR分析; 以大豆60S为内参基因对GmWRKY28-like基因在不同逆境胁迫(ABA、PEG或NaCl)下的表达进行qRT-PCR分析。每个样品3个重复孔(技术性重复), 生物学重复3次, 采用2-Δ Δ Ct法[31]分析GmWRKY28-like的相对表达量, 并计算3次生物学重复的标准误。
| 表1 试验中使用的引物 Table 1 Primers used in this study |
用限制性内切酶Bgl II和BstE II酶切T-GmWRKY28质粒和pCAMBIA1301载体, 然后连接转入农杆菌菌株EHA105, 构建GmWRKY28-like的植物表达载体, 采用“ floral dip” 方法转化拟南芥, 潮霉素筛选出纯合株系。收获纯合转基因T3代, 37℃烘2 d左右, 密封存放于4℃冰箱备用。
对野生型拟南芥Col-0和过表达GmWRKY28- like基因的纯合T3代转基因株系#11、#40进行NaCl胁迫处理。经过预试验, 确定设置0、50、100、和150 mmol L-1 NaCl处理水平, 以1/2MS为基本培养基, 统计、分析种子的萌发率和主根长。其中, 萌发率每次以30~50粒种子计数; 根长则以30株左右幼苗计算。试验重复3次。
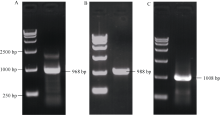
根据同源基因比对, 与拟南芥WRKY28基因(At4g18170.1)同源性最高的大豆基因为XP_ 003545146.1 (即Glyma.14G028900), 其编码的蛋白与拟南芥AtWRKY28蛋白的相似度为46.6%。由于该基因的5° 端序列在大豆中存在2个拷贝, 先后通过3次扩增得到该基因: 首先利用14g-F和14g- REV1为引物得到长度预计为968 bp的片段(图1-A), 然后以第1次PCR产物为模板, 利用14g-F和14g-REV2为引物得到长度预计为988 bp的片段(图1-B), 最后以第2次PCR产物为模板, 利用14g-F和14g-REV3为引物得到长度预计为1008 bp的片段(图1-C)。经过3次扩增获得了完整的目的片段。测序结果显示, 所得序列与NCBI中XP_003545146.1的序列(即Williams 82序列)完全一致, 为1008 bp。
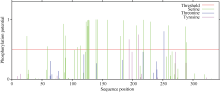
GmWRKY28-like基因的CDS区域共1008个核苷酸, 编码335个氨基酸, 其等电点为6.99, 蛋白质量为37 960.54 Da, 蛋白质二级结构由26.87%的α -螺旋、9.85%的延伸、6.57%的β -转角和56.72%的无规则卷曲4种结构模块组成。预测发现GmWRKY28- like没有信号肽和跨膜结构。GmWRKY28-like磷酸化位点预测结果如图2显示, GmWRKY28-like含有22个丝氨酸(Serine), 1个苏氨酸(Threonine)和2个酪氨酸(Tyrosine), 推测这些磷酸化位点的作用可能与GmWRKY28-like蛋白的活性调控有关。
对该基因的保守性功能域的预测(图3)显示, 在187~246氨基酸位置(LEDGYRWRKYGQKAVKNSP YPRSYYRCTSQKCGVKKRVERSFQDPTIVITTYEG QHNHHC)有一个WRKY的功能结构域, 其锌指结构为C2H2型(C-X4-C-X23-H-X1-H), 属于WRKY蛋白II类。其中WRKYGQK是WRKY结构域的核心序列。
用PlantCARE分析GmWRKY28-like基因上游1500 bp序列包含的顺式作用元件(表2), 发现共有39种顺式元件。根据这些元件的注释, 可以将其分成非生物胁迫相关、生理功能相关、生物胁迫相关、和功能未知4类。非生物胁迫相关的顺式作用元件又可以分为两类, 一类是环境因子, 主要包括光、厌氧、干旱、热击、机械损伤等响应, 其中以光响应元件最多, 包括ACE、Box-4、G-box等11种元件; 第2类是激素相关的顺式作用元件, 包括脱落酸(ABA)反应元件(ABRE)、茉莉酸甲酯(MeJA)应答元件(CGTCA-motif)和水杨酸(SA)应答元件(TCA-element), 其中ABRE出现频率最高。生理功能相关的顺式作用元件中, 出现频率较高的是CAAT-box、TATA-box、Skn-1_motif。生物胁迫相关元件包括Box-W1和W box元件, 可对真菌、病原体产生响应。另外还有一些功能未知的顺式元件, 如AAGAA- motif、Unnnamed_1、Unnnamed_4等。
 | 图3 GmWRKY28-like蛋白的保守结构域预测(SMART)Fig. 3 Predicted conserved domain of GmWRKY28-like protein (from SMART) |
应用DNAMAN对不同植物中WRKY28的氨基酸序列进行多重序列比对(图4), 以黑色区域标注完全相同的氨基酸, 以灰色标注相似度在50%以上的氨基酸。可以看到, 不同植物的WRKY28在WRKY结构域中存在一定的保守性, 而两端的非WRKY结构域保守性比较弱, 不同物种的序列差异明显。
用MEGA5.0对GmWRKY28-like与其他物种中的WRKY28的氨基酸序列进化树分析(图5), 与大豆GmWRKY28-like相似性最高的是菜豆, 一致性(identity)为82%, 鹰嘴豆、蒺藜苜蓿与大豆的一致性也比较高, 分别为64% 和59%, 大麦、小麦、陆地棉与大豆的GmWRKY28-like蛋白相似性最低。
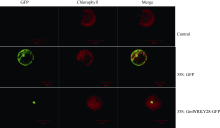
拟南芥原生质体亚细胞定位结果表明, 融合蛋白GmWRKY28-GFP信号全部集中于细胞核中(图6), 因此GmWRKY28-like很可能在细胞核内发挥作用。
| 表2 GmWRKY28-like基因上游1500 bp调控区的顺式作用元件 Table 2 cis-elements in the 1500 bp upstream regulatory regions of GmWRKY28-likegene |
分别取幼苗期的根、真叶、茎尖分生组织、茎、第一个三出复叶、盛花期的花、鼓粒盛期的绿荚和成熟种子的cDNA为模板, 以种子表达量为对照, 进行组织表达分析。实时荧光定量PCR结果(图7)表明, GmWRKY28-like在根和种子中的相对表达量很低, 在真叶、花、茎尖分生组织和绿荚中则大量表达。
实时荧光定量PCR结果(图8)显示, 分别以各时间点正常生长条件下的样品为对照, 在3种胁迫处理下, 大豆叶片和根中GmWRKY28-like的相对表达量较对照都有不同程度的改变。
ABA处理下, GmWRKY28-like在叶片中的相对表达量在24 h达到高峰, 是对照的4倍; 根中GmWRKY28-like的相对表达量在48 h最高, 也达到对照的4倍。PEG处理下, 叶片中GmWRKY28-like的表达水平在处理后短时间内即受诱导上调表达, 3 h时PEG处理是对照的9.3倍; 在根中的表达量则一直低于对照。在200 mmol L-1的NaCl处理下, GmWRKY28-like在叶片中的相对表达量升高, 72 h的相对表达量是对照的5.5倍; 而根中的相对表达量在24 h达到最高。
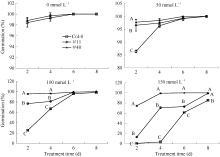
如图9所示, 野生型Col-0、过表达GmWRKY28- like基因的纯合T3代转基因株系#11和#40的种子在正常1/2MS培养基上的萌发状况都很好, 播种后2 d萌发率都达到了98%以上, 没有明显差异; 50 mmol L-1 NaCl处理下播种2 d的萌发率有极显著差异, Col-0为86.6%, 而#11、#40分别为96.2%和97.7%; 100 mmol L-1 NaCl处理下, 2 d和4 d三者间的萌发率也存在极显著的差异, Col-0在2 d萌发率仅为24.2%, 到4 d才达到67.2%; #11在2 d为76.7%, 4 d为81.9%; #40在2 d萌发率就已经达到96.0%; 萌发率差异最为明显的是150 mmol L-1NaCl处理, 萌发2、4、6和8 d, 转基因株系和对照株系都具有极显著差异; Col-0在4 d才开始有萌动现象, 仅为3.4%, 到8 d才达到85.3%, 且生长状态很差, 植株无变绿现象; #11在2 d已经达到14.2%, 4 d的萌发率达到了70.1%, 8 d就已经全部萌发, 生长状况良好; #40株系拟南芥最耐高盐, 2 d萌发率为74.2%, 4 d时已经全部萌发。
图10表明, 在正常1/2MS培养基上萌发的野生型Col-0、过表达GmWRKY28-like基因的纯合T3代
转基因株系#11、#40, 根系生长情况良好, 2 d时基本都长到了4.5 mm, 4 d时在20.0 mm上下, 到12 d时都超过了43.0 mm。50 mmol L-1NaCl处理下, Col-0、#11、#40根系生长速度略微减缓, 在6 d时, Col-0和#11没有明显区别, 但与#40具有显著差异, 此后三者主根长度相差不大, 12 d时基本都在40.0 mm以上。100 mmol L-1的NaCl条件下, 株系#40根系伸长量较Col-0更多, 在8、10、12 d时, #40和Col-0的根长具有显著差别, #11和Col-0没有明显差异。利用高浓度150 mmol L-1 NaCl处理时, 野生型Col-0的长势明显弱于转基因株系, 2 d时#11、#40根长显著大于Col-0, 此后一直表现出极显著的根系伸长量差异; #11、#40在4 d平均根长为4.0 mm、4.1 mm, 而Col-0只有0.8 mm; 12 d的#11、#40根长为6.5 mm和8.1 mm, Col-0只有2.2 mm。
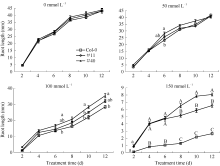 | 图10 拟南芥在对照和NaCl处理下的根长 野生型Col-0、过表达GmWRKY28-like基因的纯合T3代转基因株系#11、#40在不同浓度的NaCl的1/2MS培养基上的根长。每次以30棵左右的幼苗计数, 误差线表示3次重复的标准误。每个时间点都使用新复极差法分析Col-0、#11和#40之间是否存在显著性差异; 大写和小写字母分别表示在0.01和0.05水平上差异性显著。Fig. 10 Root length of Arabidopsis in control and NaCl treatments The root length of wild type Col-0 and homozygous T3GmWRKY28-like overexpressing transgenic Arabidopsis lines #11 and #40 on 1/2MS medium with the different concentrations of NaCl. Data represents mean of three replicates with about 30 seedlings within each replication. Error bars represent standard errors of three replicates. Shortest Significant Ranges method was used to analyze whether there were significant differences at each time point among Col-0, #11, and #40, whereas capital and lowercase letters represent significant difference at the 0.01 and 0.05 probability levels, respectively. |
WRKY家族属于植物中特有的一类转录因子, 其家族庞大, 成员众多。很多研究结果表明该家族基因广泛参与调节植物的生长发育、生物和非生物应答等多种生理过程。然而, 目前对大豆该家族基因的研究还较少, 因此, 研究大豆中WRKY28基因的功能对了解该家族成员具有更进一步的借鉴意义。
GmWRKY28-like基因上游1500 bp区域具有多种参与生理功能、生物和非生物胁迫应答相关的顺式作用元件, 推测GmWRKY28-like很可能与植物应对干旱、机械损伤、热击等逆境胁迫和ABA、水杨酸、茉莉酸等激素的应答过程。前期研究认为[32], 如果某个基因可以受到ABA诱导, 且在它的启动子中含有ABRE顺式元件, 那么这个基因很可能与增强植物抵抗干旱和脱水胁迫的能力有关。GmWRKY28- like的启动子区域含有4个ABRE顺式元件和2个干旱应答的顺式元件MBS, 且表达受到ABA的诱导, 推测该基因在抗旱方面很可能具有一定作用。PEG处理下, 大豆叶片中的GmWRKY28-like在很短时间内即受到强烈的诱导, 表达量提高近10倍。PEG处理和干旱条件下都对植物造成渗透胁迫, 因此GmWRKY28-like可能参与干旱条件下的渗透胁迫应答。但PEG渗透胁迫与常规意义上的土壤渐进失水情况并不完全相同, 因此PEG只能模拟而不能完全代替干旱情况。GmWRKY28-like在干旱条件下的具体表达情况, 还要通过土壤失水处理来确定。
虽然在启动子区域中并没有发现明确的与高盐有关的顺式作用元件, 但GmWRKY28-like基因可受到高浓度NaCl的诱导表达, 说明GmWRKY28-like可能参与植物对高盐离子毒害或者渗透胁迫的应答反应。此外, WRKY转录因子可以激活植物防御细菌和真菌感染的系统。草酸在大豆菌核菌的发病机制中起到重要作用[19], 过表达AtWRKY28的转基因株系对菌核病以及草酸都表现出抗性增强的现象, 其应对机制主要是通过激活茉莉酸/乙烯途径来发挥作用[29]。在GmWRKY28-like基因的启动子区域也有一些和生物胁迫相关的作用元件, 如W box和Box-W1, 也有茉莉酸甲酯应答元件TGACG-motif, 因此GmWRKY28-like基因在防御、抵抗病原体侵害方面很可能也具有一定的作用。
拟南芥中AtWRKY28被定位在细胞核中[26], 且受到ABA、高盐、机械损伤诱导[26], 并很可能通过水杨酸途径或茉莉酸信号通路参与对葡萄孢菌的免疫应答反应[27]。本研究表明GmWRKY28-like定位于细胞核中, 且能受到ABA、高盐、PEG诱导表达。荧光定量PCR结果显示, GmWRKY28-like对ABA有较强程度的应答能力, 很可能参与ABA信号途径, 同时该基因还可能参与对干旱、高盐、渗透胁迫等方面的响应。通过比较NaCl胁迫下野生型和过表达GmWRKY28-like的转基因拟南芥的萌发率和根长, 发现过表达GmWRKY28-like提高了拟南芥的耐盐性。据此推测大豆中的这个WRKY28-like极有可能是作为一个类似AtWRKY28的转录因子在细胞核中发挥作用, 参与大豆对非生物逆境的应答过程。
在大豆品种科丰1号中, 克隆了GmWRKY28- like基因, 该基因编码335个氨基酸, 具有一个WRKY保守结构域, 无信号肽和跨膜结构, 编码的蛋白与菜豆中的WRKY28同源性很高。启动子区域中含有多个与生物和非生物逆境胁迫相关的顺式作用元件。GmWRKY28-like蛋白定位于细胞核。该基因在多种组织中均可表达, 但具一定组织特异性, 在真叶、花、及茎尖表达量较高, 同时该基因受ABA、PEG和NaCl的诱导表达。过表达GmWRKY28- like的转基因拟南芥在高盐环境下的萌发率和根长比野生型显著提高。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|