第一作者联系方式: E-mail: zhoutianshan@nwsuaf.edu.cn
儿茶素类化合物与花青素均由类黄酮代谢途径合成, 紫芽茶中富含花青素。为探明紫芽茶树中类黄酮生物合成代谢流的情况, 本试验以来源于湄潭苔茶后代的1株紫色芽叶茶树和1株绿色芽叶茶树为材料, 测定芽下第一叶、第二叶和第三叶的叶色、儿茶素类组分和花青素总量, 分析了类黄酮生物合成相关的基因表达情况及基因表达量同总儿茶素、花青素累积量之间的相关性。结果表明, 紫芽茶树中各叶位中花青素含量均显著高于对照绿芽茶树, 而儿茶素类总量却低于对照; 类黄酮生物合成关键酶(PAL、CHS、CHI、F3H、DFR、ANS、ANR1、ANR2、F3’H和F3’5’H)基因均呈现上调趋势。紫色芽叶中的总儿茶素与花青素, 同各相关基因( LAR除外)表达水平的相关性都较高, 且二者相关系数差异不大。绿色芽叶中的总儿茶素与各基因( LAR、F3’H除外)表达的相关系数, 明显高于花青素同各基因表达的相关系数。
Flavan-3-ols (aka catechins) and Anthocyanins found in large amounts in tea plant with purple leaf are synthesized through flavonoids metobolic pathway. To investigate the metobolic flux of flavanoids biosynthetic pathway in tea plant with purple leaf, we employed a tea plant with purple leaf and a tea plant with green leaf both from Mei-Tan-Tai-Cha, to examine the expression profiles of related genes involved in flavonoids biosynthesis intensively and determine the concentrations of catechins and anthocynins. The correlation between total catechins (or anthocyanin) and the expression levels of related genes were analyzed. The results indicated that the expression levels of related genes ( PAL, CHS, CHI, F3H, DFR, ANS, ANR1, ANR2, F3’H, and F3’5’H) were up-regulated in purple leaves as compared with those in the green leaves. The purple leaf also had higher concentration of anthocyanins than the green leaf, while the green leaf was richer in total catechins. In purple leaves, the expression levels of related genes (except LAR) were highly correlated with both concentrations of total catechins ( r = 0.84-0.99) and anthocyanins ( r = 0.72-1.00). In contrast, there was only a high correlation between the expression levels of related genes (except LAR and F3’ H) and the concentration of total catechines ( r = 0.64-0.77) in green leaves.
茶多酚是茶树[Camellia sinensis (L.) O. Kuntze]中主要的次生代谢产物, 其含量可达鲜叶干重的18%~36%, 它包括儿茶素类(黄烷醇类), 黄酮及黄酮醇类, 花青素和花白素类, 酚酸及缩酚酸等[1]。除酚酸及缩酚酸外, 均具有2-苯基苯并吡喃为主体的结构, 统称为类黄酮化合物。植物中类黄酮化合物生物合成途径, 现已基本探明[2, 3, 4]。
儿茶素类是茶叶中多酚类化合物的主体, 占茶叶干重的12%~24%, 花青素在一般茶叶中仅占干重的0.01%, 而在具有紫芽、紫叶、紫茎特性的紫鹃品种中高达2.7%~3.6%[5]。一般认为, 紫色芽叶制成绿茶品质较差, 汤色发褐, 滋味苦涩, 叶底靛青。近年来, 随着花青素所具有的抗氧化[6]、抗过敏[7]和缓解眼部疲劳[8]等生物学活性被人们认识, 现已有Benibana茶[9]、Sunrouge茶[10]和紫鹃茶[11] 3个富含花青素的茶树品种得以开发。因为饮用富含花青素的紫芽茶, 不仅能摄取丰富的儿茶素类, 而且能同时摄取花青素, 更具有保健价值。如Maeda-Yamamoto等[12]研究发现, Sunrouge茶的水提取物对乙酰胆碱酯酶具有很强的抑制作用, 因而可预防乙酰胆碱酯酶相关疾病。
对紫芽茶树的研究, 主要集中在花青素含量同叶色的关系[13, 14]、花青素的分离鉴定和生物活性方面[9, 10, 12, 15]。另外, 陈林波等[16]曾采用cDNA-AFLP技术研究了紫鹃幼嫩叶片和成熟叶片的基因表达差异, 并筛选出相关的基因。但对于紫芽茶树中类黄酮生物合成关键酶基因的表达、儿茶素类物质的累积以及花青素的累积的关系, 目前尚未见报道。本试验分别以湄潭苔茶后代中具有相似遗传背景的1株紫色芽叶和1株绿色芽叶的茶树单株为材料, 分析了类黄酮生物合成关键酶基因的表达情况, 同时检测了儿茶素类物质和花青素的累积及紫芽茶树中类黄酮生物合成代谢流的情况, 为进一步探明茶树紫芽形成机制奠定基础。
在西北农林科技大学西乡茶叶试验站种质资源圃的湄潭苔茶后代(编号51)中有1株紫色芽叶茶树, 其他均为绿色芽叶。紫色芽叶茶树编号为51-2, 另选1株正常绿色芽叶茶树作为对照, 其编号为51-1。以此2株茶树作为试验材料, 分别在春季摘取芽下第一叶、第二叶和第三叶, 立即投入液氮冷冻, 再放入-80℃冰箱保存备用。
采用手持柯尼卡美能达CR400色彩色差计, 将测试头对准茶树叶片中间部位, 按下测试键, 读取并记录L、a、b色差值。依次测量芽下第一叶、第二叶和第三叶的色差值, 每个叶位测量20片, 重复3次。
参照TaKaRa RNAiso Plus Total RNA提取试剂盒说明书提取叶片总RNA, 对总RNA进行浓度、完整性等质量检验后, 调整浓度至1 µ g µ L-1, -80℃保存备用。采用TaKaRa Prime Script RT Reagent Kit合成cDNA第一链。
根据NCBI中登录的基因序列, 设计定量PCR引物(表1)。荧光定量在iQ5实时定量PCR仪中进行, 以茶树β -actin基因为内参, 反应体系含2.0 µ L浓度为50 ng µ L-1的cDNA、0.8 µ L上下游引物(引物浓度为10 µ mol L-1), 7.4 µ L ddH2O和10 µ L SYBR Premix Ex Taq II。
反应程序为95℃预变性2 min, 95℃变性30 s, 52℃退火30 s, 72℃延伸30 s, 循环40次, 每个样品3个重复。反应结束后分析荧光值变化曲线和熔解曲线, 采用2-Δ Δ CT法[17]分析。
称取0.1 g样品, 在液氮中研磨成粉末, 加入1 mL甲醇, 振荡提取20 min, 在4℃条件下10 800× g离心10 min, 取上清液, 再用0.2 µ m滤膜过滤上清液, 用液相色谱分析儿茶素类组成及含量。色谱条件[18]: A相是2%乙酸, B相是乙腈, 流速1 mL min-1, 柱温30℃, 检测波长280 nm, 进样量10 µ L; 梯度洗脱, B相在16 min内由6.5%线性上升到25%, 25 min时再回到6.5%。
参照文献[19]分析花青素总量。称取1.0 g液氮磨碎样, 加入50 mL MeOH/HCl (99∶ 1, v/v)提取液, 以900转 min-1的速度在室温下磁力搅拌4 h, 过滤后减压旋转蒸发至干。再用5 mL的蒸馏水溶解即得花青素提取液。分别吸取200 µ L花青素提取液, 依次加1.8 mL pH 1.0的0.025 mol L-1 KCl缓冲液和pH 4.5 mol L-1的0.4 mol L-1乙酸钠配制成2份比色液, 分别于520 nm和700 nm测定吸光值, 以cyanidin-3- glucoside作为标品绘制标准曲线。
| 表1 实时定量PCR引物 Table 1 Primers for real-time PCR |
含量(μ g g-1) = (A× K× DF)/FW, 其中A = (A520 nm- A700 nm)pH 1.0-(A520 nm-A700 nm)pH 4.5; K为由标准曲线求得的常数; DF为稀释倍数; FW为样品鲜重(g)。
采用IBM SPSS 19.0软件分析试验数据。
在亨特表色系统中, L表示亮度, a和b表示色调和度。a为正值时, 表示红的程度, 正值越大颜色越红; a为负值表示绿的程度, 其绝对值越大色泽越绿。b为正值时, 表示黄的程度, 正值越大颜色越黄; b为负值表示蓝的程度, 其绝对值越大色泽越蓝。经多重比较发现, 两株茶树相同叶位的叶片色泽上存在显著差异(表2)。对于51-2来说, 其不同叶位的叶片色泽上也存在显著差异, 51-2第一叶的a值为正值, 且最高, 表明51-2芽下第一叶叶色最红, 芽下第二叶(51-2第二叶)其次, 但芽下第三叶(51-2第三叶)的a值为负值, 说明叶色已属于绿色范围。结合图1发现, 51-2的芽下第三叶中间部分为绿色, 叶缘泛红。色差分析表明, 试验所用的材料色泽差异明显。
根据2-苯基苯并吡喃B环上羟基的数量, 茶叶中的儿茶素类可分为B环二羟基儿茶素(B-3’ , 4’ - catechins)和B环三羟基儿茶素(B-3’ , 4’ , 5’ -catechins)。前者包括儿茶素(C)、表儿茶素(EC)、表儿茶素没食子酸酯(ECG)和儿茶素没食子酸酯(CG); 后者主要有表没食子儿茶素(EGC)、表没食子儿茶素没食子酸酯(EGCG)和没食子儿茶素没食子酸酯(GCG)。2-苯基苯并吡喃B环3’ 和5’ 位的羟基化分别由F3’ H和F3’ 5’ H催化。由图2可以看出, 绿色芽叶植株的B环三羟基儿茶素和总儿茶素含量呈现芽下第二叶> 芽下第一叶> 芽下第三叶; B环二羟基儿茶素含量呈现芽下第一叶> 芽下第二叶> 芽下第三叶。紫色芽叶植株的B环二羟基儿茶素、B环三羟基儿茶素和总儿茶含量呈现芽下第一叶> 芽下第二叶> 芽下第三叶。不过, 紫色芽叶植株的各叶位叶片的B环三羟基儿茶素和总儿茶素均低于绿色芽叶植株。
| 表2 紫色芽叶与对照色泽 Table 2 Values of L, a, and b for purple leaves and control |
 | 图1 紫色芽叶与绿色芽叶(对照)植株 51-1: 绿色芽叶(对照); 51-2: 紫色芽叶。Fig. 1 Tea plant with purple leaf and green leaf (control) 51-1: green leaf (control); 51-2: purple leaf. |
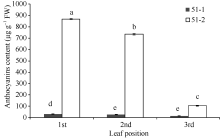
花青素含量以紫色芽叶植株的芽下第一叶最高, 达到866.08 µ g g-1(鲜重), 芽下第二叶为183.46 µ g g-1 (鲜重), 芽下第三叶为103.76 µ g g-1 (鲜重), 分别是绿色植株相应叶位叶片的27.00、28.39和7.49倍(图3)。
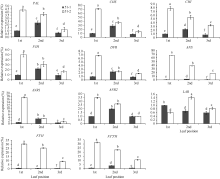
从图4可以看出, 紫色芽叶中PAL (苯丙氨酸解氨酶)、CHS (查耳酮合成酶)、CHI (查耳酮异构酶)、F3H (黄烷酮3’ -羟化酶)、DFR (二氢黄酮醇4’ -还原酶)、ANS (花青素合成酶)、ANR1 (花青素还原酶1)、ANR2 (花青素还原酶2)、F3’ H (类黄酮3’ -羟化酶)和F3’ 5’ H (类黄酮3’ , 5’ -羟化酶)的表达量显著高于对照相应叶位叶片, 尤其在芽下第一叶中。其中F3’ H和F3’ 5’ H上调幅度最大, 它们的表达量分别是对照芽下第一叶的9.16~30.43倍和10.69~31.82倍。此外, 上调幅度较大的还有ANS和ANR2。这与紫色芽叶植株的各叶位叶片中B环三羟基儿茶素和总儿茶素含量都低于绿色芽叶植株(图2)的结果不一致。在绿色芽叶植株(51-1)中, 除LAR (无色花色素还原酶)和F3’ H外, 其他基因的表达量都呈现芽下第二叶> 芽下第一叶> 芽下第三叶; 但在紫色芽叶植株(51-2)中, 除LAR外, 其他基因的表达量都呈现芽下第一叶> 芽下第二叶> 芽下第三叶。这与图2中紫色芽叶植株的B环二羟基儿茶素、B环三羟基儿茶素和总儿茶素含量变化趋势相吻合。LAR在紫色芽叶中上调不明显, 仅在芽下第二叶和第三叶中比对照略有上调。
如表3所示, 紫芽茶树中, 无论是总儿茶素还是花青素, 同各相关基因(LAR除外)表达水平的相关性都较高, 且二者相关系数差异不大。而绿色茶树中, 则是总儿茶素与各基因(LAR、F3’ H除外)表达的相关系数, 明显高于花青素同各基因表达的相关系数。这说明紫色芽叶植株中类黄酮生物合成的代谢流朝向儿茶素类和花青素合成2个方向; 绿色芽叶植株中类黄酮生物合成的代谢流主要朝向儿茶素类物质合成。
| 表3 总儿茶素、花青素与相关基因表达量相关性分析 Table 3 Pearson’ s correlation analysis between total catechins (or anthocyanins) and expression levels of related genes |
PAL (苯丙氨酸解氨酶)是类苯丙烷代谢途径的第一个酶, 它调节植物初级代谢的碳流向类苯丙烷代谢途径[2, 3, 4]。茶树中有2个PAL序列(GenBank登录号为D26596和AY694188), 它们的相似性达到95.06%, 可能是等位基因序列。实际上, Matsumoto等[20]曾报道PAL (GenBank登录号为D26596)在单倍体茶树中以单基因形式存在。拟南芥中PAL1被认为专一作用于类黄酮生物合成途径[21], 本试验中所分析的PAL (GenBank登录号为D26596)与其相似性高达85%。Singh等[22]曾报道茶树受干旱、创伤、赤霉素及脱落酸处理过程中, PAL基因的表达与儿茶素类化合物的累积呈正相关, 这与本试验的结果相一致。另外, 在本试验紫芽茶树中, PAL基因的表达还与花青素的累积呈正相关(r = 1.00)。不过在白化的安吉白茶中, PAL基因的表达与儿茶素类化合物的累积呈负相关[23]。
CHS (查耳酮合成酶)催化类黄酮生物合成第一步反应, 也是茶树中儿茶素类物质生物合成的关键酶之一, 其催化合成的柚皮素查耳酮, 经CHI (查耳酮异构酶)、F3H (黄烷酮3-羟化酶)、DFR (二氢黄酮醇4-还原酶)和ANS (花青素合成酶)催化生成花青素[2, 3, 4]。本试验中, 紫芽茶树各叶位CHS、CHI、F3H、DFR、ANS这5个酶基因表达均较对照上调, 这与紫芽叶片中花青素含量比对照高出7.49~27.00倍的结果相吻合。
花青素的基本结构是2-苯基苯并吡喃, 由于取代基不同(羟基或甲氧基), 形成了各种各样的花青素, 矢车菊素(cyanidin)、天竺葵素(pelargonidin)和飞燕草素(delphindin)是植物常见的花青素。其中矢车菊素的合成需要F3’ H的参与, 以催化B环3’ 位的羟基化, 而飞燕草素则需经过F3’ 5’ H催化B环3’ 5’ 位的羟基化而形成[2, 3, 4]。本试验中, 紫色芽叶植株的花青素同F3’ H和F3’ 5’ H的相关性都达到显著水平, 而绿色芽叶植株的花青素仅同F3’ H的相关性达到显著水平。这是否预示着绿色芽叶植株中花青素主要是B环3’ , 4’ -二羟基化型, 而紫色芽叶植株中存在B环3’ , 4’ -二羟基化型和B环3’ , 4’ , 5’ -三羟基化型的花青素, 尚需验证。
从类黄酮代谢途径可以看出, 花青素的合成在儿茶素类物质(EC、EGC、ECG和EGCG)之前, 花青素还原酶(ANR)催化花青素(cyanidin和delphinidin)合成两种表儿茶素类(EC和EGC), 继而合成酯型儿茶素类(ECG和EGCG)。据Pang等[24]研究表明, 茶树中的ANR1和ANR2都能将花青素(cyanidin和delphinidin)转化成两种表儿茶素类(EC和EGC)。本研究中, 紫芽植株的ANR1和ANR2相对于对照均上调, 这说明造成紫芽中总儿茶素含量比对照低不是由花青素还原酶(ANR)引起, 而是由其他因素引起的。
对紫色芽叶茶树中的花青素分离鉴定[9, 10, 12, 15]发现, 其花青素主要有飞燕草-3-O-(6-(E)-p-香豆酰)吡喃型半乳糖苷、飞燕草-3-O-(6-(E)-p-香豆酰)吡喃型葡萄糖苷、矢车菊-3-O-(6-(E)-p-香豆酰)吡喃型半乳糖苷、矢车菊-3-O-(6-(E)-p-香豆酰) 吡喃型葡萄糖苷、飞燕草-(Z)-p-香豆酰-吡喃型半乳糖苷和矮牵牛素-(E)-p-香豆酰-吡喃型半乳糖苷。由此可见, 茶叶中的花青素主要是B环3’ , 4’ -二羟基化型和B环3’ , 4’ , 5’ -三羟基化型, 并以葡萄糖苷和半乳糖苷的形式存在。本实验中的紫芽植株芽下第一叶中花青素含量为866.08 µ g g-1鲜重, 明显高于对照植株, 但紫芽植株与对照绿芽植株都是来源于湄潭苔茶, 具有类似的遗传背景。为什么二者在相关基因表达、儿茶素类物质组成与含量、花青素含量上存在显著性差异?又是什么调节这种差异?是否是紫芽植株中类黄酮-3-O-糖基转移酶(UDPG-flavonoid glucosyltransferase UFGT)活性比对照绿芽植株高, 从而有利于紫芽植株中花青素(苷)的累积, 减少了儿茶素类物质的合成?这些问题是需研究的重点。本课题组正在进行的紫芽茶树转录组分析、相关基因克隆与酶学分析, 也许将能为上述疑问提供部分解释。
本试验中所用的紫色芽叶茶树与对照绿色芽叶茶树, 在叶色上存在显著差异。相对于对照, 紫芽茶树花青素含量高, 儿茶素类化合物总量低; 类黄酮生物合成关键酶(PAL、CHS、CHI、F3H、DFR、ANS、ANR1、ANR2、F3’ H和F3’ 5’ H)基因表达量上调。紫色芽叶中, 各相关基因(LAR除外)表达量, 不仅同总儿茶素累积相关性高(r = 0.84~0.99), 而且与花青素累积相关性也较高(r = 0.72~1.00)。绿色芽叶中, 各基因(LAR、F3° H除外)表达量仅同总儿茶素累积相关性高(r = 0.64~0.77)。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|