第一作者联系方式: E-mail: 932197016@qq.com, Tel: 010-82106043
为探讨乙矮合剂对密植夏玉米叶片衰老及后期早衰的调控机制, 建立华北夏玉米区密植高产稳产化学调控技术, 以中单909和浚单20为材料, 设置乙矮合剂(ECK)和密度梯度处理, 研究密度梯度对夏玉米花粒期不同部位叶片衰老特性的影响与ECK的调控效应。结果表明, 随密度增加, 两品种花粒期单株叶面积减小且降幅增大; 各叶位叶片的叶绿素相对含量和可溶性蛋白含量呈下降趋势; 超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性呈降低趋势; 丙二醛(MDA)含量则呈增高趋势; 上述指标在叶位和品种间存在差异。ECK处理显著提高各密度不同部位叶片SOD、CAT、POD活性和叶绿素相对含量及可溶性蛋白含量, 显著降低MDA含量; 单株绿叶面积降幅减小, 叶片衰老进程延缓, 衰老程度减轻。ECK处理后, 较高密度群体下(7.5~10.5万株 hm-2), 中单909和浚单20较各自对照分别增产5.59%~6.63%和6.73%~8.10%。因此, 采用合理的种植密度结合喷施乙矮合剂可作为华北夏玉米区高产栽培的重要技术措施。
In order to explore the effects of ethylene-chlormequat-potassium (ECK) on leaf aging and early senescence in summer maize, and provide a theoretical basis for high and stable yields of summer maize under high planting density by chemical regulation technology in North China Plain, a field experiment was conducted using two types of maize hybrids (Zhongdan 909 and Xundan 20) with treatments of ethylene-chlormequat-potassium under different planting densities. The results showed that the increased planting density significantly decreased leaf area (LA) per plant and increased LA reduction rate. With the increase of planting density decreased SPAD value, soluble protein content, and activities of superoxide dismutase (SOD), catalase (CAT) and peroxidase (POD) of ear leaf, the third leaf above ear, and the third leaf below ear, while malondialdehyde (MDA) content increased. The above indexes had differences among varieties and leaf positions. ECK treatment significantly increased activities of superoxide dismutase (SOD), catalase (CAT) and peroxidase (POD), SPAD value and soluble protein content in leaves at different positions, decreased LA reduction rate, delayed and alleviated leaf senescence. Under the density of ≥7.5×104 plant ha-1, the yield of Zhongdan 909 and Xundan 20, compared with their own controls, increased by 5.59-6.63% and 6.73-8.10%, respectively. ECK treatment significantly prevented early senescence under higher planting densities, therefore increased yield. Thus, adopting an appropriate planting density combined with ECK application could be an important technique for achieving high grain yield in summer maize production in North China Plain.
增加种植密度是玉米获得高产的重要途径之一[1, 2]。然而, 增密将导致群体冠层郁闭, 通透性差, 光热资源分布不均, 冠层基部温度低、光照不足; 同时, 增加密度引起耕层根系数量增加, 植株间对有限养分水分资源的激烈竞争使个体生长发育差, 根系活力低, 地上部叶片功能期缩短, 导致花粒期群体早衰[3, 4]。花粒期是玉米产量形成的关键时期, 该时期叶片开始衰老, 叶片功能开始衰退; 已有研究表明, 叶片的衰老伴随着活性氧的积累以及细胞中抗氧化酶活性的降低[5]。研究发现, 种植密度与叶片衰老密切相关, 王海燕等研究表明, 玉米花粒期不同层位叶片的SPAD值、光合速率、气孔导度、蒸腾速率随密度增加而降低[6]; 解振兴等[7]研究表明, 随种植密度增加, 玉米穗位叶保绿度、叶绿素含量下降, 超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性降低, 丙二醛(MDA)含量升高; 乔宏伟等[8]研究表明, 玉米不同层次叶片的可溶性蛋白含量低密度下均高于高密度下, 而可溶性蛋白含量与植株体内生理代谢的强度密切相关[9], 并进一步影响着叶片的功能与衰老, 以及光合产物在籽粒中的积累过程和最终的籽粒产量。
玉米籽粒产量形成阶段与叶片衰老过程同步进行, 随灌浆进程发展, 叶片逐渐衰老, 因此, 在此期间延缓叶片衰老有利于增强叶片光合功能, 获得更高产量[10]。虽然, 将适宜的种植密度和播种方式、行间距配置[11]相结合, 配合分次施氮肥且适当增加花粒肥比例[12]等栽培措施相集成[13], 在一定程度上, 提高了玉米密植群体叶片抗氧化酶活性, 延缓了植株衰老, 在一定密度范围内, 提高了籽粒产量, 但是, 应用化学调控技术可以通过调节作物自身的内源激素平衡, 调控作物的生长发育进程, 调控作物对水分、养分的吸收同化运转, 改善作物自身对环境的适应能力, 最终可以有效改善作物的产量形成, 显著提高产量[14, 15, 16]。研究表明, 外施矮壮素可以提高作物保护酶活性和可溶性蛋白含量, 进而提高作物的抗逆性[17, 18]。适宜浓度的乙烯利可以促进根系生长, 并调控株型结构, 增加玉米产量[19, 20]。
目前, 在华北夏玉米大田生产中, 抗倒伏增产调节剂— — 乙矮合剂(乙烯利∶ 矮壮素=1∶ 3, 含量为28%)应用面积较大, 在密植群体矮化株高、抗倒伏等方面效果显著[21, 22], 但是, 上述研究均限于夏玉米生育前期, 即六展叶期处理对株型建构、茎秆质量形成和根系建构等方面的影响, 而有关乙矮合剂对生育后期(花粒期— — 即产量形成时期)不同密度群体夏玉米抗早衰效果的研究, 尤其是对不同部位叶片的衰老特性调控效果方面的研究, 尚未见报道。因此, 本试验采用不同基因型品种为试材, 设置乙矮合剂化学调控和密度梯度处理, 研究密度梯度对夏玉米花粒期不同部位叶片抗氧化特性的影响与乙矮合剂的化学调控效应, 探讨乙矮合剂调控玉米叶片抗氧化特性、防止花粒期叶片早衰的生理机制, 为建立华北夏玉米区密植高产稳产化学调控技术提供科学依据。
以不同基因型品种中单909 (由中国农业科学院作物科学研究所选育, 耐密性较强, 以下简称ZD)和浚单20 (由河南省浚县农业科学研究所选育, 耐密性较差, 以下简称XD)为试材。
试验于2013年和2014年在中国农业科学院新乡试验站进行, 试验地常年平均气温14.3℃, 常年平均降雨量560.6 mm, 年际内降雨分布不均, 大部分集中于6月至9月份, 约占全年降雨量的75%。试验地土壤为黏壤二合土, 土壤含有机质12.55 g kg-1、全氮1.13 g kg-1、速效磷16.15 mg kg-1、速效钾109.95 mg kg-1, pH 8.1。采用裂区设计, 化学调控处理(TR)为主区, 于六展叶期叶面喷施乙矮合剂0.45 L hm-2, 每公顷兑水225 L, 对照(CK)喷施等量清水; 密度处理为副区, 设置4.5万株 hm-2、6.0万株 hm-2、7.5万株 hm-2、9.0万株 hm-2、10.5万株 hm-2 5个密度水平, 分别用D1、D2、D3、D4、D5表示。试验小区为12行区, 60 cm等行距, 小区面积57.6 m2, 3次重复。基施复合肥(N∶ P2O5∶ K2O=15∶ 15∶ 15, 总养分≥ 45%) 375 kg hm-2, 追施尿素600 kg hm-2, 60%拔节期追施, 40%大口期追施。其他管理同当地大田生产。2013年6月16日播种, 9月26日收获。2014年6月8日播种, 9月20日收获。
乙矮合剂(ethylene-chlormequat-potassium, 以下简称ECK)由中国农业科学院作物科学研究所栽培生理系研制, 黑龙江禾田丰泽兴农科技开发有限公司生产提供。
开花期选取同天开花且长势长相基本相同的单株挂牌标记, 从开花之日起, 每10 d取样1次, 取穗位叶、穗上第3叶、穗下第3叶(去除叶脉后取叶片中部), 液氮速冻后放入-20℃冰柜储存待测生理指标。
取各叶位叶样品0.5 g, 分别加入5 mL pH 7.8磷酸缓冲液, 冰浴研磨, 10 000× g冷冻离心20 min, 上清液即为酶液。
1.2.1 叶面积和叶片衰老程度
从每个小区选择代表性样株3株, 开花后每10 d 一次, 采用长宽系数法, 测定并计算绿叶面积(LA); 参考Tollenaar等[23]方法, 用2次测得的绿叶面积相对减少的比例来描述叶片衰老程度, 即LA降幅(%) = (LAt2 - LAt1)/ LAt1 × 100。
1.2.2 叶绿素相对含量
采用日本美能达公司产手持式SPAD-502型叶绿素计测定穗位叶、穗上第3叶、穗下第3叶的叶绿素相对含量(SPAD值)。
1.2.3 可溶性蛋白含量
采用考马斯亮蓝G-250染色法测定。吸取酶液20 μ L, 加入考马斯亮蓝G-250溶液3 mL, 混匀, 在室温下静置2 min, 595 nm处比色[24]。
1.2.4 SOD、POD、CAT活性
参照王爱国等[25]的方法测定SOD活性, 吸取20 μ L酶液, 加入3 mL SOD 反应液(0.05 mol L-1pH 7.8磷酸缓冲液1.5 mL, 130 mmol L-1 Met 0.3 mL, 750 μ mol L-1 NBT 0.3 mL, 100 μ mol L-1 EDTA-Na2 0.3 mL, 20 μ mol L-1 FD 0.3 mL, 蒸馏水0.3 mL), 照光30 min, 对照与酶液置相同条件下光照, 空白置于暗处用于调零, 560 nm处比色。参照李忠光等[26]的方法测定POD活性, 吸取20 μ L酶液加入3 mL POD反应液(1.4 μ L愈创木酚, 0.85 μ L 30% H2O2和0.1 mol L-1 pH 6.0磷酸缓冲液), 470 nm下比色每隔30 s读吸光度增加值。参照林植芳等[27]的方法测定CAT活性, 吸取50 μ L酶液加2.5 mL CAT反应液(0.5 mL 0.1 mol L-1 H2O2溶液, 2.5 mL 0.1 mol L-1 pH 7.0磷酸缓冲液), 240 nm下比色, 每隔30 s读取吸光度的下降值。
1.2.5 MDA含量
参照林植芳[27]的方法测定。1 mL酶液加2 mL 0.6% TBA, 沸水浴15 min, 迅速冷却后离心, 取上清液, 分别在600、532和450 nm 3个波长下比色。
1.2.6 产量及其构成
在每处理小区中选取10 m2称重计产, 并选取20个平均穗调查穗部性状, 测定出籽率和含水率, 计算产量(按14%含水率计)。
采用Microsoft Excel 2007作图, SPSS 17.0统计分析, LSD检验处理平均数间差异显著性(P < 0.05* ; P < 0.01* * )。两年的试验结果趋势基本一致, 本文采用2014年的数据。
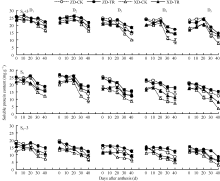
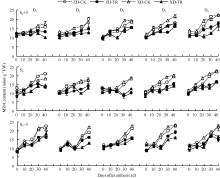
如图1所示, 吐丝期至成熟期, D1~D5各密度处理花后每隔10 d叶面积显著下降, ZD降幅分别为2.98%~14.88%、3.91%~19.12%、3.35%~20.49%、8.35%~23.37%和8.98%~22.98%; XD降幅分别为4.90%~15.23%、4.41%~20.58%、7.12%~26.41%、6.01%~23.41%和5.57%~29.69%。可见, 在灌浆过程中两玉米品种单株叶面积降幅随种植密度增加而增大; 且ZD的D3、D4、D5密度处理花后30~40 d叶面积降幅达20%以上, XD的D2、D3、D4、D5密度在花后30~40 d叶面积降幅达20%以上。
ECK处理后, 显著减小了两玉米品种叶面积降低幅度(P < 0.05* ), ZD-TR花后每隔10 d叶面积降幅较清水对照分别平均减小了14.44%、26.50%、42.47%、40.25%和25.26%; XD-TR较清水对照分别平均减少了18.19%、12.41%、39.44%、38.12%和20.72%。
ZD和XD的叶片SPAD值随密度增加而降低, 尤其在花后40 d高密度下叶片SPAD值下降速率较快(图2)。D1~D5各密度, 吐丝期两品种各叶位SPAD值无显著差异; 花后20 d开始, 叶片SPAD值随密度增加而减小且下降较快; 花后40 d, D3~D5密度下显著低于D1、D2密度。穗位叶和穗上3叶花后30~40 d显著下降, 而穗下第3叶花后20~40 d显著下降。
ECK处理提高了花后20~40 d不同叶位SPAD值, 尤以穗位叶和穗下第3叶增幅显著。D1~D5各密度, ZD-TR穗上第3叶、穗位叶和穗下第3叶较各自清水对照平均增幅分别为5.43%~9.19%、3.49%~ 7.84%和3.68%~14.86%; XD-TR平均增幅分别为2.71%~9.77%、3.92%~11.34%和2.13%~17.71%。
如图3所示, 穗上第3叶D1~D5和穗位叶D1、D2, 花后20 d开始下降且随密度增加降幅加大; 穗位叶D3~D5和穗下第3叶D1~D5花后一直呈下降趋势。D1~D5各密度, 两品种穗上第3叶和穗位叶的可溶性蛋白含量显著高于穗下第3叶。
ECK处理提高了两品种D1~D5密度不同灌浆阶段不同部位叶片可溶性蛋白的含量, 其中, 穗上第3叶花后30~40 d可溶性蛋白含量, ZD-TR和XD-TR较各自清水对照平均提高5.54%~20.20%和13.00%~ 48.34%; 穗位叶花后20~40 d可溶性蛋白含量, ZD-TR和XD-TR增幅分别为13.42%~19.72%和16.43%~62.90%; 穗下第3叶花后20~40 d可溶性蛋白含量, ZD-TR和XD-TR增幅分别为21.15%~ 44.48%和21.67%~61.80%。增幅表现为穗下第3叶> 穗位叶> 穗上第3叶。
2.4.1 对SOD活性的影响
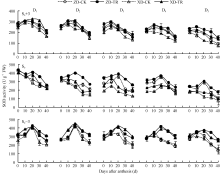
两品种各密度各叶位SOD活性呈单峰曲线变化(图4), 且峰值出现时间不同, 穗上第3叶D1~D4出现在花后10 d, D5出现在花后0 d; 穗位叶D1~D2出现在花后0 d, D3~D5出现在花后20 d; 穗下第3叶D1~D3出现在花后20 d, D4~D5出现在花后10 d。D1~D5的SOD活性, 随密度增加而降低; 且穗下第3叶> 穗位叶> 穗上第3叶; 品种间以ZD高于XD。
ECK处理提高了两品种各密度各叶位SOD活性。ZD-TR和XD-TR穗上第3叶SOD活性较各自清水对照分别增加6.68%~19.84%和33.54%~46.94%; 穗位叶SOD活性, 分别增加16.49%~32.23%和3.57%~36.72%; 穗下第3叶SOD活性分别增加9.95%~38.27%和16.02%~32.15%。
2.4.2 对POD活性的影响
两品种各密度各叶位POD活性呈单峰曲线变化(图5), 除穗下第3叶外, 峰值均出现在花后20 d。D1~D5处理的各叶位POD活性随密度增加而降低; 且ZD表现为穗下第3叶> 穗上第3叶> 穗位叶; XD表现为穗下第3叶> 穗位叶> 穗上第3叶。品种间以ZD高于XD。
ECK处理提高了两品种各叶位POD活性, 其中, ZD-TR和XD-TR穗位叶D1和D2低密度下差异不显著, D3~D5高密度下花后20~40 d差异达显著水平, 平均增幅分别为19.12%~36.39%和34.25%~41.21%; 而穗下第3叶D1~D5增幅分别为7.29%~21.75%和18.46%~32.70%。
2.4.3 对CAT活性的影响
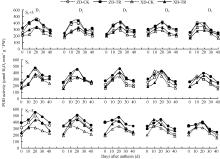
D1~D5密度下CAT活性的变化在穗上第3叶呈单峰曲线, 峰值为花后20 d, 且随密度增加差异不显著; 在穗位叶和穗下第3叶则呈下降趋势; 品种间以ZD高于XD (图6)。
ECK处理提高了两品种各叶位CAT活性。其中, 穗上第3叶CAT活性在D4~D5高密度下增幅达显著水平, ZD-TR和XD-TR平均增幅分别为22.13%~ 24.90%和57.62%~68.16%。D1~D5密度下穗位叶在花后20~40 d增幅达显著水平, ZD-TR和XD-TR平均增幅分别为6.56%~59.56%和36.77%~123.43%; 穗下第3叶(除了D1、D2、D3密度下花后0 d)差异均达显著水平, 平均增幅分别为22.47%~77.79%和63.28%~156.28%。
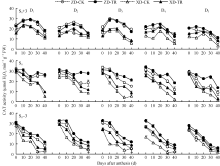
由图7可知, 同一密度处理下, ZD和XD不同叶位叶片膜质过氧化产物MDA 含量在花粒期总体表现为上升的趋势且XD高于ZD。随密度增加, MDA含量升高, 且穗位叶和穗下第3叶升高的趋势更为显著。
ECK处理降低了两品种玉米各叶位叶片MDA含量。D1~D5密度下ZD-TR和XD-TR穗上第3叶MDA含量比清水对照平均下降7.09%~15.45%和14.89%~28.44%; 穗位叶平均下降16.45%~19.74%和17.72%~25.68%; 穗下第3叶平均下降8.43%~ 17.03%和11.44%~24.32%。
绿叶面积及其降低幅度(失绿)可作为评价叶片衰老程度的指标。将各密度两品种各叶位叶片衰老指标与抗氧化酶系活性、MDA含量、SPAD值及可溶性蛋白含量之间进行相关分析, 结果如表1所示。ZD-CK叶片衰老与SOD、POD、CAT活性呈极显著负相关, 与SPAD值和可溶性蛋白含量呈极显著负相关; 其叶片MDA含量与SOD、POD和CAT活性呈极显著负相关, 与SPAD值和可溶性蛋白含量呈极显著负相关。而ZD-TR叶片衰老与POD活性相关性不显著, 叶片MDA含量与POD活性相关性不显著, 其他指标与ZD-CK一致。XD-CK和XD-TR的相关分析结果一致, 叶片衰老与SOD、CAT活性呈极显著负相关, 与SPAD值和可溶性蛋白含量呈极显著负相关; 其叶片MDA含量与SOD、CAT活性呈极显著负相关, 与SPAD值和可溶性蛋白含量呈极显著负相关。
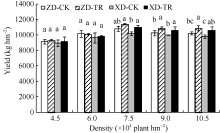
2.7.1 对产量的影响 由图8可知, 两玉米品种产量随密度增加呈先增加后降低趋势, D3密度达最大值, 且ZD的产量高于XD。ZD在D3密度下比D1和D2分别高1654.31 kg和646.54 kg, 比D4和D5分别高555.10 kg和596.88 kg。XD在D3密度下比D1和D2分别高1256.30 kg和557.66 kg, 比D4和D5分别高225.63 kg和396.38 kg。ECK处理后, 高密群体(D3、D4、D5) ZD-TR和XD-TR的产量与各自CK相比, 差异达显著水平(P< 0.05* ), ZD-TR在D3、D4、D5密度下分别增产5.59%、6.11%和6.43%; XD-TR在D3、D4、D5密度的增幅分别为7.51%、8.10%和6.73%。
| 表1 不同密度夏玉米叶片衰老与抗氧化酶(SOD、POD、CAT)活性、MDA、可溶性蛋白含量及SPAD值的相关性 Table 1 Correlation coefficients of leaves senescence with antioxidant enzyme (SOD, POD, CAT) activities, MDA, soluble protein contents, and SPAD value in summer maize under different planting densities |
2.7.2 对产量构成因素的影响
如表2所示, D1~D5密度下两品种有效穗数随密度增加而增加; ECK处理后, D3、D4、D5密度下增加显著, ZD-TR的增幅分别为2.04%、4.58%、2.42%, XD-TR的增幅分别为5.91%、4.24%、4.31%。在D1~D5密度下, 两品种穗行数随密度增加有所降低但差异不显著; 行粒数随密度增加而显著减少。ECK处理后, ZD和XD的行粒数较各自清水对照均增加。两品种的穗行数略有增加, 但差异不显著。在D1~D5密度下, ZD-TR的行粒数增幅分别为3.30%、0.68%、2.89%、7.05%、2.13%; XD-TR的增幅分别为2.08%、2.08%、6.81%、9.66%、4.60%。两玉米品种千粒重随密度的增加而降低, 品种间表现为ZD大于XD。ECK处理后, 不同密度处理下两品种千粒重均高于各自清水对照, 在D3、D4、D5密度下达显著水平; 在D3、D4、D5密度下, ZD-TR的增幅分别为4.46%、6.99%、4.31%; XD-TR的增幅分别为5.96%、4.69%、5.90%。
| 表2 乙矮合剂对不同密度夏玉米产量及产量构成的影响 Table 2 Effect of Ethylene-Chlormequat-Potassium (ECK) on yield components of summer maize under different planting densities |
花粒期是玉米产量形成的关键时期, 随着籽粒灌浆的进程, 叶片的功能逐渐衰退, 叶片失绿, 衰老脱落, 有效光合叶面积减小, 因此, 在此期间保持较高的光合面积, 有利于增加后期干物质生产和积累, 有利于提高产量。叶片失绿速率、持绿时间和绿叶面积等可作为评价衰老进程和程度的指标[7, 28, 29]。增加种植密度导致作物冠层郁闭, 光、温和CO2分布不均, 直接影响叶片的光合效率和干物质积累, 导致有效光合面积减少, 叶片早衰。本研究结果, 不同种植密度处理下夏玉米单株叶面积从灌浆中后期开始下降, 特别是进入乳熟期后迅速下降, 并随种植密度的增加降幅加大, ZD和XD在D3、D4、D5密度处理下花后30~40 d叶面积降幅达20%以上, 与前人研究结果一致[3]; 而ECK处理, 减小了两玉米品种叶面积降低幅度, 延缓叶片衰老, 其中, XD-TR在D5密度处理下花后30~40 d叶面积比对照增加达20%以上。
增加种植密度导致玉米穗位叶保绿度、叶绿素含量下降[7], 花粒期不同层位叶片的SPAD值和可溶性蛋白含量降低[6, 8]; 本研究发现, 花后20 d (灌浆中期)是叶片叶绿素含量变化的转折点, 该时期随密度增加叶片SPAD值开始快速下降, 且D3~D5密度处理下显著低于D1、D2密度; 至成熟期这种趋势最为显著且穗下第3叶对密度的反应也最为敏感。ECK处理提高了叶片SPAD值, 而且, ECK处理小区和清水对照小区玉米叶片衰老进程出现差异的临界点正是开花后20 d。因此, 喷施乙矮合剂有利于延缓中下部叶片的衰老, 有利于灌浆中后期叶片维持较高的有效光合面积。
叶片衰老过程是活性氧代谢失调的过程, 而SOD、POD和CAT是植物体内最重要的活性氧清除酶类[5]。水分、温度和养分亏缺等逆境胁迫条件以及增加种植密度, 均导致玉米叶片的保护酶活性提高, 从而有效减轻膜脂过氧化程度[12, 14, 30]。本研究发现, 随密度增加, SOD、POD、CAT活性降低, 且对密度的响应存在叶位和品种的差异。ECK处理显著提高了两品种各密度各叶位SOD活性; 显著提高两品种穗位叶D3~D5密度下花后20~40 d和穗下第3叶各密度处理下的POD活性; 显著提高两品种穗上第3叶在D4~D5高密度下CAT活性、穗位叶各密度在花后20~40 d的CAT活性、穗下第3叶(除了D1、D2、D3密度下花后0 d)的CAT活性。相关分析表明, ZD叶片衰老进程与SOD、POD、CAT活性极显著负相关, XD与SOD、CAT活性显著负相关, 且MDA含量与SOD、CAT活性极显著负相关。ECK处理显著提高了不同叶位叶片SOD、POD、CAT活性, 显著降低了膜脂过氧化产物含量, 尤其对下部叶片更为显著, 使叶片衰老进程延缓, 衰老程度减轻。王永军等[10]研究发现, 不同产量群体的不同叶位保护酶活性也存在差异, 即超高产群体叶片衰老过程中, 上部和中部叶片SOD活性较高, 下部叶片则以SOD、POD和CAT三者活性较高; 普通产量群体仅中部叶片POD和CAT活性较高。可见, 下部叶片SOD、POD、CAT活性高是保障群体高产的有利条件。
进一步分析, 我们得到如下乙矮合剂处理提高密植玉米的抗逆性、延缓衰老的原因。第一, ECK主成分之一矮壮素能够提高作物抗氧化系统酶活性和可溶性蛋白含量, 降低活性氧产生速率, 保持膜完整性, 提高抗逆性[17, 18], 主成分之二乙烯利可以促进根系生长, 并调控株型结构, 增加玉米产量[19, 20]。第二, ECK处理能够改善玉米密植群体的株型结构, 提高茎秆抗倒伏能力, 提高耐密性, 使其更适于密植[21, 22]。第三, ECK处理能够提高NR活性和GS活性, 促进氮素同化作用, 进而提高叶片中叶绿素、可溶性蛋白和游离氨基酸含量, 维持玉米体内基本代谢正常进行(另文发表)。
产量与种植密度呈二次曲线关系[31], 当密度超过适宜密度时, 对光温水肥的竞争导致群体恶化, 叶片早衰直接影响着籽粒灌浆的进程, 最终影响产量和品质[32]。本研究发现, 增加种植密度导致叶片SOD、POD和CAT活性降低, MDA含量升高; 叶片叶绿素和可溶性蛋白含量降低, 叶片早衰, 以及最终产量的下降。前人研究表明, 玉米中下部叶片保护酶活性高和膜脂过氧化程度低是近代玉米品种高产抗逆的内在因素[33], 而ECK处理提高了穗位叶和基部叶片SOD、POD和CAT活性, 提高了可溶性蛋白含量和叶绿素含量, 降低了膜脂过氧化程度, 提高了作物的抗逆性, 延缓了叶片的衰老进程, 最终提高了产量。
中单909和浚单20不同密度群体花粒期单株叶面积随密度增加呈降低趋势且降幅增大, 花后30~40 d的降幅高达20%以上。灌浆中后期(开花后20~40 d), 不同叶位叶片的叶绿素和可溶性蛋白含量显著下降, SOD、CAT、POD活性呈降低趋势, MDA含量则呈增高趋势, 叶片呈现早衰趋势; 上述指标均存在叶位和品种间差异。ECK处理能显著提高各密度不同部位叶片SOD、CAT、POD活性和叶绿素相对含量及可溶性蛋白含量, 降低MDA含量; 增加单株叶面积, 叶面积降幅减小, 绿叶面积增加。因此, ECK处理有助于延缓叶片衰老进程, 减轻衰老程度, 保证植物体内正常的代谢, 改善产量构成因素, 最终提高产量。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|