第一作者联系方式: E-mail: jingang_0317@163.com
本研究旨在通过梅雨前后自然光强明显变化的情况下对水稻叶片光氧化突变体812HS与野生型812S的PSII光化学活性、抗氧化酶活性等生理特性的比较研究, 探讨812HS易受光氧化损伤现象的光合生理原因。结果表明, 大田自然光照出现强光照前, 812HS与812S的叶绿素含量、PSII活性、光合磷酸化活性、净光合速率、抗氧化酶活性和活性氧含量均无显著差异。自然强光照开始(梅雨结束)一段时间后, 两种水稻的上述各项指标都发生了明显的变化。突变体812HS的叶绿素含量、PSII活性、非循环式光合磷酸化活性和净光合速率均明显低于812S。高光强下812HS叶片中抗氧化酶CAT和POD活性的上升幅度则小于812S, 从而使其体内富集了更多的O2܋、H2O2和MDA。光氧化突变体812HS对高光照强度较敏感的PSII活性和较低的CAT、POD活性可能是其发生叶片光氧化现象的生理成因。
To reveal the physiological mechanism of leaf photo-oxidation in a rice mutant 812HS, we compared and analyzed differences of photochemical activity, antioxidative enzyme activities between 812HS and its wild type 812S grown in the field. Results showed that chlorophyll content, PSII activity, photophosphorylation activity, net photosynthetic rate ( Pn) and antioxidative enzymes activities as well as active oxygen contents in 812HS were similar to those in 812S before exposed to high intensity of sunlight. However, all above indexes were affected by a period of high intensity of sunlight. The decreased degree of chlorophyll content, PSII activity, non-cyclic photophosphorylation (NCPS) activity and Pn in 812HS were significantly higher than those in 812S. Besides, high intensity of sunlight led to a lower increase rate of POD and CAT activities in 812HS. Therefore, the contents of O2܋, H2O2, and MDA in 812HS became higher than those in 812S. The result implied that the leaf photo-oxidation of mutant 812HS mainly results from higher sensitivity of PSII activities and lower CAT, POD activities under high intensity of sunlight.
光是植物光合作用必需的能量来源[1]。正常情况下, 太阳辐射的光能被叶绿素吸收后可以驱动类囊体膜上的电子传递系统生成ATP和NADPH[2]。过剩的光能会对植物形成光氧化胁迫, 能够直接降低植物的光合能力, 使其发生明显的光合作用减弱现象[3, 4, 5, 6]。强光甚至中等强光、低CO2环境下的植物都易遭受光氧化的伤害, 寒害和高温等也会促进光氧化的发生[7]。了解水稻光氧化的机制, 对于采取措施缓解伤害以保证水稻高产、稳产有重要意义[8]。
已有的研究大多是在人为创造光氧化胁迫条件下研究水稻的生理生化反应。例如, Jin和Choon[9]通过施加甲基紫精(MV)对水稻造成光氧化胁迫, 研究其机体活性氧(ROS)对光系统I (PSI)和光系统II (PSII)的影响; Ji和Jiao[10]通过设置温度梯度和光照强度梯度, 比较研究不同温度和光照条件下粳稻与籼稻光氧化伤害程度的差异。此外, 前人还利用一些诱变产生的突变体研究水稻中不同基因或组分在应对光氧化胁迫中发挥的作用。如Ye等[11]通过对诱导形成的水稻osotp51突变体研究发现, osotp51基因可以间接影响PSI的结构和功能, 从而导致植株在较低光强下也会发生光抑制现象; Zhou等[12]通过对60Co诱变水稻突变体lyl1的研究, 推测该突变基因可能与叶绿素和α -生育酚的生成有关, 并认为lyl1基因在水稻应对光氧化胁迫和光损伤保护中起重要作用。上述研究结果对于阐明光氧化机制具有重要意义。
水稻812S是江苏省农业科学院两系杂交稻课题组育成的籼稻两用不育系, 812HS是一个来自812S (野生型)的光氧化突变体, 农艺性状与野生型无实质性差别[13]。梅雨寡照季节结束前的秧苗(一般在5月中旬出苗, 至7月上旬梅雨结束), 突变体的表型与野生型基本没有差异。梅雨季节过后, 由于田间自然光照强度的明显增加, 半个月左右后, 突变体812HS的叶片尤其是顶部叶片失绿(发黄), 而野生型812S在表型上不发生这种失绿现象。此外, 在弱光或部分遮光处理的情况下(与不遮光对照的气温相同), 812HS与812S一样, 并不发生叶片失绿现象, 表明主要是光强起作用。遗传分析和基因定位表明, 该光氧化性状受第4染色体上分子标记RM307与RM401之间1个显性基因LPO1控制。通过Gramene检索发现, 该基因是首次报道并实现分子标记定位的光氧化性状相关基因[13]。通过基因精细定位和生物学信息分析, 已经预测了该基因(尚未发表)。由于基因新颖, 突变体与野生型农艺性状又非常接近, 该突变体为进一步了解光氧化调控机制和相关基因功能提供了非常新颖的研究材料[14]。
本试验是在大田自然生长条件和自然光照下进行(遮光试验也在室外自然条件下, 用黑纱网部分遮光), 旨在比较分析光氧化突变体与野生型在光化学活性、能量利用和抗氧化酶活性等方面的差异, 从生理学上分析812HS光氧化现象的原因, 为进一步在分子水平上研究光氧化基因LPO1提供生理依据。
水稻812HS和812S种植于江苏省农业科学院水稻试验田(南京)和南京师范大学仙林校区植物园, 按照水稻常规的种植方法管理。于7月2日(5月15日出苗至7月2日, 自然光照强度正常或较低, 其中6月中旬至7月2日处于梅雨期, 光照强度较低, 2个水稻品种叶色无差异)和8月2日(7月2日至8月2日为高光照强度, 812HS表现出叶片明显失绿)采样测定(倒二或倒三叶), 3次重复。
在室外条件下, 用黑纱网部分遮光, 使水稻冠层光强降低约2/3 (气温相同), 观察叶色变化, 测定叶绿素含量的差异。
1.2.1 叶绿素含量
将水稻叶片剪碎, 放入无水乙醇与丙酮的混合液(1∶ 1)中浸泡过夜提取叶绿素。用紫外分光光度计(GBC, Australia)分别测量提取液在663、645和440 nm处的吸光值, 根据Arnon[15]的方法计算获得叶绿素a和叶绿素b的含量, 并计算叶绿素a/b值。
1.2.2 叶绿素荧光的快速测定
按照Schansker等[16]的方法, 用便携式植物效率仪(Hansatech, UK)测量叶绿素a的荧光。测量之前, 先用叶片夹夹住水稻叶片进行30 min的暗处理, 然后用光量子为1500 µ mol m-2 s-1的650 nm波长照射1 s后测定荧光值。测得的参数主要包括PSII的最大量子产额(Fv/Fm)、单位反应中心吸收的光能(ABS/RC)、单位反应中心捕获的光能(TR/RC)、单位反应中心传递的电子能(ET/RC)和单位反应中心的热耗散能量(DIo/RC)。
1.2.3 净光合速率 根据Jé ré mie等[17]的方法, 用Li-6400便携式光合测定系统(Li-Cor, USA)在自然生长条件下测定水稻叶片的净光合速率(net photosynthetic rate, Pn)和胞间CO2浓度(intercellular CO2 concentration)。测量时, 保持500 µ mol s-1的空气流速, 360 µ mol s-1的CO2浓度, 样品室内光合光子通量密度(photosynthetic photon flux density, PPFD)为1000 µ mol m-2 s-1。
1.2.4 光合磷酸化活性 根据Ketcham等[18]的方法略加修改后制备叶绿体溶液悬浮液, 测定光合磷酸化活性。取1 g去中脉的叶片剪碎, 用10 mL冰浴的提取液[50 mmol L-1 Tris-HCl (pH 7.6), 5 mmol L-1 MgCl2, 10 mmol L-1 NaCl, 0.4 mol L-1蔗糖, 0.1%牛血清蛋白(BSA)]将其匀浆, 经4层纱布过滤后, 以200× g冷冻离心2 min, 保留上清液, 再经2000× g冷冻离心5 min, 即得叶绿体沉淀。用提取液重悬叶绿体沉淀即得叶绿体悬浮液。
利用Fluoroskan Ascent FL发光光度计(Thermo Scientific, America)测定光合磷酸化活性。0.1 mL叶绿体悬浮液与0.9 mL反应缓冲液[10 mmol L-1 K3Fe(CN)6, 0.2 mol L-1 Tricine (pH 8.0), 20 mmol L-1 MgCl2, 20 mmol L-1 Na2HPO4和20 mmol L-1 (ADP)]混匀之后光照(50 μ mol m-2 s-1) 1 min, 加入20%的三氯乙酸(TCA)终止反应。然后, 1000× g离心5 min, 得上清液。用9.9 mL 0.02 mmol L-1 Tris-HCl (pH 7.5)与0.1 mL的上清液混匀得反应液。最后, 用0.2 mL的反应液与0.8 mL的荧光素酶液混合, 在Fluoroskan Ascent FL发光光度计(Thermo Scientific, America)中测定光合磷酸化活性。
1.2.5 抗氧化酶的提取及其活性测定
根据GarcÍ a等[19]的方法并略加修改后制备粗酶液。1 g去脉的水稻叶片加入10 mL预冷的50 mmol L-1的磷酸钠缓冲液(PBS)研磨至匀浆状。在4℃条件下, 将匀浆12 000× g离心10 min, 上清液即为粗酶提取液。
参照Mandhania等[20]的方法, 通过分析对氮蓝四唑(NBT)化学还原的抑制状况测定超氧化物歧化酶(SOD)活性。粗酶提取液与反应液[0.13 mol L-1甲硫氨酸, 0.75 mmol L-1 NBT, 0.1 mmol L-1 EDTA, 50 mmol L-1 PBS (pH 7.8), 0.02 mmol L-1核黄素]按照1∶ 59的比例混匀后, 于50 µ mol s-1光照下反应15 min。两个对照组以等体积的蒸馏水代替粗酶提取液, 并且把其中一个置暗处作为空白对照。最后, 分别测定各管在560 nm的吸光值。SOD活性以抑制NBT光化还原的50%为一个酶活性单位。
根据Beers和Sizer[21]的方法测定过氧化氢酶(CAT)活性。3 mL的反应体系包括1 mL 0.3% H2O2[0.1 mol L-1 PBS (pH 7.0), 30% H2O2], 1.9 mL H2O和0.1 mL酶液。测定反应液在240 nm波长处吸光值的降低速度。将每分钟吸光值降低0.01定义为CAT的一个酶活性单位(U)。
参照Ou等[22]的方法测定过氧化物酶(POD)活性。反应体系含0.1 mL PBS, 28 μ L愈创木酚, 19 μ L H2O2和0.05 mL酶液。加入酶液后启动反应, 记录紫外分光光度计470 nm波长处吸光值的增加速度。将每分钟吸光值升高0.01定义为一个酶活单位。
1.2.6 O2܋和H2O2含量
按照王爱国和罗广华[23]的方法加以修改后进行O2܋含量的测定。1 g去中脉叶片在0.5 mmol L-1的磷酸缓冲液(pH 7.8)中研磨后经12 000× g离心10 min。取1 mL上清液加入0.9 mL的0.05 mol L-1磷酸缓冲液(pH 7.8)和0.1 mL的氯化羟胺, 25° C下混合培养20 min。取1 mL上述培养液依次加入17 mmol L-1对氨基苯磺酸和17 mmol L-1 α -苯胺各1 mL, 25℃反应20 min。测定反应液在530 nm处的吸光值, 根据标准曲线计算O2܋的含量。
取上述离心得到的上清液1 mL, 借助H2O2含量测定试剂盒(建成生物公司, 中国南京), 按照说明书的要求测定H2O2含量, 并同时以蒸馏水为空白对照, 测定各样品在405 nm处的吸光值。根据公式计算H2O2含量。
1.2.7 丙二醛含量
按照华春和王仁雷[24]的方法测定。取上述粗酶提取液1.5 mL, 与2.5 mL含有0.5%硫代巴比妥酸(TBA)的20%三氯乙酸(TCA)溶液混匀, 沸水浴10 min, 迅速冷却, 1800× g离心10 min, 分别在532、600和450 nm处测定上清液的吸光值。
图1展现的是强光照前后突变体812HS和野生型812S的表型变化。7月2日(之前一段时间为梅雨季, 寡照), 突变体的表型与野生型没有明显差异。8月2日, 由于7月中下旬至8月初光照强度明显较强, 突变体812HS的叶片出现明显的失绿现象, 尤其是顶部更甚, 而野生型812S无此现象(图1)。
在部分遮光试验中, 根据实际测定, 黑纱网遮去光强约65% (晴天测定, 自然光强平均值1308 µ mol m-2 s-1, 遮光后水稻冠层顶部光强平均值为468 µ mol m-2 s-1)。从出苗后直至8月2日, 部分遮光处理的812HS与812S叶色一直没有明显差别。而在同时进行的黑纱网外的对照实验中(正常自然光, 气温相同), 812HS与812S叶色差异明显, 812HS明显失绿, 812S叶色正常(图2), 叶绿素的测定结果也证实了目测对叶色的判断(表1), 表明是光强的差别导致了叶色失绿。8月2日揭去黑纱网, 1周后, 812HS逐渐失绿, 15 d后, 叶色明显失绿, 而812S叶色变化仍然不大, 再次验证了光强导致的叶色变化。表2的叶绿素测定结果也证实了以上的结论。实验表明, 是光强的不同造成了叶色的差异, 而非品种本身的遗传性早衰。如果是遗传性早衰, 失绿特性是由遗传基因决定的, 将不受光强条件的限制, 在正常光或稍弱光下也能表达早衰失绿特性。
| 表1 自然光照条件和部分遮光下812HS和812S的叶绿素含量 Table 1 Changes of chlorophyll contents in rice leaves of mutant 812HS and 812S under natural sunlight and partial shading sunlight (mg g-1 FW) |
由表2可知, 田间生长条件下, 在7月2日, 2个品种的叶绿素a、叶绿素b含量及叶绿素a/b值之间均没有显著差异(P > 0.05)。8月2日, 2个品种的光合色素均相应减少。812HS的叶绿素a、叶绿素b及叶绿素a/b的降幅分别为16.9%、11.2%和11.1%, 明显高于812S的6.5%、5.2%和5.7%。其中, 812HS的叶绿素a含量下降尤其明显, 与812S差异显著(P< 0.05)。说明812HS的反应中心色素对光照强度的敏感度高于野生型, 更容易受到高光强的伤害。
如表3所示, 7月2日, 812HS的ABS/RC、TRO/RC、ETO/RC值都显著低于野生型(P< 0.05), 而DIO/RC和Fv/Fm值均与野生型之间没有显著差异。8月2日, 两个品种的ABS/RC、TRO/RC、ETO/RC和DIO/RC的值都明显升高, 只有Fv/Fm明显降低。812HS的Fv/Fm值显著低于野生型(P< 0.05), 而其ABS/RC、TRO/RC、ETO/RC和DIO/RC值均明显高于812S, 其中TRO/RC差异显著, 从812S显著高于812HS变为812HS显著高于812S。
| 表2 812HS和812S的光合色素含量 Table 2 Pigment contents in leaves of rice mutant 812HS and its wild type 812S |
| 表3 812HS和812S的荧光动力学参数 Table 3 Fluorescence kinetics parameters of rice mutant 812HS and its wild type 812S |
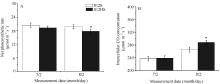
812HS和812S叶片的净光合速率(Pn)如图3-A所示。在相同光合条件下, 7月2日测定Pn, 812HS与812S差异不显著。到8月2日, 2个品种的Pn均有所降低, 但812HS的降幅是812S的1.7倍, 显著低于812S。图3-B表明, 812HS和812S的Ci(胞间CO2浓度)的变化呈现出与Pn相反的趋势。有研究表明, Pn与Ci具有一定的负相关性, Ci值是CO2羧化能力的体现[24]。在高光照强度造成伤害后, 812HS的Ci值明显升高, 意味着其CO2羧化能力降低, 进而影响光合作用的强度。
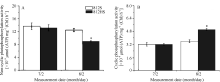
如图4所示, 在7月2日, NCPS活性和CPS活性812HS与812S基本相同(P> 0.05)。8月2日, 812HS和812S的非循环式光合磷酸化(NCPS)及循环式光合磷酸化(CPS)活性都随着光强的变化而改变。812HS的NCPS活性显著低于812S, 而CPS活性则显著高于812S。通过分析上述变化可以发现, 在高光强刺激下, 与野生型812S相比, 突变体812HS的NCPS活性的稳定性较差, 因而较易激发循环式光合磷酸化的活性。激活的循环式光合磷酸化活性可以消耗过剩的能量[25]。
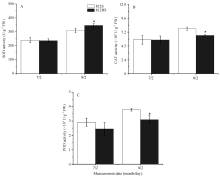
图5表明, 在7月2日, 812HS与812S相比, SOD、CAT和POD活性均无显著差异。8月2日, 两者的各种抗氧化酶活性都明显增加, 但812HS的SOD活性显著高于野生型, 而POD和CAT活性却显著低于野生型。可以推测, 突变体较低的POD和CAT活性可能是其在高光强下表现光氧化现象的原因之一。
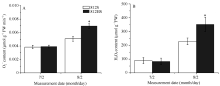
如图6所示, 在7月2日, 812HS细胞内O2܋和H2O2的含量与812S基本相同。8月2日, 两者植株内O2܋和H2O2的含量都升高, 在812HS中富集得更多, 显著高于812S。这可能是812HS的PSII对高强光照较敏感, 其较低的POD、CAT抗氧化酶活性打破了O2܋和H2O2产生与消除之间的动态平衡, 从而植株体内活性氧含量显著增加, 使叶片更易受到伤害。
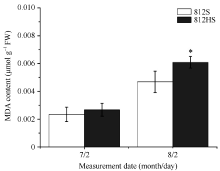
由图7可知, 在7月2日, 812HS和812S的MDA含量均维持在相对较低的水平, 两者间无显著差异。至8月2日, 812HS和812S的MDA含量都明显增加。但是, 812HS的增幅明显高于812S, 差异显著。MDA含量的变化与上述活性氧的变化趋势一致, 这可能是812HS叶片内积累的较高含量的活性氧对其膜脂过量氧化造成的。
叶绿体是植物的光合器官, 也是对光氧化最敏感的细胞器。正常情况下, 叶绿体吸收的光能通过光合电子传递、热耗散和叶绿素荧光形式消耗掉。这3个途径相互竞争, 荧光的变化可以反映光合作
用的水平[22]。本研究发现, 一段时间的强光照之后, 812HS的叶绿素a严重降解, 反应中心失活程度较高, 导致单位反应中心吸收和捕获的光能高于野生型。同时, 812HS叶片中PSII的最大光化学效率Fv/Fm显著低于812S。由此可见, 812HS的PSII活性稳定性比野生型差, 对强光照比较敏感, 其PSII的光能转化效率和潜在活性受到了抑制, 这将会进一步影响光合电子传递和CO2的同化作用。
NCPS的活性依赖于PSII、中间电子载体和PSI [26]。本实验发现, 812HS和812S的NCPS活性变化趋势与PSII一致, 推测812HS的NCPS活性降低可能是其PSII活性的改变造成。之前已有研究发现, 正常情况下, CPS在植物体内光合磷酸化中所占的比例很小, 高光照强度下植物可以通过提高其活性来保护叶片, 从而使植物免受光氧化胁迫的损害[27]。本研究与前人的结果一致, 2种水稻的CPS活性在强光照后都增加, 但812HS的增幅显著高于野生型, 说明CPS作为NCPS的一个辅助途径, 其活性与NCPS活性之间具有一定的负相关性。当NCPS受到损伤后, 812HS可以通过提高CPS活性起到一定的弥补作用。
对于水稻来说, 7月份之前的光照强度属于正常或偏低范围, 突变体812HS的PSII活性与野生型812S间并没有明显差别。在7月中下旬至8月初较高的光照强度下, 812HS的PSII活性发生了非常明显的下降, 其中叶绿素a的降低幅度显著大于野生型812S。812HS显著降低的PSII活性会影响后续的NCPS活性, 最终导致Pn明显下降。同时, 这也造成了其体内过剩能量的大量积累。
植物在长期的进化过程中, 体内同时形成两种主要的抗氧化系统, 分别是包括SOD、POD、CAT在内的抗氧化酶系统和小分子抗氧化物质, 它们能够在一定范围内及时清除机体内过多的活性氧, 维持自由基代谢的动态平衡[28]。SOD、CAT和POD能够清除植物体内的活性氧, 从而使光合作用膜免受过氧化的损伤, 对植物起到一定的保护作用[29]。SOD将O2܋歧化成H2O2, 抑制Haber-Weiss反应, 再由CAT和POD将H2O2分解成H2O, 从而阻止O2܋和H2O2的积累[30]。只有三者协调一致, 才能使活性氧自由基维持在较低的水平[31]。本实验的结果显示, 在自然高光强下, 812HS和812S的SOD活性均明显增加, 而且, 812HS比812S增加得显著, 但是, 可能由于光氧化812HS产生的O2܋比812S多得多, 所以, 812HS的SOD活性的增加并不足以抵消光氧化产生的O2܋增量, 从而导致实际测定中O2܋的积累量812HS仍显著高于812S。此外, 在812HS中, 高活性SOD酶也导致更多H2O2的积累, 而CAT和POD的活性增幅明显低于812S, 导致H2O2在植物体内大量积累, 引起细胞膜系统损伤和生理代谢紊乱, 使得812HS在高光照强度下保护叶绿体的能力相对较弱, 因而叶绿体的光氧化损伤程度比812S明显严重。MDA是膜脂过氧化产物, MDA含量的增加是植物膜系统受胁迫的重要标志之一。本研究中发现, 高光强条件下812HS的MDA含量明显增加, 与活性氧的变化趋势一致, 表明活性氧加速了膜脂过氧化链式反应, 自由基增多, 过氧化产物在812HS中积累[32]。
812HS的光氧化特性是由其不稳定的PSII活性和较弱的CAT、POD活性造成。这种特性使得812HS细胞内大量富集ROS, 并对叶绿体机构和光合磷酸化造成损伤, 形成了明显的叶片光氧化失绿表型。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|