第一作者联系方式: E-mail: chuben@scau.edu.cn
从粳稻品种日本晴经60Co-γ诱变的M1材料中发现一个黄绿叶突变体, 其叶片从萌发到三叶前期表现白化, 三叶后期开始转为黄绿叶, 直到衰老。遗传分析表明, 该突变表型受一对隐性核基因控制, 将该黄绿叶突变体暂定名为 ygl8951。与野生型相比, ygl8951的叶绿素含量与类胡萝卜素含量显著降低。电子显微镜观察表明 ygl8951内叶绿体数量明显减少, 叶绿体内没有基粒类囊体, 只有类似间质类囊体结构。基因表达定量分析表明, 突变体中光系统I和光系统II基因表达水平明显下调, 核糖体结构基因和质体编码的RNA聚合酶亚基基因表达明显上调。利用 ygl8951与籼稻品种黄华占杂交获得的F2分离群体, 将该基因定位于水稻第6染色体上的In/Del标记607489与607611之间, 物理距离191 kb的范围内, 通过分析确认该基因为一个新的调控叶色的基因。
A yellow-green leaf rice mutant, temporarily named as ygl8951 (
叶片是植物光合作用的主要器官, 水稻产量的95%来自叶片的光合作用[1]。叶色突变在水稻种植过程中较为常见, 多因为叶绿素合成或降解过程发生变化所导致。过去常常认为叶色突变无任何利用价值, 但随着生物技术的发展, 人们发现探究叶色调控不仅可以深入研究植物光合作用机制、叶绿素生物合成途径、叶绿体的结构功能和遗传发育调控机制, 也可以在作物性状标记、水稻叶色改良等领域[2, 3]有一定的应用价值。
水稻叶色突变类型丰富, 包括白化、黄化、黄绿(淡绿)、条斑、斑马叶等多种表型。迄今为止, 已报道的水稻叶色突变体超过180个, 已成功克隆的叶色相关基因有37个。从叶色突变基因的分布来看, 12条染色体上均有发现, 其中以第3染色体上最多。由于叶绿体是半自主型细胞器, 其生物发生及发育受核基因组和叶绿体基因组共同调控, 因此引起叶色变异的机制较复杂, 其中叶绿素、类胡萝卜素等色素合成过程中酶的突变, 导致叶绿素合成缺陷, 是目前发现最多的一类, 例如OsDVR[4]、YGL1[5]、OsCAO1[6]、OsPDS (水稻八氢番茄红素脱氢酶)、OsZDS (水稻ζ -胡萝卜素脱氢酶)、OsCRTISO (水稻类胡萝卜素异构酶)、β -OsLCY (水稻番茄红素β -羟化酶)[7]均属这一类。叶绿体自身结构发育异常也常常导致叶色的突变, 例如, OsPPR1[8]、转绿型白叶突变体v1[9]、转绿型白叶突变体v2[10]、OsCHR4突变体[11]均属此类型。叶绿素分解代谢障碍也可以导致叶色突变, Sgr突变[12, 13, 14]、NYC1 (non-yellow coloring)[15]变异均表现出叶片滞绿。
本实验室利用60Co-γ 诱变日本晴, M1获得一个水稻黄绿叶突变体, 暂命名为ygl8951。对M2材料遗传分析表明, 该性状由单个隐性基因控制。本研究对该突变体进行生理生化分析和显微观察, 并定位该突变基因, 以期为该基因的克隆及对叶绿体发育过程的功能研究提供参考。
黄绿叶突变体萌发至三叶期前期为白化表型, 三叶期后期开始转为黄绿苗, 突变体生长较野生型缓慢且矮化, 分蘖数减少, 只有2~4个, 整个生命周期延长近60 d。
分别取突变体和野生型材料的分蘖期叶片, 测定其叶绿素含量, 重复3次, 取平均值。测定方法参照文献[16], 并略加修改。
取分蘖期的野生型及突变体叶片, 用4%戊二醛(以pH 7.2的磷酸缓冲溶液配置) 4℃过夜固定, 磷酸缓冲溶液冲洗3次, 1%锇酸固定1 h, 磷酸缓冲溶液冲洗3次, 用30%、50%、70%、80%、95%、100%的乙醇和丙酮逐级脱水5 min, 最后用树脂包埋, 切片后用醋酸铀染色, 透射电镜下观察。
选取6株黄绿叶突变单株, 与籼稻品种黄华占杂交, 获得F1种子。播种F1后, 自交繁殖获得F2种子, 分株系种植F2群体, 作为定位群体。
采用SDS法[17]分别提取24株黄绿植株叶片总DNA, 用于基因初步定位。根据初步定位结果, 采用快速打叶法[18]对定位群体植株进行两侧标记检测, 并利用内部In/Del引物进一步精细定位。
用于基因定位的In/Del分子标记, 一部分为本实验室已有的, 另一部分为根据已公布的水稻品种93-11和日本晴全基因组序列自行开发。这些标记均匀分布于水稻12条染色体上, 共147对。
取分蘖期的叶片提取RNA, 并反转录cDNA, 由于叶绿体Rubisco基因表达受到影响, 因此利用β -Actin (Os03g0718100)作为内参基因, 以64对引物检测野生型与突变体中叶绿体基因组基因的表达量。β -Actin引物序列为, F: 5′ -CACATTCCAGCAGAT GTGGA-3; R: 5′ -ACCACAGGTAGCAATAGGTA-3′ 。根据Bio-Rad公司的《荧光定量PCR应用指南》数据处理, 通过计算2-Δ Δ CT值来确定每个基因在野生型和突变体的相对表达量。
正常的自然条件下, 黄绿叶突变体种子萌发后子叶为白色, 从真叶长出至三叶期叶片完全为白色, 从三叶期后突变体逐渐转为黄绿色(图1)。
黄绿叶突变体的叶绿素a/b几乎不变, 但叶绿素a、叶绿素b和类胡萝卜素含量下降明显, 表明突变体的叶绿素合成受到明显抑制(表1)。
| 表1 野生型和ygl8951突变体中色素含量 Table 1 Photosynthetic pigments contents in wild type (WT) and ygl8951 mutant |
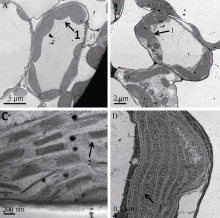
利用透射电镜(TEM)观察发现, 野生型材料细胞中叶绿体含量丰富, 基粒结构清晰, 而突变体叶绿体中没有清晰的基粒类囊体, 仅有类似间质类囊体结构(图2)。
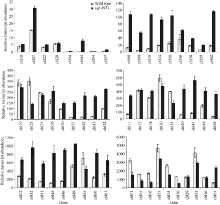
通过定量结果可以看出, 该叶色突变对叶绿体基因的影响是全面的, 并且上调基因明显多过下调基因, 共有30个基因明显上调(上调倍数> 2), 上调基因主要为核糖体结构基因(chl44, chl63, chl42, chl43, chl45)和RNA聚合酶亚基基因(chl10, chl09, chl08); 表达量明显降低的基因多为光系统基因(chl06, chl16, chl01, chl05)以及Rubisco大亚基基因(chl23)(图3)。
突变材料M1中, 野生型植株与黄绿突变植株分别为38株和11株, 符合3∶ 1的分离关系(χ 2c= 0.06 < χ 20.05= 3.84; P > 0.05)。单株收获M1叶色正常的植株种子, 种植M2代, 约有1/3的植株后代全部叶色正常, 不再分离, 其余2/3的植株后代又表现出大致3∶ 1的分离比。选取6株黄绿叶单株与籼稻亲本黄华占杂交, F1种子自交获得F2群体, 分别统计正常植株与黄绿苗数目, 正常植株与黄绿突变植株分别为334株和102株, 分离比例符合3∶ 1 (χ 2c= 0.517 < χ 20.05=3.84; P > 0.05), 因此确定该突变为单基因隐性遗传。
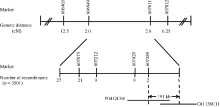
选取在两亲本间有多态性的In/Del标记, 共有147对, 均匀分布于水稻12条染色体上。用24株黄绿苗, 将黄绿基因初步定位在第6染色体的短臂上, 分子标记In/Del 606949与In/Del 607611之间, 物理距离约为662 kb。
为了进一步缩小定位区间, 选取F2群体中1121株黄绿植株和2380株正常表型植株做精细定位群体。根据公布的粳稻日本晴与籼稻93-11序列, 在In/Del标记606949与607611之间, 找到了8对在2个亲本有差异的新标记(表2), 并最终将黄绿叶基因ygl8951定位在In/Del标记607420与607611之间, 物理距离约为191 kb (图4)。
| 表2 用于精细定位的新In/Del标记 Table 2 New In/Del markers for mapping |
突变体ygl8951从种子萌发到三叶前期为白化表型, 三叶后期以后为黄绿叶表型这种类型的突变尚未见报道。ygl8951突变体叶绿素、类胡萝卜素含量明显下降, 这与大部分的黄绿叶突变体研究结果相似[19, 20]。根据孔萌萌等[21]的关于叶绿体发育阶段研究, 叶绿体发育分为3个阶段, 即前质体时期、单片层时期和基粒形成期。ygl8951突变体的电镜结果显示突变体的叶绿体中没有清晰的基粒类囊体, 仅有类似间质类囊体结构, 因此叶绿体发育一直处在单片层形成期, 说明突变基因影响了基粒类囊体的形成。
水稻(Oryza sativa)叶绿体基因组测序工作在1989年已经完成[22], 叶绿体编码蛋白预测超过100个[23]。由于很多预测基因片段太小, 无法设计合适的引物检测, 因此只对64个叶绿体基因组基因表达进行了定量分析, 结果发现, 在突变体中光系统I和光系统II基因表达下调明显。由于光系统I和ATP合酶集中分布在基质类囊体和基粒类囊体边缘, 而光系统II和捕光天线复合体II主要分布于基粒垛叠区域[24], 因此可以认为不仅基粒类囊体没有形成, 间质类囊体也发育不完整。叶绿体基因组转录至少需要2种RNA聚合酶— — 核基因组编码的RNA聚合酶(NEP)和质体基因组编码的RNA聚合酶(PEP)[25]。核糖体结构基因和质体编码的RNA聚合酶亚基上调明显, 目前没发现有这方面的报道, 猜测可能是植物的应激反应。
通过图位克隆将目标基因ygl8951定位在191 kb的范围, 在目前已报道的水稻叶色突变材料中, 有15个突变基因被定位到第6染色体, 其中引起黄绿叶表型的有yl6[26]和ygl2[27], 它们与ygl8951均非等位基因, 在该区间内也没有别的叶色相关基因的报道, 因此为一个新基因。
粳稻品种日本晴经60Co-γ 诱变后, 在M2材料中发现了一个稳定遗传的黄绿叶突变体ygl8951, 从芽萌发至三叶期前期叶片完全为白色, 从三叶期后期逐渐转为黄绿色, 其叶绿素、类胡萝卜素含量下降明显, 叶绿体中没有清晰的基粒类囊体, 仅有类似间质类囊体结构, 说明突变基因影响了基粒类囊体的形成。光系统I和光系统II基因表达下调明显; 核糖体结构基因和质体编码的RNA聚合酶亚基表达上调明显, 这几大类基因之间的调控网络目前未知, 也未见相关报道。ygl8951被定位在第6染色体In/Del标记607489和607611之间191 kb的范围, 推测是一个新基因。但是要想回答上面的问题及了解调控网络, 则需要进一步精细定位和克隆该突变基因。
致谢: 感谢华南农业大学亚热带农业生物资源保护与利用重点实验室的张群宇老师提供叶绿体基因组引物及序列。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|