第一作者联系方式: E-mail: hanpingan327@163.com
高丹草是代表性的利用杂种优势的饲用牧草, 本研究以杂种高丹草及其亲本三叶期叶片为试材, 采用双向电泳、质谱技术及生物信息学分析方法, 进行了蛋白质组学研究。凝胶上检测到的可重复蛋白点400多个, 其中杂种与亲本间达到了显著水平的差异蛋白点34个, 包括显性(单亲沉默3个, 偏高亲表达17个, 偏低亲表达5个)和超显性表达(特异表达1个, 超高亲表达6个, 超低亲表达2个)模式, 因此推测显性和超显性效应共同促进高丹草杂种优势的形成, 且显性效应作用更大。同时, 成功鉴定出其中的27个蛋白点涉及到8个功能类别, 即光合作用、碳水化合物代谢、胁迫响应、ATP合成、蛋白质合成、电子转移、信号转导及未知蛋白。高丹草所占比例最大的光合蛋白多数呈上调表达, 表明杂种叶片光合作用增强进而同化更多的有机物是杂种优势形成的主要原因。网络互作的关键节点蛋白为杂种优势特异蛋白的基因操作提供了靶蛋白。本研究在蛋白质水平为高丹草杂种优势分析提供了理论依据, 也为其他饲草作物的相关研究提供了理论参考。
Sorghum-sudangrass hybrids are typically used for studying heterosis in forage crops. In this study, we carried out proteomic research on sorghum-sudangrass hybrids and their parents at the three-leaf stage by two dimensional electrophoresis-based proteomics and bioinformatic methods. More than 400 protein spots were detected, in which 34 proteins showed significant differences between hybrid and parents in expression, including dominant expression (showing three single-parent silent, seventeen high-parent and five low-parent expression) and overdominant expression (showing one hybrid-specific, six above-high-parent, two below-low-parent expression). Thus, we speculated that dominant and overdominant effects play key roles, and dominant effect is a major factor in the formation of heterosis in sorghum-sudangrass hybrid. Moreover, 27 out of 34 proteins were related to eight functional categories, i.e., photosynthesis, carbohydrate metabolism, stress response, ATP synthesis, protein synthesis, electron transfer, signal transduction and unknown. The up-regulated photosynthetic proteins were the biggest category, which indicates that photosynthesis in the leaves of sorghum-sudangrass hybrid is enhanced resultig in producing more organic matter, so that showing heterosis. The identified key node proteins in the interaction networks were the potential target proteins for future genetic manipulation of the specific proteins of heterosis. Our findings provide a theoretical basis on heterosis analysis of sorghum-sudangrass hybrids, which is potentially useful for other forage plants.
高丹草(Sorghum bicolor × S. sudanense)为高粱(Sorghum bicolor L.)与苏丹草[Sorghum sudanense (Piper) Stapf]杂交产生的一年生禾本科饲用牧草, 综合了亲本的诸多优点, 产草量高, 分蘖和再生性好, 抗非生物胁迫(干旱、盐碱、低温)能力强, 草质柔软, 深受牛羊的喜爱, 在生产中具有广泛的应用前景[1, 2]。高丹草是非常典型的利用杂种优势的饲草作物, 然而关于杂种优势分子机制仍然没有一致性的解释。杂种优势最早期的经典理论主要是显性假说[3, 4]、超显性假说[5, 6]和上位性假说[7, 8], 这些假说虽然都有足够的证据支持, 但仅仅是概念性的理论, 不能在分子水平解释杂种优势。
近年来, 已分别在基因组、转录组以及蛋白质组水平上大量研究不同作物杂种优势的分子机制。众多研究成果表明加性表达、非加性表达以及表观遗传对杂种优势有促进作用。Stupar和Springer[9]对玉米亲本和F1的幼穗和胚研究显示, 杂种与亲本间基因差异表达模式中80%的基因为加性表达模式, 20%为非加性表达, 且数据表明亲本的顺式作用因子的变化导致F1的加性表达。Zhang等[10]认为小RNA是超级稻杂种优势的重要调控因子。另外, 有相关报道表明, DNA甲基化在杂种优势形成上起重要作用[11, 12]。
蛋白质组学的迅速发展为解析杂种优势的分子机理提供了新方法。目前, 基于凝胶的蛋白质组学技术已在很多作物上进行了杂种优势形成机理的研究。Song等[13, 14]先后利用双向电泳结合串联质谱技术对小麦的根、叶蛋白质组学分析发现, 杂种与亲本的蛋白丰度存在显著差异, 且这些差异蛋白涉及碳水化合物代谢、信号转导、能量代谢、胁迫响应等多种功能类别, 可能与杂种优势形成相关。Wang等[15]对杂交稻以及亲本成熟胚的蛋白质组学分析显示, 54个差异表达蛋白分别参与营养储存、胁迫响应、代谢等生物学通路, 并且杂种储藏蛋白为超高亲表达, 胁迫响应蛋白为加性表达, 这些研究成果为分析杂种优势提供了参考。进茜宁等[16]对先玉335及其亲本胚芽的差异蛋白质组学分析表明, 杂种的蛋白点中有81%是非加性表达, 推测非加性蛋白的累积是胚芽杂种优势形成的主要原因。郭宝健等[17, 18]分别以玉米杂交种及其亲本自交系的苗期叶片, 雌穗花器官为试验材料, 利用双向电泳结合串联质谱技术成功建立了玉米幼叶、幼穗的差异蛋白表达谱, 且杂种与亲本的差异蛋白涉及多个功能类别, 推测与杂种优势形成相关。因而, 运用蛋白质组学技术研究杂种优势的分子机制受到了广大科研工作者的青睐。然而, 在蛋白质水平上研究高丹草杂种优势的分子机制还未见报道。本研究利用双向电泳结合质谱鉴定的方法对高丹草及其亲本苗期叶片的杂种模式进行定量分析, 通过鉴定差异蛋白旨在深入地剖析高丹草杂种优势形成的分子机制, 为杂种优势遗传理论研究积累资料。
杂交种高丹草F1(11A× Bai)及其母本(高粱不育系11A)和父本(苏丹草Bai)由内蒙古农业大学遗传育种教研室提供。
1.2.1 高丹草苗期农艺性状的测定 将所有试验材料的种子分为3批, 作为3个生物学重复, 在光照培养箱中于28℃催芽24 h, 然后将其种在育苗砵里放进光照培养箱, 于为28℃光培养16 h, 25℃暗培养8 h, 在三叶期收获叶片, 同时对每个生物学重复的所有基因型随机选取10株, 测量第3片叶的叶长、叶宽、株高、以及10株的鲜重、干重, 并计算各性状的中亲优势。中亲优势( MPH)% = ( F1- 双亲平均)/双亲平均× 100。将所有收集的试验材料立即在液氮里固定后放于-80℃冰箱保存待用。
1.2.2 高丹草叶片总蛋白的提取 参照Ajit等[19]和Han等[20]方法并加以改进提取高丹草叶片总蛋白。将每个试验材料的3个生物学重复的叶片等量混合后称取1 g, 剪碎放入研钵中, 加液氮磨成粉末后加入10 mL裂解缓冲液(LB, 含8 mol L-1 尿素, 2 mol L-1硫尿, 4% CHAPS, 20 mmol L-1 Tris-base, 30 mmol L-1二硫苏糖醇, 2%两性电解质pH 4~7), 混合的匀浆经超声处理后, 在冰上裂解1 h, 在25 000× g, 4℃条件下离心30 min取上清液, 将预冷的3倍体积的丙酮加入上清液, 放4℃冰箱沉淀除盐2 h, 随后离心15 min (25 000× g, 4℃), 所得沉淀在同样条件下用冷丙酮洗涤2次, 弃去上清液, 收集沉淀, 经室温干燥后加LB使其完全溶解, 所得溶液即为蛋白样品。采用考马斯亮蓝法测定蛋白样品浓度后分装, 置-80℃超低温冰箱保存备用。
1.2.3 双向电泳 每个样品的蛋白双向电泳分析均进行3次技术重复, 且上样量均为800 μ g, 采用pH 4~7, 17 cm非线性IPG胶条(Bio-Rad)。20℃条件下, 第一向等电聚焦程序设置为: 50 V主动水化14 h, 250 V线性30 min, 1000 V快速30 min, 9000 V线性5 h, 9000 V快速9000 Vh。等电聚焦结束后, 将IPG胶条在平衡液I (0.375 mol L-1 Tris-HCl (pH 8.8), 6 mol L-1尿素, 20%甘油, 2%SDS, 2%DTT)、平衡液II [0.375 mol L-1 Tris-HCl (pH 8.8), 6 mol L-1尿素, 20%甘油, 2%SDS, 2.5%碘乙酰胺]中先后平衡15 min, 然后配制12%的SDS-PAGE凝胶对平衡后的IPG胶条进行第二向分离。待电泳结束后, 将凝胶于G-250考马斯亮蓝染液中染色12 h。
1.2.4 凝胶图像处理 用UMAX Powerlook (2100XL-USB)扫描仪扫描采集图像, 分辨率为300 dpi。利用Progenesis SameSpots (Nonlinear Dynamics, British)软件处理分析图像。
1.2.5 差异蛋白的表达模式 用SameSpots软件分析杂种高丹草与亲本间蛋白丰度的表达差异。每个品种3个重复, 蛋白点丰度变化在1.5倍以上被认为是差异蛋白点, 以t测验(P< 0.05)鉴定杂种与亲本间的差异表达模式。根据郭宝健等[17]和Hoecker等[21]的研究将差异表达模式分为质和量的模式。质的差异表达模式为杂种特异表达和单亲沉默。量的差异表达模式即4种为超高亲表达( 在杂种和双亲都表达, 且杂种表达量高于高表达的亲本); 超低亲表达(在杂种和双亲都表达, 且杂种表达量低于低表达的亲本); 偏高亲表达(在杂种和双亲中都表达, 且杂种表达量与低亲表达量差异显著, 与高亲表达量差异不显著); 偏低亲表达(在杂种和双亲中都表达, 且杂种表达量与高亲表达量差异显著, 与低亲表达量差异不显著)。
1.2.6 胶内酶解 用枪头尖端挖取差异蛋白凝胶置离心管, 用超纯水清洗2次干燥的胶粒, 加入100 mmol L-1碘乙酰胺125 μ L完成烷基化反应, 避光室温反应1 h。加入Trypsin酶以1∶ 50酶/蛋白的比例37℃消化14 h。之后加入1 μ L甲酸终止酶切反应, 真空干燥浓缩肽段, 每个样品加入0.1%的甲酸60 μ L重新溶解, 用于质谱分析。
1.2.7 差异蛋白的质谱鉴定 使用Agilent Technologies 6520 Q-TOF LC/MS进行肽质量指纹图谱鉴定, 得到的数据导入Peaks 7.0 (Bioinformatics Solutions Inc., Waterloo, Canada)软件中进行搜库分析, 所用数据库2014年11月下载于NCBI中, 物种为玉米(Zea mays), 非冗余序列共66 024条, 搜库参数设置如下, 未水解的酶切位点数(max missed cleavages)最多允许1个不完全裂解位点; 固定修饰(fixed modifications)为脲甲基化[carboxymethyl (C)]; 可变修饰(variable modifications)为氧化[oxidation (M)]; 肽片段质量数最大容许误差范围(peptide mass tolerance)为± 50 mg L-1; 二级质谱最大误差范围(MS/MS tolerance)为± 0.05 Da, 若鉴定肽段覆盖率大于10%, 则认为搜库结果可信。
1.2.8 生物信息学分析 通过搜索Uniprot (http:// www.uniprot.org/)数据库, 拟南芥数据库获得的结果, 按其参与的生物学进程对鉴定的差异蛋白分类。利用Cluster 3.0软件对已鉴定蛋白质进行表达量的聚类分析。使用GeneMania (http://genemania.org/)对已鉴定的差异蛋白进行网络互作预测分析。
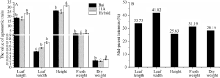
产量是杂种优势的主要指标, 而叶长、叶宽、株高、鲜重、干重又是构成产量的主要因素, 因此, 在三叶期(图1)测量杂种高丹草及其亲本的各项农艺性状, 对各指标进行单因素方差分析, 并计算中亲优势。结果(图2)表明杂种高丹草与亲本间的差异均达到了显著水平(P< 0.05), 且叶长、叶宽、株高、鲜重、干重的中亲优势分别为33.73%、41.82%、25.63%、31.19%和28.15%, 说明高丹草叶片具有明显的杂种优势。
双向电泳图谱中每张凝胶可以检测到的蛋白点至少为400个。其中有34个蛋白点(图3)在杂种与亲本间差异达到了显著水平(P< 0.05)。进一步分析发现, 杂种高丹草与亲本间的差异蛋白表达模式中质的差异为4个, 量的差异为30个。且特异表达为1个, 单亲沉默为3个, 偏高亲所占比例最高17个, 超高亲6个, 偏低亲5个, 超低亲2个(图4)。
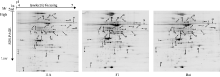 | 图3 高丹草与亲本叶片差异蛋白表达谱Fig. 3 Differential protein expression profile of leaves of sorghum-sudangrass hybrid and its parents |
挖取凝胶上定量分析后的所有差异蛋白点并进行质谱鉴定, 27个差异蛋白点被成功鉴定(表1)。为进一步确定差异蛋白的功能, 按照生物学进程进行功能分类(图5和表1), 27个差异蛋白共涉及8个功能类别, 表达类别最多的蛋白为光合作用相关的蛋白(8个), 其次是碳水化合物代谢相关蛋白(5个), 胁迫响应相关蛋白为3个, ATP合成蛋白3个, 蛋白质合成2个, 电子转移2个, 信号转导1个, 另外还有未知蛋白3个。
| 表1 已鉴定的27个蛋白的相关信息 Table 1 Relevant information of twenty-seven proteins identified |
高丹草及其亲本中的差异蛋白质表达量的聚类分析(图6)表明, 差异蛋白主要为两大类, 一类是在高丹草相对于亲本表达量上调的蛋白质, 主要涉及光合作用, 碳水化合物代谢, 胁迫响应, ATP合成。另一类是高丹草中相对于亲本表达量下调的蛋白质, 主要是电子转移类蛋白。
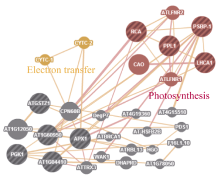
在一个活细胞里, 蛋白质执行其功能时并不是孤立的, 而是在一个网络环境下协同作用的。因此, 我们通过GeneMANIA对鉴定的差异蛋白生成互作网络图, 以期在高丹草叶片杂种优势中找到关键的节点蛋白。结果显示, 被识别的蛋白基于蛋白质间的互作形成了2个功能群(图7), 分别涉及光合作用、电子转移。表达最多的功能群是与光合作用相关的蛋白, 涉及7个蛋白, 电子转移涉及2个蛋白。
杂种优势广泛应用在增加作物产量, 提高作物品质等诸多方面, 高丹草表现突出的杂种优势, 如产草量高, 饲用品质好, 在畜牧业中广泛应用。为更好地理解高丹草杂种优势形成的分子机制, 我们建立了高丹草叶片三叶期的差异蛋白表达谱, 共检测到差异蛋白34个, 包括单亲沉默、偏高亲、偏低亲、特异表达、超高亲、超低亲等差异表达模式。其中差异蛋白表现为单亲沉默, 偏高亲, 偏低亲可认为是显性效应(25个), 表现为特异表达, 超高亲, 超低亲被认为是超显性效应(9个), 由此, 我们推测显性效应与超显性效应共同作用, 促进高丹草叶片杂种优势的形成[17]。功能分类和互作网络分析表明增强的光合作用是杂种优势形成的主要因子。
光合作用为植物的生长和发育提供能量和有机物, 是作物产量形成的基础[22]。在本研究中, 8个差异显著的蛋白与光合作用相关, 1, 5-二磷酸核酮糖羧化酶/加氧酶大亚基(Rubisco)是非常重要的酶, 在叶绿体中合成, 结合小亚基形成全酶。Rubisco是光合作用中催化光合碳循环和光呼吸的第一个酶, 且Rubisco含量丰富也是光合作用的限速酶。Rubisco在高丹草叶片的特异性表达说明杂种在光合作用中碳的固定与光呼吸的氧化能力上具有超强的优势, 可能通过高效的光合作用同化更多的有机物来增加高丹草的产量。捕光叶绿素a/b结合蛋白与色素形成色素蛋白复合体, 该复合体能捕获光能并把能量迅速传到反应中心促进光化学反应[23]。其在光系统I和光系统II之间激发能量的分配和光保护等过程中具有非常重要的调节作用[24]。捕光叶绿素a/b结合蛋白5和叶绿素a/b结合蛋白6A均是偏高亲表达, 推测杂种相对于亲本具有更高的光捕获转化能力, 更好的能量分配与光保护能力。氧不断变化的增强蛋白2 (点1)对维持光系统II的稳定性以及确保植物正常光合作用起着关键性作用。本研究的结果显示, 蛋白点1的超高亲表达说明高丹草可能有更高效的光合作用。PsbP蛋白是光系统II的外在组分, 它连同PsbO和PsbQ两个亚基构成放氧复合物的腔内组分[25], 本研究中PsbP蛋白的同源蛋白PsbP-like protein 2 (点8)为偏高亲表达, 另外还有2个光合蛋白(点5和点6)也是偏高亲表达模式。这些蛋白都明显地证明高丹草比其亲本具更强的光合作用, 这在很大程度上解释了其高产的原因。
碳水化合物是大多数有机体内最丰富的有机产物, 同时也是化学能的主要来源[26]。本研究中的碳水化合物代谢相关蛋白主要涉及糖酵解和三羧酸循环途径。三磷酸甘油醛脱氢酶、磷酸甘油酸激酶、磷酸丙糖异构酶是糖酵解途径的关键酶, 这3种酶表现出了明显的上调表达, 说明杂种高丹草增强的糖酵解途径可以产生更多的能量以满足其生长发育的高能量需求。三羧酸循环是主要的能量代谢通路, 负责呼吸底物的氧化以合成ATP[27]。苹果酸脱氢酶(MDH)是生物糖代谢的关键酶之一, 催化苹果酸与草酰乙酸之间的可逆转换, 在本研究中检测到MDH (点19)偏高亲表达。天冬氨酸转氨酶(点17)催化天冬氨酸产生草酰乙酸, 从而会影响高丹草的能量代谢系统, 蛋白点17的超高亲表达会催化产生更多的草酰乙酸, 为三羧酸循环高效进行提供更多的中间介质, 这将有助于促进高丹草杂种优势的形成。
环境胁迫是全球作物生产的主要限制条件, 每年导致主要农作物的平均产量损失达50%以上[28], 所以胁迫响应蛋白在农业生产中扮演着重要的角色。谷胱甘肽-S-转移酶(GST)是典型的胁迫响应蛋白, 大量研究表明, GST在植物体内的表达能够有效增强植物对干旱、低温、高盐、重金属等多种非生物胁迫的抵抗能力[29, 30, 31, 32]。在本研究中GST 1偏高亲表达, 可以推测杂种对环境胁迫的抵抗能力高于亲本, 为机体正常代谢活动提供了更稳定的系统。L-抗坏血酸过氧化氢酶(点26)和乙二醛酶1 (点15)是另外2个参与胁迫响应的蛋白, 抗坏血酸过氧化氢酶主要是参与清除植物体内的过氧化氢, 对维持生物体正常的生理功能尤为重要[33]。蛋白点26为单亲沉默表达, 可以将其归为显性表达, 点26在高丹草中的显性表达大大减少了活性氧的积累对植物体造成的伤害。乙二醛酶有效去除体内α -羰基醛毒性, 对生物体有极大的保护作用, 而蛋白点15的表达是偏低亲表达模式, 还需对其进行更深入的研究。
ATP合酶是生物体内能量代谢的关键酶, 并参与氧化磷酸化与光合磷酸化反应, ATP是机体生命活动的主要能量来源, ATP合酶利用质子转运形成的跨膜质子动力势催化光合磷酸化的末端反应, 将ADP和无机磷Pi合成ATP [34, 35]。在本研究中检测到3个ATP合酶, 叶绿体ATP合酶CF1亚基有α 和β 两种形式, 均为偏高亲表达模式, ATP合酶gamma亚基为超高亲表达模式。ATP合酶在杂种高丹草叶片的高亲或者超高亲的表达模式, 也许可以表明随着质子流入叶绿体, 杂种有更高的光合速率, 创造更多的ATP产物, 因此能更好地满足叶片生长发育对能量的需求[36]。
除上述功能类蛋白外还有一些重要的差异表达蛋白分别涉及蛋白质合成、电子转移和信号转导。核糖体蛋白在细胞内参与蛋白质生物合成中发挥着重要作用, 研究表明核糖体蛋白与细胞的分化和发育有关[37], 30S核糖体蛋白在高丹草的偏高亲表达说明其增强的蛋白质合成促进杂种优势的形成。与电子转移相关的蛋白点24、25均参与铁硫蛋白代谢的电子转移, 且在子代为偏低亲表达模式。蛋白点23是唯一一个与信号转导相关的差异蛋白, 它的偏高亲表达模式可能说明杂种子代的信号传导比较灵敏, 更容易完成生命活动中信号网络的传递。
成功建立了高丹草及其亲本的差异蛋白表达谱, 检测到差异蛋白34个, 包括显性(单亲沉默、偏高亲、偏低亲)和超显性(特异表达、超高亲、超低亲)表达模式。显性和超显性效应共同形成杂种优势, 而显性效应的贡献更大。在成功鉴定的27个差异蛋白中, 共涉及8个功能类别, 其中光合蛋白最多。其中叶绿体氧不断变化的增强蛋白2为超高亲表达, 1, 5-二磷酸核酮糖羧化酶/加氧酶大亚基呈杂种特异表达, 其他光合蛋白也多数为偏高亲表达模式。杂种光合作用的增强表明其子代同化有机物能力增强, 能有效维持植物的生长发育, 这可能是产生杂种优势的最主要原因。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|