第一作者联系方式: 张同祯, E-mail: 294301204@qq.com **同等贡献(Contributed equally to this work)
以长中胚轴玉米自交系PH4CV为材料, 在黑暗和光照两种处理条件下研究了玉米中胚轴长度与多胺氧化酶(polyamine oxidase, PAO)活性、H2O2含量、过氧化物酶(peroxidase, POD)活性及木质素含量的关系。通过添加5 mmol L-1 PAO抑制剂2-羟乙基肼(2-hydroxyethylhydrazine, 2-HEH)和5 mmol L-1 H2O2清除剂N,N’-二甲基硫脲(N,N’-Dimethylthiourea, DMTU)及组织化学染色, 研究了影响中胚轴伸长的H2O2来源及其积累部位。采用实时荧光定量PCR(qRT-PCR)方法, 探究了光对 ZmPAO基因表达的影响。结果表明, 光照处理显著抑制了玉米中胚轴的伸长, 同时显著增加该部位的PAO活性、H2O2含量、POD活性及木质素含量。相关性分析表明, 玉米中胚轴长度与PAO活性、H2O2含量和木质素含量呈极显著负相关, 与POD活性呈显著负相关; PAO活性与H2O2含量、POD活性和木质素含量均呈正相关。外源PAO抑制剂和H2O2清除剂处理试验, 玉米中胚轴表皮纵切面细胞长度显微观察及中胚轴H2O2组织化学染色表明, PAO氧化分解多胺(polyamines, PAs)产生的H2O2参与了中胚轴细胞伸长的生理调控, 从而抑制了中胚轴的伸长。表达分析表明, ZmPAO基因在黑暗环境下的表达量相对稳定, 光刺激0.5 h后表达量迅速升高, 3 h后达到最大值, 随后逐渐下降, 10 h后趋于稳定。本研究表明, PAO在接受光刺激后活性升高, 氧化分解PAs产生H2O2, 从而诱导POD氧化胞壁的单木质醇并聚合为木质素, 使细胞壁硬化, 造成细胞伸长受阻。研究结果为进一步探讨PAO活性调控光诱导玉米中胚轴伸长的生理机制和阐明玉米中胚轴对光逆境的响应机理提供了理论依据。
In this study, maize inbred line PH4CV was cultured under in MS medium under both dark and light conditions to investigate the relationship of length of mesocotyl with activity of polyamine oxidase (PAO), activity of peroxidase (POD), contents of H2O2 and lignin. In addition, after treated with 5 mmol L-1 2-hydroxyethylhydrazine (2-HEH) and 5 mmol L-1 N, N’-Dimethylthiourea (DMTU), the origin and accumulation site of H2O2 in mesocotyl elongation were assessed by using histochemical staining method and the effect of light on expression of ZmPAO gene was evaluated. The results indicated that the elongation of mesocotyl was significantly inhibited while the contents of H2O2 and lignin and the activities of POD and PAO were enhanced by light. Correlation analysis showed that the length of mesocotyl was negatively correlated with the PAO activity, H2O2 content, POD activity, and lignin content, and the PAO activity was positively correlated with the H2O2 content, the POD activity, and the lignin content. The assay with 2-HEH and DMTU, the microgram of epidermal cells, and histochemical localization of H2O2 revealed that H2O2 participated in mesocotyl elongation, in which PAO catalyzed polyamines (PAs) degradation to produce H2O2 resulting in the inhibition of mesocotyl elongation. Results of qRT-PCR revealed that the expression level of ZmPAO was relatively stable in dark and rose rapidly of 0.5 hour after exposing to light, with a maximum value after three hours of light treatment, then declined gradually, and finally showed a steady level after ten hours. This study suggests that the activity of PAO can be promoted by light treatment, and initiate the PAs-mediated induction of H2O2, resulting in the oxidation of lignin monomers on cell wall by POD. The produced free radicals are then transformed into lignin in a polyforming process which marked the cell wall hardened and cell elongation inhibited. This study may provide a theoretical basis for understanding the physiological mechanism underlying the PAO-mediated mesocotyl elongation and gain insights into the response of maize mesocotyl to the light stress.
玉米(Zea mays L.)种子出苗率与土壤水分、温度及播种深度密切相关。Dungan[1]和Hoshikawa[2]认为玉米主要通过延伸中胚轴长度达到深播出苗的目的, 张磊等[3]认为中胚轴和胚芽鞘协同决定幼苗的出土深度, 其中中胚轴起主导作用, 赵光武等[4]报道了深播出苗率与中胚轴长度具有显著的相关性且不同品种的耐深播能力差异明显, 杜金友等[5]研究表明, 玉米中胚轴的伸长受到光照与激素等的影响。
Stuart等[6]和Cosgrove[7]研究表明, 中胚轴伸长的实质是中胚轴细胞的延伸生长和分裂, 其中细胞延伸生长起着决定作用。李莉等[8]也认为细胞长度增加对中胚轴的伸长贡献更大, 细胞数目对中胚轴伸长的促进作用仅发生在伸长生长的初期, 而细胞伸长对中胚轴的促进作用贯穿于中胚轴伸长生长的整个时期。有学者认为细胞伸长受膨压的驱动, 但木质素作为细胞次生壁的重要组成部分, 决定了细胞壁弹性的大小, 木质素含量升高会造成细胞壁松弛度下降, 抑制细胞的伸长生长[9], 有研究认为这一过程可以被某些酶或化学因素所介导[10]。在细胞壁木质化过程中, H2O2的积累诱使过氧化物酶(POD)氧化细胞壁的单木质醇为自由基并聚合为木质素, 导致细胞壁硬化从而阻碍了细胞的伸长生长[11]。在此过程中, H2O2可能的来源主要包括还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶[12]、POD[13]及多胺氧化酶(PAO)[14]三种途径。
Yoda等[14]研究发现, 质外体H2O2主要是通过PAO氧化降解多胺(polyamines, PAs)途径产生的。PAO主要分布在禾谷类单子叶植物中[15, 16], 玉米中的PAO最早是在细胞质外体被发现, 现已被通过生物化学、细胞免疫等方法定位于玉米的木质部、木薄壁细胞、内皮层、表皮层的初生和次生壁[17]。同时, PAO的核苷酸序列与氨基酸序列已被测定分析, 发现其cDNA全长1737 bp, 具有一个开放阅读框, 编码500个氨基酸残基[18, 19]。Cervelli等[20]从玉米中分离到3种编码PAO的基因, 发现它们极其保守, 有几乎相同的核苷酸序列, 由8个外显子和7个内含子组成, 且具有高度的组织特异性。Federico等[21]研究发现豌豆在萌发后其茎基部木质化程度与PAO氧化降解PAs产生H2O2有关, Laurenzi等[22]发现玉米中胚轴切段中H2O2的产生可被PAO抑制剂2-羟乙基肼(2-hydroxyethylhydrazine, 2-HEH)强烈抑制。Cona等[23]认为光调控了玉米中胚轴表皮PAO活性, 玉米中胚轴受到光刺激后, 其表皮的PAO活性及其mRNA水平均有所升高, 并且PAO活性的增加与光诱导的时间有紧密的联系。
玉米中胚轴伸长直接影响生产中种子出苗率及幼苗对干旱缺水环境的耐受能力, 国内外关于玉米中胚轴的研究大多都集中于光对中胚轴伸长的影响, 对光调控中胚轴伸长的作用机理研究较少。本研究以前期筛选的长中胚轴玉米自交系PH4CV为研究材料, 在黑暗和光照两种条件下研究了玉米中胚轴长度与PAO活性、H2O2含量、POD活性、木质素含量之间的关系, 并通过实时定量荧光PCR (qRT- PCR)方法探究了玉米ZmPAO基因的时空表达模式, 以期为进一步探讨PAO调控光诱导玉米中胚轴伸长的生理机制及为阐明玉米中胚轴对光逆境的响应机制提供理论依据。
前期已筛选的长中胚轴玉米自交系PH4CV, 由甘肃农业大学农学院玉米遗传育种课题组提供。总RNA提取试剂盒RNA simple Total RNA Kit购自天根生化科技北京有限公司; 第一链cDNA合成试剂盒Prime Script RT reagent Kit with gDNA Eraser及实时荧光定量PCR试剂盒SYBR Premix Ex Taq II (Tli RNaseH Plus)购自宝生物工程(大连)有限公司; 其他药品均为国产分析纯。
挑选整齐饱满的干净种子, 以75%酒精溶液和0.1%氯化汞水溶液消毒后用无菌水冲洗3次, 室温浸种6 h后于25℃条件下培养24 h。将萌动一致的种子转接到MS培养基上, 置25℃人工智能培养箱(浙江托普仪器有限公司)中进行光暗处理(表1)。第1组为对照组, 第2组为5 mmol L-1 2-羟乙基肼(2-HEH)处理组, 第3组为5 mmol L-1 N, N’ -二甲基硫脲(DMTU)处理组; 设3次生物学重复。在处理0、0.5、1、3、6、10、24、48及72 h后进行各试验组形态及生理指标测定, 同时提取样品总RNA用于半定量及实时荧光定量PCR分析。
| 表1 材料培养方法 Table 1 Material culture methods |
用毫米尺测量中胚轴长度, Sartorius BSA-224S电子分析天平测量中胚轴的干鲜重, 以测定平均值(n≥ 20)表示量值大小。参照汪天等[24]的方法测定多胺氧化酶活性; 参照Brennan等[25]的方法测定H2O2含量; 参照Orozco-Cardenas等[26]的方法进行H2O2组织化学定位; 采用愈创木酚法[27]测定POD活性; 参照Syros等[28]的方法测定木质素含量; 参照Tanaka等[29]的方法以显微观察玉米中胚轴纵切面细胞长度。
按照RNA simple Total RNA Kit说明书进行实时荧光定量分析, 提取玉米中胚轴总RNA, 用1%琼脂糖凝胶电泳检测总RNA完整性, 紫外分光光度计检测总RNA的浓度和质量。根据GenBank中ZmPAO基因(NM_001111636)和β tubulin-2基因(NM_ 001111956)序列, 分别设计特异性引物, ZmPAO基因上游引物(ZmPAO-F)为5′ -AGTGTGGCAGGAGTTC GAGAA-3′ , 下游引物(ZmPAO-R)为5′ -ATGATCTCC GCCTTGGTCTG-3′ ; β tubulin-2基因上游引物(β tubulin-2-F)为5′ -TTCATGTGGTAGGTTCGTGCC-3′ , 下游引物(β tubulin-2-R)为5′ -TGGCCGAAGACGAA GTTGTC-3′ 。按反转录试剂盒说明书合成cDNA第一链, 以cDNA为模板, 按SYBR Premix Ex Taq II (Tli RNaseH Plus)说明书进行qRT-PCR。反应体系含SYBR Premix Ex Taq II (Tli RNaseH Plus)(2× )10 μ L、PCR Forward Primer 0.8 μ L、PCR Reverse Primer 0.8 μ L、ROX Reference Dye (50× ) 0.4 μ L、cDNA模板2 μ L、ddH2O 6 μ L。反应程序为, 95℃预变性31 s; 95℃变性5 s, 60℃退火34 s, 72℃延伸1 min, 40个循环。根据扩增曲线确定每个基因的响应Ct值, 以β tubulin-2为内参矫正PCR模板的拷贝数, 采用2-Δ Δ CT方法计算基因相对表达量, 同时进行半定量RT-PCR, 设3次生物学重复。
采用Microsoft Excel 2013和SPSS 19.0统计分析软件进行数据整理和最小显著差异性检验(Duncan’ s新复极差法), 利用Origin 8.5软件绘制图形。
2.1.1 光对玉米中胚轴长度及生物量积累的影响
光不仅是高等植物进行光合作用的能量来源, 也是调控植物生长发育重要的信号物质。由图1可以看出, 光照处理显著抑制了玉米中胚轴的伸长, 在处理24、48和72 h后, 中胚轴长度分别比对照减小了19.2%、60.6%和66.5%, 且在48 h后与对照的差异达到极显著水平(P< 0.01); 同时, 光照也抑制了玉米中胚轴生物量的积累, 处理72 h后中胚轴鲜重(FW)和干重(DW)分别比对照减少了60.8%和45.5%, 差异均达到极显著水平(P< 0.01), 说明光照处理抑制了玉米中胚轴的伸长及生物量的积累。
2.1.2 光对玉米中胚轴PAO活性的影响 光照处理显著提高了玉米中胚轴中PAO的活性, 在处理24、48和72 h后PAO活性分别升高了27.7%、38.9%和16.9%, 而中胚轴长度累计缩短了66.5% (图2); 进一步发现施加5 mmol L-1 2-HEH对黑暗与光照环境下PAO活性均强烈抑制, 使光下中胚轴长度累计增加了155.9%, 但仍略小于黑暗环境中胚轴长度。由此表明, 光照抑制玉米中胚轴伸长可能与PAO活性的升高有关。L-HT处理72 h后, PAO活性相比同样处理24 h及48 h略有升高, 认为当施加的2-HEH被消耗后, 光可以继续激发PAO活性从而抑制中胚轴伸长。
2.1.3 光对玉米中胚轴H2O2含量的影响 PAO在O2和H2O存在的情况下主要将PAs氧化降解为吡咯啉、1-(3-氨丙基)2-吡咯啉和二氨丙烷, 同时产生H2O2[30]。为探究H2O2是否与玉米中胚轴伸长有关, 对不同处理下中胚轴H2O2含量和长度进行了测定分析(图3), 发现光照处理后, 中胚轴H2O2含量分别升高了19.5%、39.2%和53.9%, 中胚轴伸长被不同程度的抑制, 累计缩短了66.5%; 施加5 mmol L-1 DMTU时, 黑暗和光照环境下中胚轴H2O2含量均有所下降, 与对照差异极显著(P < 0.01); L-DH处理72 h后, 中胚轴长度相比L-CK增长了2.4倍。说明H2O2含量的变化可能影响了中胚轴伸长的生理过程。
生物体内H2O2来源并不是唯一的, 质膜H2O2主要来源于还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶[12], 细胞壁H2O2主要来源于POD[13], 而质外体H2O2主要来源于PAO[14]。分析施加5 mmol L-1 2-HEH和5 mmol L-1 DMTU后, 中胚轴H2O2水平及PAO活性的变化(图4), 可以发现, PAO活性被抑制后, H2O2含量极显著下降(P < 0.01), 清除中胚轴H2O2时, PAO活性差异并不显著(P > 0.01)。说明是质外体H2O2影响了玉米中胚轴伸长, 其来源于PAO氧化分解PAs。
2.1.4 光对玉米中胚轴POD活性和木质素含量的影响 有研究表明, 质外体H2O2会促进POD氧化细胞壁单木质醇为自由基, 从而使其聚合成木质素[31]。对黑暗与光照处理下, 中胚轴POD活性及木质素含量测定(图5)发现, 光照处理下玉米中胚轴中的POD活性和木质素含量极显著升高(P < 0.01); 光照处理72 h后, POD活性和木质素含量分别累计增加了31.4%和32.9%, 说明POD活性和木质素含量在PAO参与光抑制中胚轴伸长的生理生化过程中发挥了作用。
2.1.5 中胚轴长度与PAO活性、POD活性、H2O2含量及木质素含量之间的相关性分析 由表2可以看出, 中胚轴长度与PAO活性、H2O2含量和木质素含量均呈极显著负相关(P < 0.01), 与POD活性呈显著负相关(P < 0.05); PAO活性与H2O2含量及木质素含量也存在极显著正相关(P < 0.01), 与POD活性显著正相关性(P < 0.05); POD活性与H2O2含量、木质素含量达到显著正相关(P < 0.05)。由此表明, PAO、H2O2、POD和木质素在玉米中胚轴伸长的生理过程中存在着某种联系。
| 表2 中胚轴长度、PAO活性、H2O2含量、POD活性和木质素含量之间的相关系数 Table 2 Correlation coefficients among mesocotyl length, PAO activity, H2O2 content, POD activity, and lignin content |
2.1.6 玉米中胚轴表皮细胞伸长和H2O2组织化学定位 玉米中胚轴伸长被抑制, 是否是其细胞伸长生长受到阻碍所致, 对不同处理下玉米中胚轴纵切面显微观察(图6-A-D), 发现细胞长度存在明显的差异。黑暗处理(图6-A)的细胞长度最大, 接近100 μ m; 光照处理(图6-B)的细胞长度最小, 几乎所有细胞长度均小于50 μ m; 光照情况下施加5 mmol L-1 2-HEH和5 mmol L-1 DMTU后(图6-C, D), 细胞长度均大于50 μ m但小于100 μ m。通过H2O2组织化学染色(图6-E-H)发现, 中胚轴表皮H2O2的积累量为D-CK < L-DT < L-HT < L-CK。证明H2O2的积累促进了木质素的合成, 使细胞壁硬化, 阻碍了细胞的伸长生长。
为证明PAO活性是受光照促进的, 进行了ZmPAO基因的表达模式分析, 将提取的玉米中胚轴总RNA经电泳检测后反转录为cDNA, 以设计的特异性引物ZmPAO F/R和β tubulin-2 F/R进行qRT-PCR及半定量RT-PCR (图7)。可以看出, 光照处理下ZmPAO基因的表达量显著高于黑暗处理(P < 0.05)。光刺激0.5 h后, 表达量上升了2.1倍, 3 h后达到最大, 是黑暗处理的2.5倍, 之后逐渐下降, 10 h后逐渐趋于稳定。结果表明ZmPAO基因的表达是受光信号调控的, 光刺激后, 其表达量会迅速升高, 达到峰值后会随即缓慢下降并趋于稳定状态。
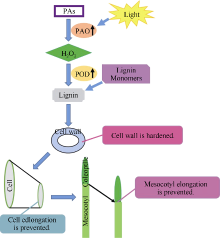
根据以上试验结果, 我们推测PAO活性调控光诱导玉米中胚轴伸长的生理机制可能为, PAO在接受光刺激后活性升高, 氧化分解PAs产生H2O2, 从而促进POD氧化单木质醇为自由基进而聚合为木质素, 使细胞壁硬化, 细胞伸长受阻, 最终导致中胚轴伸长生长被抑制(图8)。
光是植物生长发育过程中重要的信号分子与能量物质, 在植物形态结构、生理生化反应和生长发育等方面起重要作用[32], 不适时的光刺激会造成植物生长逆境, 改变植物光合作用、同化物质运输和形态建成等生理生化过程, 影响植物正常的生长发育[33]。本研究发现, 对萌发后的玉米种子进行光照处理, 中胚轴长度、鲜重和干重的积累均被显著抑制, 中胚轴PAO活性、H2O2含量、POD活性和木质素含量有不同程度的升高, 这与苏国兴[34]研究大豆下胚轴伸长的结果基本一致。PAO活性被抑制后, H2O2含量随之降低, 从而解除了光对中胚轴伸长的抑制作用; 而清除H2O2处理后, PAO活性并无明显变化, 但显著缓解了光对中胚轴伸长的抑制作用, 由此表明, PAO通过氧化分解PAs产生H2O2调控了中胚轴的伸长。2-HEH和DMTU处理后, H2O2不能被完全清除, 说明还有其他代谢途径产生了H2O2, 这与Hohl等[35]的研究结果相一致。
玉米中胚轴纵切面细胞显微观察和H2O2组织化学染色表明, H2O2调控的细胞壁硬化、细胞伸长受阻在这一调控机制中发挥了作用, 这与Zhao等[36]报道的中胚轴伸长与细胞伸长生长有关是一致的, 但他认为, 细胞伸长生长的调控主要是由中胚轴内源赤霉素(gibberellin, GA3)含量变化引起的, 这与本研究结果中细胞伸长受阻可能是由于细胞木质化程度升高所引起的不完全一致。ZmPAO基因qRT-PCR分析表明, 玉米中胚轴表皮细胞ZmPAO基因的表达受光信号调控, 光刺激后, 其表达量出现迅速升高而后平缓下降到趋于稳定的状态, 且光处理下其活性均高于黑暗处理, 这与Laurenzi等[22]的研究结果和ZmPAO基因表达是由依赖光敏素的转录激发子在光响应元件上的作用所介导的[23]研究结果相类似。
玉米幼苗出土后, 芽鞘首先感知到光信号, 调控中胚轴的伸长, 可能存在从芽鞘到中胚轴的某种信号转导或物质转运过程。杜金友等[5]认为光和内源激素影响了玉米中胚轴的伸长, Cona等[23]研究表明, 玉米中胚轴中PAO活性在受光调控的同时, 还受到吲哚乙酸(indoleacetic acid, IAA)和萘乙酸(naphthylacetic acid, NAA)的调控, 其基因表达受光和激素共同调控。本研究表明玉米中胚轴伸长与光诱导的PAO活性有关, 当芽鞘接受到光刺激后, 芽鞘合成的IAA向下垂直运输, 提高了中胚轴中PAO的活性, 氧化分解PAs产生的H2O2在薄壁质外体上驱动了POD催化的薄壁单木质醇多聚体酚类残基的氧化交联和木质化的形成[31, 37], 从而完成细胞壁的硬化, 抑制了细胞的伸长[35, 38]。有研究发现, PAO蛋白通过非共价的方式结合了黄素腺嘌呤二核苷酸(flavin adenine dinucleotide, FAD)[19, 39], 这表明PAO有可能是直接接受光刺激而非通过其他物质运输或信号转导的方式完成了其活性升高的生理生化过程。玉米中胚轴伸长的生理机制是光暗影响的多个生理生化过程共同影响的形态建成过程, 是否还存在其他调控PAO活性参与中胚轴伸长的生理机制, 有待进一步研究。
明确了光诱导的PAO活性升高是导致玉米中胚轴伸长受到抑制的主要原因, ZmPAO基因的表达受光的诱导。PAO调控光诱导玉米中胚轴伸长可能的生理机制为光促进PAO活性增强, 氧化分解PAs造成H2O2积累, 从而诱使POD氧化细胞壁单木质醇为自由基, 进一步聚合为木质素使细胞壁硬化, 细胞伸长受到抑制。研究结果为进一步探讨该生理机制和阐明玉米中胚轴对光逆境的响应机理提供了理论依据。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|