第一作者联系方式: E-mail: muc320@163.com
以国欣棉3号为材料, 以棉花 GhCLA1为指示基因, 探讨了生长温度、重悬液浓度、注射时间、品种等对水培棉花pTRV介导的VIGS沉默效率的影响。在24℃条件下, 出苗后3~5 d内注射能得到较高沉默效率, 重悬液浓度对沉默效率没有影响; 同时以注射pTRV-GFP作为空白对照可以消除插入片段对植株生长的影响, 减小对照误差; 水培与土培方式相比能更快更早出现沉默表型, 缩短试验周期, 并能诱导不同品种棉花材料 GhCLA1基因沉默; 利用水培棉花TRV-VIGS体系, 成功抑制了棉花 GhCTR1基因的表达, 与对照株相比, 抑制后的棉花植株出现矮化表型, 说明水培棉花TRV-VIGS体系建立在棉花研究中的广谱利用性。
Using GhCLA1 as a marker gene and cotton variety Guoxinmian 3 plants as material, we aimed to explore effects of temperature, syringe-infiltrated concentrations and time, cultivation patterns, and cotton varieties on efficiency of tobacco rattle virus (TRV)-induced gene silencing (VIGS) under hydroponic condition. The results showed that higher silencing efficiency was induced by syringe-infiltrated time at 3 to 5 days after emergence and optimum growth temperature at 24℃ under hydroponic condition, but syringe-infiltrated concentrations could not affect VIGS silence efficiency. Moreover, pTRV-GFP as null fragment could alleviate the adverse effect of inserted fragment for plant growth. Silencing phenotype could be visible earlier in hydroponics culture than in soil culture, and the experimental period was significantly shortened under hydroponic condition. In addition, GhCLA1could be silenced in all tested varieties (lines) under hydroponic condition. Cotton plants with silenced GhCTR1 were severely dwarfed, which indicated TRV-VIGS system can be applied widely in hydroponic cotton.
病毒诱导的基因沉默(virus-induced gene silencing, VIGS)作为一种快速的基因沉默技术已广泛用于拟南芥[1]、烟草[2]、大豆[3]等植物基因功能的研究。携带部分病毒基因组和目的基因片段的T-DNA通过农杆菌侵染被释放到植物宿主体内后, 能够特异性地攻击宿主体内的同源mRNA, 使植物体内特异同源目的基因受到不同抑制, 最终导致植株局部或整体表现出该基因功能丧失或降低的相应表型[4, 5]。目前, VIGS技术在研究棉花基因功能上已开始广泛应用, Gao等[6]利用VIGS技术对棉花抗黄萎病相关基因进行了深入研究; 王丽等[7]通过沉默棉花GhCPS基因, 探究了GhCPS对植物激素和植株幼苗光合能力的影响; 王心宇等[8]利用TRV-VIGS体系成功抑制了棉花GhMAPKKK基因的表达, 验证了GhMAPKKK基因在抗黄萎病过程中的作用。随着棉花四倍体数据库的释放, 大量未知基因有待发掘和鉴定, 若能利用棉花cDNA基因文库并使其与VIGS技术结合, 便可通过敲除基因功能筛选参与特定生理生化反应或抗逆反应的功能基因, 加速棉花基因组功能的研究。
尽管VIGS技术在棉花上已得到成功应用, 但上述研究都是在土培方式下进行, 试验周期较长, 后期利用VIGS技术进行文库筛选需要耗费大量时间。若能在水培棉花上进行VIGS基因功能的研究及文库的筛选, 可大大缩短试验周期, 缩短棉花基因组功能研究的时间成本。由于VIGS基因沉默效率依赖于病毒入侵植物体的能力和较高的复制水平[9]。因此, 与病毒积累相关的因素如注射植株的生长时期、植株的生长环境、农杆菌的浓度、载体等都有可能影响病毒诱导的基因沉默效率。本试验以GhCLA1为指示基因, 利用已构建好的pTRV- GhCLA1沉默载体, 以棉花为材料, 对水培条件下棉花VIGS基因沉默体系进行了探索和优化, 并成功抑制了乙烯负调控因子GhCTR1的表达, 验证了该体系的可行性, 为后期快速筛选目标基因、研究基因功能奠定了基础。
陆地棉(Gossypium hirsutumL.)品种国欣棉3号由河北省河间市国欣农村技术服务总会提供。
1.1.1 水培 将种子种于发芽盒, 出苗次日移植至Hoagland营养液中。培养室光照/黑暗时长为14 h/10 h, 相对湿度为60%, 每7 d换一次营养液。
1.1.2 土培 将种子播在装有营养土∶ 蛭石(w/w) = 1∶ 1的花盆中, 保持土壤湿润, 温度为24℃, 光照保持不变。
TRV为双粒RNA病毒, 因此需要二元病毒载体共侵染棉花, 质粒pTRV-GhCLA1、pTRV-GFP、pTRV-RNA2和pTRV-RNA1由美国德州农工大学(Texas A& M University)单立波教授惠赠。分别将pTRV-GhCLA1、pTRV-GFP、pTRV-RNA2和pTRV- RNA1质粒转化农杆菌GV3101, 挑取单克隆至5 mLYEP (含25 mg L-1庆大霉素和50 mg L-1卡那霉素)液体培养基中, 在200转 min-1摇床上28℃培养过夜, 然后取上述菌液按1︰50比例分别加至含终浓度为10 mmol L-1的MES和20 μ mol L-1的乙酰丁香酮50 mL的YEP (含25 mg L-1庆大霉素和50 mg L-1卡那霉素) 培养基中, 28℃摇床上200转 min-1摇菌过夜。次日离心收集菌体沉淀 (6000转 min-1, 10 min), 用重悬液 (10 mmol L-1的MES、200 μ mol L-1的乙酰丁香酮及10 mmol L-1的MgCl2)重悬, 室温放置3~4 h后, 将含pTRV-GhCLA1和pTRV-RNA1的两种重悬菌液等体积混合, 用注射器按压棉花叶子的背面以侵染。
1.3.1 棉花培养温度及菌体重悬浓度 在水培条件下, 按1.2菌体培养及注射方法, 将注射后的棉花幼苗分别放置昼夜温20℃/18℃、24℃/20℃、28℃/20℃条件下培养, 每组温度条件下分别设置菌体浓度OD600值为0.8和1.5, 光照和湿度保持不变。
1.3.2 棉花幼苗注射时间 在水培条件下, 按1.2菌体培养及注射方法, 设置在出苗后的3、5、7、9 d进行注射, 注射菌体OD600值为1.5, 并在昼夜温24℃/20℃条件下培养, 光照和湿度保持不变。
1.3.3 试验对照设置 按1.2菌体培养及注射方法, 将pTRV-RNA1重悬液分别与pTRV-RNA2、pTRV-GFP重悬液混合, 在出苗后的第3天注射棉花子叶, 注射菌体OD600值为1.5, 并在昼夜温24℃/20℃条件下培养, 光照和湿度保持不变。
1.3.4 栽培方式 按1.1所述栽培方法分别对棉苗水培和土培, 并按1.2菌体培养及注射方法, 在棉花出苗后的第3天注射, 注射菌体OD600值为1.5, 培养在昼夜温24℃/20℃条件下, 光照和湿度保持不变。
1.3.5 品种 采用水培方式种植邯7860、国欣棉8号、国欣棉3号、国欣棉9号、GK99-1、鲁棉研28和鲁棉研21棉花品种。按1.2菌体培养及注射方法, 在棉花出苗后的第3天注射菌体, 其OD600值为1.5, 并在昼夜温24℃/20℃条件下培养, 光照和湿度保持不变。
注射病毒后15 d, 观察pTRV-GhCLA1棉花幼苗叶片在不同温度下的白化情况并照相。分别取24℃条件下对照组(pTRV-GFP)和GhCLA1沉默组(pTRV-GhCLA1) 棉花幼苗的第2片真叶(自茎基部向上), 提取总RNA, 逆转录合成cDNA。根据棉花内参基因GhUBQ7 (GenBank登录号为DQ116441) 和GhCLA1设计引物, 引物序列分别为GhUBQ7-F: 5'-A AGAAGAAGACCTACACCAAGCC-3', GhUBQ7-R: 5'-GCCCACACTTACCGCAATA-3', GhCLA1-F: 5'-G GAATTCCACAACATCGATGATTTAG-3', GhCLA1-R: 5'-GGGGTACCATGATGAGTAGATTGCAC-3'。以半定量PCR检测GhCLA1沉默效率。
注射病毒后15 d, 分别取pTRV-GFP对照组和pTRV-GhCLA1沉默组棉花幼苗的第l叶和第2叶, 测定总叶绿素含量, 以叶绿素含量下降比例为基因沉默效率检测指标[10], 具体方法参照Lichtenthaler和Wellbum[11]的描述。
用植物RNA提取试剂盒(艾德莱, 北京)提取棉花叶片的总RNA, 用逆转录酶(M-MLV Reverse Transcriptase, Promega)合成cDNA。根据GhCTR1 (GenBank登录号为GU207868.1)部分序列设计特异性引物(上游引物5'-CGGAATTCCATATGCCTGGAC TGTGTGC-3', 下画线为EcoR Ι 酶切位点; 下游引物5'-GGGGTACCACAATATTTGCAGCCCTTCG-3', 下画线为KpnI酶切位点), 以cDNA为模板, 用KOD-Plus高保真酶(TOYOBO, Japan)进行RT-PCR扩增并测序, 然后用EcoR I/KpnI双酶切扩增产物和pTRV-RNA2 载体, 分别回收酶切产物, 连接、转化和筛选阳性克隆。
采用水培方式, 按1.2菌体培养及注射方法, 在棉花出苗后的第3天注射, 注射菌体OD为1.5, 在昼夜温24℃/20℃条件下培养, 光照和湿度保持不变。
独立重复3次每个单因素的VIGS沉默效率试验, 各次结果趋势一致, 取用其中具有代表性的数值。用SPASS 16.0 (SPSS Inc. Chicago, USA)的t检验比较平均值(P < 0.05)。
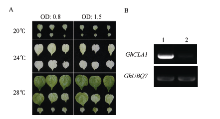
侵染棉花15 d后, VIGS-GhCLA1沉默植株在20℃条件下第1、第2真叶出现了明显的白化表型, 刚刚展开的叶片与正常温度28℃下的植株相比生长受到了显著抑制; 在24℃条件下, 植物同样出现了显著的白化表型, 并且其叶片只略小于正常温度下植株叶片; 而在正常生长温度条件下的沉默植株只显示出了部分花斑状的白化表型(图1-A)。24℃条件下的沉默植株半定量PCR检测结果显示, GhCLA1基因的表达量与对照相比受到了显著的抑制(图1-B)。因此, 所有后续试验选择在24℃条件下进行, 这样植株可维持较高的沉默效率和较快的生长速度。
在同一温度下, 以OD600值为0.8和1.5的重悬液侵染, 发现棉花在后期并没有出现沉默效率上的差异(图1-A), 说明菌体浓度并不是影响基因沉默效率的决定因素。
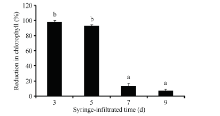
分别在出苗后的第3天、5天、7天和9天注射侵染棉花子叶, 其中出苗后3 d侵染的植株, 叶绿素含量能够95%以上。出苗后5 d注射可使植株叶绿素含量下降90%以上。但在出苗7 d后侵染只能引起不到20%的叶绿素含量下降(图2)。
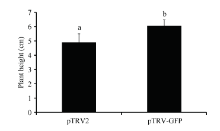
pTRV-GFP质粒是含一段外源GFP基因片段的pTRV-RNA2质粒, 将pTRV-RNA1重悬液与pTRV- RNA2、pTRV-GFP重悬液分别混合后注射进棉花子
叶, 注射14 d后, 用含pTRV-RNA2混合重悬液处理的植株幼苗在株高上低于pTRV-GFP重悬液处理的植株(图3), 并有一般显著性差异(P < 0.05), 插入片段的大小可以影响病毒在宿主细胞内的传播和扩散, 因此, 后期用pTRV-GFP作为空白对照可以减弱插入片段对植株生长的影响, 减小对照误差。
水培棉花在注射5 d后, 处理组和对照组的一叶均展开, 开始出现2叶, 且GhCLA1沉默植株与对照相比开始出现花斑, 叶色变浅, 注射10 d后, 水培棉花2叶已完全展开且整株叶片出现白化状态; 而土培棉花在注射10 d后出现了白化, 整体长势上晚于水培棉花(图4)。因此, 用水培方式进行VIGS技术研究棉花基因功能, 可以更快、更有效地沉默目的基因, 缩短试验时间。
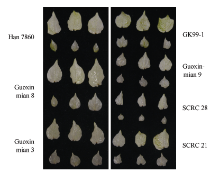
如图5所示, 在农杆菌侵染棉花15 d后, 几个棉花常用品种邯7860、国欣棉8号、国欣棉3号、国欣棉9号、GK99-1、鲁棉研28和鲁棉研21均出现了显著的白化现象, 品种间白化程度差异不大(图5), 表明VIGS技术能够成功地普遍应用于棉花不同品种, 同时也验证了同一基因序列在不同株系中功能上的高度保守性, 为后期鉴定基因功能提供了理论支持。
用pTRV-RNA1和pTRV-GhCTR1混合重悬液侵染棉花子叶, 20 d后与对照相比, 植株出现了明显的矮化表型(图6-A)。提取pTRV-GhCTR1和pTRV-GFP处理植株叶片的总RNA, 半定量RT-PCR检测表明, 与对照植株相比, 侵染pTRV-GhCTR1的植株GhCTR1基因表达水平显著降低(图6-B)。结果表明水培棉花VIGS技术体系能够成功应用到基因研究工作中。
VIGS技术已广泛应用在拟南芥、烟草等多种植物[1, 2], 而在棉花中应用时间尚短, 尤其是在水培条件下生长的棉花, 如何对在水培条件下生长的棉花进行VIGS操作来获得高效、稳定、快速的基因沉默效率是实际应用中应该考虑的问题。
温度是影响病毒诱导的基因沉默效率的重要因素[12, 13], 病毒感染症状严重程度和感染的分子过程受到温度的影响, 较低温度能使植物更早开启VIGS机制, 产生更强烈的基因沉默表型[14, 15], 但温度过低会抑制植株生长, 而温度较高则会在某些情况下使病毒消灭。因此, 每个病毒-宿主植物基因沉默体系都有各自的最优温度[16]。例如, 在番茄中, 病毒诱导的基因沉默最佳温度为21℃ [17], 而在烟草中则为25℃ [2]。植物生长温度能够影响病毒DNA的转录、病毒在植物体内的传播、沉默信号的产生及病毒和宿主因子的相关作用[17]。VIGS技术在土培棉花上的应用一般采用23℃ [6, 8], 本研究结果显示, 对水培条件下棉花VIGS来说, 植株培养温度24℃、出苗后5 d内进行农杆菌侵染能够保持VIGS-pTRV病毒载体在棉花体内较快的传播, 使植株获得较高沉默效率。
植株生长阶段也是影响基因沉默效率的因素之一[15, 18], 而且幼嫩的植物比成熟期植物更容易出现沉默表型[19]。本研究结果与上述研究类似, 在棉花出苗后的3~5 d内用农杆菌注射子叶, 更容易出现较高程度的基因沉默表型。 同时, 试验中对照植株的选择对实验结果起着非常重要的作用。在很多TRV烟草脆裂病毒介导的VIGS试验中, pTRV-RNA2作为不含目的基因片段的原始载体, 通常与pTRV-RNA1混合作为对照[16]。插入片段的大小能够通过影响病毒在植物体内的复制效率和扩散程度从而影响对植株的胁迫程度, 因此pTRV-GFP载体能够减轻病毒引起的叶片卷曲等症状[10], 减弱病毒浸染对植株的抑制作用。由于插入片段大小的不同而引起的植株间的差异容易混淆实验结果, 因此, 对于沉默不同基因的VIGS试验, 需要选择对应的较优化的载体对照。
对许多作物来说, 稳定转基因株系的产生总是受到遗传背景的限制。VIGS技术在水培棉花不同品种株系上的稳定应用是利用该技术对棉花基因功能及基因组学进行研究的必要条件。我们发现在优化的沉默体系条件下, VIGS技术能够成功地应用于水培条件下多种棉花品种, VIGS诱导基因沉默受棉花宿主遗传背景影响较小, 可广泛用于来源不同的棉花材料, 为后期确定基因功能提供了可信性。
CTR1编码一个Raf家族的蛋白激酶, 作用于乙烯受体下游, 负调控乙烯响应途径。CTR1功能缺失突变体能够使植株产生矮化表型[20]。本文利用优化的水培棉花VIGS沉默体系成功抑制了GhCTR1基因表达, 沉默植株与pTRV-GFP对照株相比出现了明显的矮化表型, 说明该体系能够成功应用到棉花基因功能的研究中。此外, 与土培技术相比, 水培具有出苗整齐, 方便管理等优势, 在水培条件下对棉花进行VIGS-cDNA文库的筛选, 可以在同一水培盒中同时沉默多个基因, 后期在同样的外源处理条件下, 能够比较沉默不同基因植株之间的差异, 较快筛选理想表型, 缩短实验周期, 加速棉花cDNA文库的筛选进程。
成功建立了水培条件下棉花VIGS 基因沉默体系。在24℃条件下, 用OD值为0.8或1.5的混合菌体重悬液, 在出苗后3~5 d内用注射的方法侵染棉花, 同时以含pTRV-GFP质粒的农杆菌为对照, 能够更快、更准确地发现目的表型, 鉴定基因功能。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|