第一作者联系方式: 刘睿洋, E-mail: ruiyang_liu2007@126.com **同等贡献(Contributed equally to this work)
高油酸油具备较高的营养价值, 在甘蓝型油菜中, 脂肪酸去饱和酶基因( FAD2)是控制油酸含量的关键基因。本研究克隆了甘蓝型油菜A5、C5、A1连锁群上3个 BnFAD2基因的全长cDNA序列, 分别命名为 BnFAD2-A5、 BnFAD2-C5和 BnFAD2-A1, 各自编码384、384、136个氨基酸。分别使用TMHMM、Clust X软件分析 FAD2基因的跨膜结构域和酶活中心表明, BnFAD2-A1不具备脱氢酶活性。采用酵母功能互补实验对4个基因(含已发表的 BnFAD2-C1)进行功能验证, 发现 BnFAD2-A5和 BnFAD2-C5基因去饱和能力接近, 均大于 BnFAD2- C1基因。采用qRT-PCR分析4个基因在甘蓝型油菜不同组织中的表达规律, 并用血凝素标签法分析BnFAD2-C1、BnFAD2-A5和BnFAD2-C5的蛋白稳定性, 表明 BnFAD2-A5和 BnFAD2-C5是影响油菜种子油酸积累的主效基因。
The oil containing high oleic acid is high nutritional. In Brassica napus, the fatty acid desaturase gene ( FAD2) is the key gene controlling oleic acid content. In this study, the full-length cDNA sequences of three genes located on chromosome A5, C5 and A1 in Brassica napus were cloned and named BnFAD2-A5, BnFAD2-C5 and BnFAD2-A1. The three genes encode proteins with 384, 384, and 136 amino acid residues, respectively. TMHMM was used to predict transmembrane domain and Clust X software was used to analyze the activity center of FAD2 genes. Both of the results showed that BnFAD2-A1 did not have the function of dehydrogenase. The yeast complementary experiment on four genes (including published BnFAD2-C1gene) showed that the desaturation capability of BnFAD2-A5 gene was next to that of BnFAD2-C5 gene, and both of them were greater than that of BnFAD2-C1 gene. The expression patterns of the four genes were analyzed by using qRT-PCR technique in different tissues and the protein stability of BnFAD2-C1, BnFAD2-A5, and BnFAD2-C5 was analyzed by using Hemagglutinin labeling method. Both of the results revealed that BnFAD2-A5 and BnFAD2-C5are major genes affecting the accumulation of oleic acid in B. napus.
高油酸菜籽油具备较高的营养价值和氧化稳定性, 主要因为其含有大量单不饱和脂肪酸和较少量多不饱和脂肪酸(如亚油酸、亚麻酸)。亚油酸是亚麻酸的合成前体, 由脂肪酸去饱和酶2 (FAD2; EC 1.3.1.25)催化油酸脱氢形成[1]。因此, FAD2是菜籽油品质改良的关键基因。
Tanhuanpä ä 等[2]最先在白菜型油菜中进行油酸含量QTL定位研究, 以白菜型油菜杂交F2代为作图群体, 发现2个控制油酸含量的QTL, 并将其定位在FAD2基因[3]。在甘蓝型油菜中, Schierholt等[4]以高油酸材料为研究对象, 发现一个控制油酸含量的QTL位于A5连锁群, 且证明高油酸的性状是由FAD2基因突变导致。Hu等[5]不仅证实了这一发现, 还在A1连锁群上定位到一个微效QTL, 控制油酸含量。杨燕宇等[6]也证实A5连锁群上具有一个控制油酸含量QTL, 并首次报道在C5连锁群上具有一个控制油酸含量的QTL, 认为该QTL与A5连锁群QTL为同源标记。
在甘蓝型油菜基因组中, FAD2基因通常以多拷贝的形式存在。Scheffler等[7]利用Southem杂交发现在甘蓝型油菜中, FAD2基因有4~6个拷贝, 其中4个拷贝被分别定位在Al、C1、A5和C5连锁群上。这4个拷贝中, 位于C1、A5和C5连锁群上的3个被Smooker等[8]开发的FAD2基因标记所证实。肖钢等[9]根据FAD2保守序列设计引物, 克隆了甘蓝型油菜基因组FAD2, 获得了56条基因序列, 分析认为在甘蓝型油菜中FAD2基因存在11个拷贝, 分为有功能的5个拷贝和无功能的6个拷贝[10]。杨庆勇等[11]借助于白菜、甘蓝基因组数据库, 在油菜基因组中定位了4个FAD2基因。近些年关于甘蓝型油菜FAD2基因拷贝数的研究日渐明确, 但对于该基因的染色体定位及其功能机制还不十分清楚。
本研究克隆了甘蓝型油菜A5、C5、A1连锁群上共3个BnFAD2基因的全长cDNA序列, 采用生物信息学和酵母功能互补实验的方法分析4个基因功能, 通过比较4个基因在不同组织中的表达规律及BnFAD2-C1、BnFAD2-A5和BnFAD2-C5的蛋白稳定性, 进一步了解4个基因在油酸积累过程中的功能, 确定其主效功能蛋白。
甘蓝型油菜湘油15来源于湖南农业大学油料作物研究所; 酵母菌株INVSC I和酵母表达载体PYES2.0为湖南省作物基因工程重点实验室的陈信波教授赠予; 本试验中所用到的引物均由南京金斯瑞合成。
利用已公布的甘蓝型油菜BnFAD2基因(NCBI登录号为AY577313), 在白菜、甘蓝的基因组数据库中进行Blast比对, 发现在A1、A5、C5染色体上分别存在FAD2基因序列, 根据序列两端的差异碱基设计了每个FAD2基因的特异扩增引物SP。
使用肖钢等[9]设计的FAD2基因编码区保守序列的扩增引物P1/P2和特异定位引物SP (表1), 以基因组DNA为模板进行高保真扩增。将PCR产物纯化回收后, 进行加A反应, 然后将其连接到pMD18-T载体并转化到大肠杆菌中, 由铂尚公司完成测序工作。
参考Kiefer等[12]的方法, 采用CTAB法提取油菜总RNA, 按照消化试剂盒(TaRaKa, Japan)说明书操作, 去除RNA中的基因组DNA。将消化后的RNA按照Smarter Race cDNA扩增试剂盒说明扩增BnFAD2基因全长cDNA, 转化大肠杆菌并筛选阳性菌测序。
| 表1 BnFAD2基因克隆中用到的引物序列 Table 1 List of primers used in experiments to clone BnFAD2gene |
根据已获得的全长cDNA序列, 在该基因3′ UTR序列区域设计特异性引物进行定量PCR检测。引物序列如表2所示。采用上述方法提取油菜不同组织及不同发育时期种子的RNA, 包括根、花、角果皮(开花后10、15、20、25、30、35和40 d), 种子(开花后10、15、20、25、30、35和40 d)。将RNA按照上述方法消化后, 按照PrimeScript II 1st Strand cDNA Synthesis Kit说明书(TaKaRa)进行cDNA第1链的合成, 选择Actin作为内参基因, 进行定量PCR检测。
| 表2 BnFAD2基因拷贝表达检测引物 Table 2 List of primers used for detecting expression quality of BnFAD2gene |
1.4.1 BnFAD2蛋白的跨膜结构域分析 在丹麦技术大学生物序列中心网站(http://www.cbs.dtu.dk/services/)分别使用TM HMM对跨膜结构域进行预测分析。
1.4.2 BnFAD2蛋白的酶活中心分析 使用Clust X软件, 将大豆[13]、花生[14]、向日葵[15]、玉米[16]、棉花[17]、拟南芥[1]、红花[18] 9种植物的FAD2基因序列与BnFAD2基因的4个拷贝序列进行比对分析。
将获得的BnFAD2基因连接于PYES2.0载体, 采用氯化锂法将其转化到酵母菌株INVSC I中。参考徐荣华等[19]的方法培养酵母, 将含有BnFAD2拷贝基因的酵母及含有对照质粒的酵母在尿嘧啶缺陷的合成完全培养基(synthetic minimal defined medium lacking uracil, SC-U)抑制培养基(2%葡萄糖)中220转 min-1振荡培养, 在30℃条件下培养过夜。当OD600值为1.0时, 离心收集菌体, 用SC-U诱导培养基(2%半乳糖)重悬菌体至OD600值为0.4, 在220转 min-1、30℃条件下培养36 h后, 收集酵母菌体, 低温冻干, 测定脂肪酸组分。采用 HP 6890N 分析脂肪酸, 毛细管色谱柱为Aginent DB-23, 在肖钢等[10]的方法基础上, 待柱温升至210℃后, 运行时间延长至8 min。
将BnFAD2基因的4个拷贝分别与血细胞凝集素(Haemagg, HA)标签融合, 然后连接到PYES2.0载体, 转化至酿酒酵母INVSC I, 筛选阳性菌株。将已获得的阳性菌株于30℃条件下活化培养, 待OD600值为1.0时, 收集菌体备用。
参考O’ Quin等[20]的实验方法, 使用含有终浓度为2%葡萄糖和0.5 mg mL-1环己酰亚胺的SC-U酵母液体培养基重悬菌体, 在30℃下培养8 h, 并在0、2、4、6和8 h时收集相同数量的酵母菌体, 提取总蛋白, 用于蛋白印迹杂交分析(Western blot)。参照鲁少平[21]的方法进行Western blot。一抗使用HA标签抗体, 从山羊中提取获得, 二抗使用小鼠抗山羊抗体, 采用ECL发光检测。
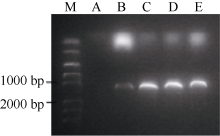
使用保守引物P1、P2和染色体定位引物SP, 从基因组中高保真扩增, 均得到约1100 bp长度的片段(图1-A, B)。将其转化到大肠杆菌后测序, 获得多个不同的拷贝序列, 根据油菜与甘蓝、白菜的同源性, 将这些拷贝分别定位到A1、A5和C5染色体上, 分别命名为BnFAD2-A1、BnFAD2-A5和BnFAD2-C5。
采用RACE技术在甘蓝型油菜种子的cDNA中克隆5′ UTR和3′ UTR序列, 以确定转录起始位点和终止位点。以RACE试剂盒中M14R引物为反向引物, 在3个FAD2基因同源区序列设计引物RACE-F (5′ -CTATGTTGAACCGGATAGGCA-3′ )为正向引物, 高保真扩增3′ UTR序列(图1-D), 并转化大肠杆菌。大量筛选阳性菌落, 测序。同时, 在编码区内部同源区设计反向引物CDS-R (5′ -GTGGGATTGCTTTCT TGAG-3′ ), 结合试剂盒中的特定正引物(UPM/NUP), 高保真扩增FAD2基因5′ UTR序列(图1-C)。转化大肠杆菌并筛选阳性菌测序。BnFAD2-A1、BnFAD2-A5和BnFAD2-C5基因中5′ UTR和3′ UTR序列长度分别为167、155、155和166、308和286 bp。在此基础上, 以基因组DNA为模板, 将3个基因从5′ UTR至3′ UTR序列进行高保真克隆, 得到3个基因的全长序列。
BnFAD2基因在油菜基因组中主要由5′ UTR、CDS、3′ UTR及位于5′ UTR内部的内含子(Intron)序列4个部分构成; 其基因的转录由位于5′ UTR之前的启动子序列启动, 转录由5′ UTR第一个碱基起始至3′ UTR结束。
BnFAD2-A1基因的开放式阅读框(ORF)长度为1141 bp, 因其发生了碱基的添加(在180位2 nt, 1009位1 nt)与删除(在164位1 nt, 在231位15 nt, 在409位1 nt), 致使其在第411位碱基处翻译提前终止, 共编码136个氨基酸; 其5′ 端存在着一个159 bp的UTR序列, 且其内部含有长度为618 bp的内含子, 在3′ 末端带有一个166 bp的UTR序列。BnFAD2-C1 (已发表)是BnFAD2-A1的同源基因, 编码384个氨基酸。
BnFAD2-A5基因的ORF长度为1155 bp, 编码384个氨基酸, 5′ UTR长度为155 bp, 其中内含子为1077 bp, 3′ UTR长度为308 bp。BnFAD2-C5基因的ORF长度为1155 bp, 编码384个氨基酸, 5′ UTR长度为151 bp, 其中内含子为1123 bp, 3′ UTR长度为286 bp。
BnFAD2-A1、BnFAD2-C1基因分别与白菜BrFAD2-A1、甘蓝BoFAD2-C1基因的同源性为100%; BnFAD2-A5、BnFAD2-C5基因分别与白菜BrFAD 2-A5、甘蓝BoFAD2-C5基因的同源性为98.87%和99.22%。
由图2可知, 甘蓝型油菜中BnFAD2-A5、BnFAD2-C5和BnFAD2-C1蛋白的序列相似度为96.61%, 其中包含6个跨膜结构域和3个组氨酸富集区, 3个组氨酸富集区与铁离子共同构成脱氢酶的酶活中心[22]。而BnFAD2-A1基因的ORF出现碱基缺失及移码突变, 致使其蛋白质缺少了2个组氨酸富集区, 无法与铁离子结合构成有功能的酶活中心, 因此, 推测BnFAD2-A1基因不具备脂肪酸脱氢酶的活性。
将4个BnFAD2基因分别连接到pYES2.0载体, 然后转入酵母INVSC I。将转化的酵母涂布于SC-U固体平板, 30℃条件下培养2 d。挑选单菌落于2 mL SC-U液体培养基(2%半乳糖)摇过夜, 收集菌体, 使用酵母质粒提取试剂盒(天根)提取质粒, 以保守引物P1, P2为引物进行PCR检测。结果如图3, 酵母INVSC I自身不含有FAD2基因, 而转化的酵母均扩增出约1100 bp长度的产物, 说明已成功将BnFAD2基因转入酵母中。
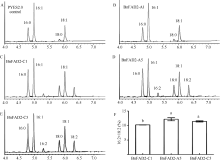
经生物信息学预测已知, BnFAD2-A1基因不具备脂肪酸脱氢酶的活性, 其他3个基因功能尚未可知。为了研究3个基因活性差异并进一步验证BnFAD2- A1蛋白的功能活性, 将4个基因分别转入酵母采用气相色谱分析脂肪酸组分。在阴性对照中, 酵母的脂肪酸色谱图上只有棕榈酸(16:0)、棕榈一烯酸(16:1)、硬脂酸(C18:0)和油酸(C18:1), 因此酿酒酵母INVSC I是一种天然的FAD2基因突变体, 适合于检测BnFAD2基因功能的分析(图4-A)。在图4-C, E中, 气相色谱图上出现了棕榈二烯酸(16:2)和亚油酸(18:2)的特异脂肪酸峰, 这意味着BnFAD2-C1、BnFAD2-A5、BnFAD2-C5完全具备脱氢酶的活性。与此同时, 含有 BnFAD2-A1基因的酵母菌株则没有检测到这2个特异性的脂肪酸峰, 说明BnFAD2- A1基因不具备油酸脱氢酶功能, 是假基因。这与生物信息学分析的结果一致。
由于棕榈二烯酸(16:2)和亚油酸(18:2)均是由BnFAD2基因将其相应底物脱氢而生成, 因此我们以二者在脂肪酸中所占的比例来表示BnFAD2-C1、BnFAD2-A5、BnFAD2-C5基因脂肪酸脱氢酶活性的大小, 结果显示, BnFAD2-A5和BnFAD2-C5活性较为接近, 显著高于BnFAD2-C1。
图5-A表明, BnFAD2表达量随着种子成熟度加深而先上升后下降, 在授粉后25 d达到顶峰; 其中BnFAD2-A5表达起伏平缓, 而BnFAD2-A1、BnFAD2-C1、BnFAD2-C5在第15~25 d期间, 表达量大幅上调, 而后迅速下降, 表明该时期三者共同受到某种因素调节。从整体上看, BnFAD2-C5的表达量最高, 其次是BnFAD2-A1和BnFAD2-A5, 而BnFAD2-C1表达量最低。BnFAD2-A1经证明并没有脱氢酶的活性, BnFAD2-C1蛋白脱氢酶活性最弱, 因此认为, 在种子中对油酸消减的主效基因是BnFAD2-A5和BnFAD2-C5。据表达规律, BnFAD2-A5基因应属于组成型表达基因, 而BnFAD2-C5基因表达规律更接近于为诱导增强型表达。
在角果皮中(图5-B), BnFAD2-A5、BnFAD2-C5与另外2个拷贝相比更加活跃, 且表达变化不明显; 但BnFAD2-A1在油菜即将成熟时出现大幅上调。
在油菜的花和根中(图5-C), BnFAD2-A5和BnFAD2-C5仍然维持着较高的表达量; 在根组织中, BnFAD2-A5的表达量高于BnFAD2-C5, 而在花中BnFAD2-A5的表达量要低于BnFAD2-C5, 推测BnFAD2-A5主要负责根细胞多不饱和脂肪酸的合成, 而BnFAD2-C5负责花器官多不饱和脂肪酸的合成。BnFAD2-A1在根组织中的表达量接近于0, 在花中的表达量较高, 仅次于BnFAD2-C5。
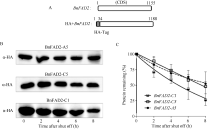
将HA标签插入BnFAD2基因的5′ 端, 对其蛋白定量示踪(图6-A)。显示, 随着时间的推移, BnFAD2- A5、BnFAD2-C5、BnFAD2-C1的蛋白含量不断减少。在8 h时, BnFAD2-A5、BnFAD2-C5的蛋白残存量为原有的50%, 而BnFAD2-C1为原有的25%; 这说明BnFAD2-A5、BnFAD2-C5的蛋白较之BnFAD2-C1更加稳定。在同等情况下, 细胞中始终会保持较高含量的BnFAD2-A5和BnFAD2-C5, 发挥油酸脱氢酶的功能(图6-B)。
利用Quality One软件将Western杂交斑点数字化, 并绘制衰减曲线, 结果表明, BnFAD2-A5与BnFAD2-C5蛋白衰减曲线十分接近, 说明二者的蛋白稳定性相同; BnFAD2-C1的蛋白衰减曲线下滑速率显著高于BnFAD2-A5和BnFAD-C5, 其蛋白的稳定性较差。
油菜油酸含量QTL最先是由Tanhuanpä ä 等[2]在白菜型油菜(Brassica rapassp. oleifera)中定位的, 使用白菜型油菜杂交F2代群体作为作图群体, 找到2个控制油酸含量的QTL。在甘蓝型油菜中, Schierholt等[4]用高油酸材料发现在A5连锁群上存在一个控制油酸含量的QTL, 并证明高油酸是FAD2基因突变的结果, 随后这个发现被Hu等[5]证实, 并发现A1连锁群上存在一个控制油酸含量的微效QTL。Mahmood等[23]研究发现, 在A8连锁群上存在1个油酸含量主效QTL。Smooker等[8]、Burns等[24]和Zhao等[25]研究表明, 在C8连锁群上还有一个油酸含量主效QTL。张洁夫等[26]和Smooker等[8]在C3连锁群还发现了另一个油酸含量的主效QTL。在芥菜型油菜中, 这种油酸含量主效QTL同时也是芥酸含量主效QTL并且与FAE基因相关的现象是与甘蓝型油菜一致的[23]。
基于甘蓝型油菜湘油15为当前普遍种植的低油酸油菜的代表品种(油酸含量为62%), FAD2是目前定位到与油酸相关的关键基因, 本研究克隆到BnFAD2基因的多个拷贝序列, 经比对验证, 发现在甘蓝型油菜基因组中只有4个拷贝, 并分别定位于A1、C1、A5、C5染色体上, 这与前人的研究结果一致。
植物FAD2蛋白一般定位于细胞内质网中, FAD2蛋白在翻译的同时依赖于其第一个疏水跨膜区作为N端的信号序列与信号识别颗粒SRP (signal recongnition particle)相互作用, 插入到内质网膜上, 便于蛋白的跨膜运输[27]。组氨酸富集区常作为酶活性中心, 参与蛋白功能发挥。BnFAD2-A1编码的蛋白只有正常BnFAD2蛋白前端的136个氨基酸, 缺少2个组氨酸富集区, 因此BnFAD2-A1基因不具备脱氢酶的活性, 这已在酵母功能实验中得到了证实。甘蓝型油菜中A基因组来源于白菜[28], Jung等[29]发现白菜中含有两个FAD2拷贝, 其中一个不具备功能; 肖刚等[10]克隆到长度为1141 bp的假基因, 经序列比对分析, 该假基因即为本研究中的BnFAD2-A1。虽然BnFAD2-A1是假基因, 但其在种子、花和角果皮中表达却异常活跃。假基因即与功能基因相关的、有缺陷的序列, 不受进化的负选择作用, 因此, 可为物种进化的正选择、负选择以及中性漂变提供丰富的原材料, 成为物种进化不可缺少的有用工具[30]。
由于BnFAD2-A1是假基因, 那么在油菜种子油酯合成期发挥油酸消减功能的基因就是BnFAD2- C1、BnFAD2-A5、BnFAD2-C5。对于消减功能的发挥起重要作用的因素是蛋白稳定性, 且不同蛋白稳定性存在差异, 这一差异削弱了基因表达量与蛋白含量之间的关系。O’ Quin等[31]利用血细胞凝集素(Haemagg, HA)标签法成功检测了拟南芥FAD2和油菜FAD3蛋白的稳定性。在此, 我们利用HA标签定量示踪BnFAD2蛋白, 发现BnFAD2-A5与BnFAD2-C5蛋白衰减趋势接近, 稳定性相同; 较之BnFAD2-C1蛋白稳定性更强。
BnFAD2-A5和BnFAD2-C5的基因表达量、脂肪酸脱氢酶活性及蛋白稳定性均明显高于BnFAD2-C1, 这意味着在单位时间内种子细胞中含有较多的BnFAD2-A5和BnFAD2-C5蛋白在对油酸磷脂胆碱发生高效的消减作用; 同时BnFAD2-C5基因的表达量高于BnFAD2-A5, 因此推断, BnFAD2基因的功能发挥是以BnFAD2-C5为主, BnFAD2-A5辅助完成油菜种子中油酸的消减作用。然而, 大量的高油酸QTL实验结果表明, BnFAD2-A5是消减油酸的主效基因[2, 4, 32], 而BnFAD2-C5基因的作用较小。这表明, 在BnFAD2-A5、BnFAD2-C5蛋白对油酸脱氢的过程中, 仍然存在某种机制在对其功能调控, 而这种机制目前尚未可知, 有待进一步探索研究。
甘蓝型油菜只有4个BnFAD2基因, 已克隆到其全长cDNA序列, 其中BnFAD2-C1、BnFAD2-A5和BnFAD2-C5具备正常的脂肪酸脱氢酶功能, 而BnFAD2-A1为假基因, 不具备这一功能。BnFAD2-A5和BnFAD2-C5在基因表达、脂肪酸脱氢酶活性及蛋白稳定性上均明显高于BnFAD2-C1, 这意味着二者是控制种子油酸消减作用的主效基因。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|