第一作者联系方式: 苏炜华, E-mail: 410946470@qq.com; 刘峰, E-mail: 760733016@qq.com
CAX (Ca2+/H+ antiporter)是植物细胞膜Ca2+主动运输体系的一个大类。本研究以高粱的 CAX1基因(GenBank 登录号为XM_002441593)为探针, 利用电子克隆并结合RT-PCR技术, 获得甘蔗 CAX1基因的1条cDNA序列, 命名为 ScCAX1 (GenBank登录号为KT799799)。生物信息学分析显示, ScCAX1基因全长784 bp, 包含1个645 bp的开放阅读框, 编码1个214个氨基酸的蛋白质。ScCAX1蛋白被定位于叶绿体类囊体膜, 为稳定的疏水性蛋白, 不存在信号肽。蛋白二级结构元件多为α-螺旋, 具有1个Na_Ca_ex superfamily。实时荧光定量PCR分析表明, 甘蔗 ScCAX1基因的表达具有组织特异性, 在各组织中均表达, 但在茎中表达量最低, 叶中的表达量最高。在PEG、NaCl、SA、ABA和MeJA胁迫过程中, ScCAX1基因的表达均受到调控。其中ABA、SA和PEG胁迫下表达量上调, 均在胁迫24 h达到最大值。SA胁迫24 h的表达量为对照的5.47倍, 而ABA胁迫24 h的表达量为对照的3.5倍。NaCl胁迫6 h的表达量达最大值, 为对照的2.14倍。推测 ScCAX1基因能够响应逆境胁迫, 其表达可能与甘蔗的抗盐、抗渗透胁迫性状有关。
CAX (Ca2+/H+ antiporter) is a major category of Ca2+ active transport systems in plant cell membrane. In the present study, using a CAX1 mRNA sequence from Sorghum bicolor (GenBank accession number: XM_002441593) as the probe, the full-length cDNA sequence of sugarcane CAX1 gene was cloned by in silico cloning combined with RT-PCR amplification, and named as ScCAX1(GenBank accession number: KT799799). Bioinformatics analysis showed that ScCAX1 has a length of 784 bp and contains a complete open reading frame with a length of 645 bp, which encodes a 214 amino acid residues of sugarcane CAX1 protein. The ScCAX1 protein with stable acidity and hydrophobia was detected to be located in thylakoid membrane of chloroplasts with no signal peptide. It belongs to a conserved Na_Ca_ex. The mainly secondary structure element of ScCAX1 protein is alpha helix. Real time quantitative PCR (RT-qPCR) analysis revealed that the expression of ScCAX1 was tissue-specific, with constituent expression in different tissues of sugarcane. The highest expression was observed in leaf while the lowest in stem. Besides, the expression of ScCAX1gene could be regulated by treatments of PEG, NaCl, SA, ABA, and MeJA. The expression level of this gene was up-regulated by ABA, SA and PEG, with the highest inducible expression level in treatment of 24 hours. The expression level was 5.47 times higher than that of control under 24 hours stress of SA, and 3.5 times higher than that of control under 24 hours stress of ABA. Under 6 hours stress of NaCl, the gene had the highest inducible expression level, which was 2.14 times higher than that of control. This study suggested that ScCAX1 could response to stresses, and its expression may be associated with salt resistance and osmotic tolerance in sugarcane.
Ca2+作为植物体必需的营养元素, 参与植物各阶段的生长发育过程[1]。Ca2+亦是植物体中重要的信使, 它在响应植物自身的发育信息和外部刺激中发挥着重要作用[2, 3, 4]。在响应逆境胁迫方面, Ca2+通过维持质膜结构和功能的稳定, 提高植物的抗逆境能力[5]。当植物受到干旱、低温和盐胁迫等外部刺激时, 细胞中Ca2+浓度会经历短时间的快速上升和长时间慢速上升2个阶段[6, 7, 8], Ca2+浓度的升高作为信号物质诱导响应基因的表达[7]。在植物体内众多的Ca2+转移系统中, Ca2+/H+反向转运体属于Ca2+外向转运器的一类, 它能够调节细胞中的Ca2+浓度、调控植物营养和参与信号传递[4, 9]。
CAXs家族作为CaCA (Ca2+/cation antiporter, Ca2+/阳离子逆向转运体)交换体超家族的一部分, 其主要功能是将阳离子转运出胞外以维持胞内合理的离子浓度, 不仅具有高效率、高通量和低亲和性的特征, 而且对很多金属离子具有较高的转运能力, 但主要以Ca2+为主[10, 11, 12, 13]。植物中关于Ca2+/H+反向转运体的研究, 始于拟南芥(Arabidopsis thaliana)中克隆得到CAX1(calcium exchanger 1)及其表达分析[14]。目前, 在拟南芥中已有CAX1、CAX2、CAX3和CAX4[11, 15, 16]被成功克隆, 预计还有8个Ca2+/H+反向转运体基因[17]。另外CAX1基因已在水稻(Oryza sativa)[18]、绿豆(Vigna radiate)[19]、棉花(Gossypiumspp.)[20]等多个物种中被克隆和分析。CAX1基因在植物的生长发育及适应环境变化方面具有重要的作用。在调控植物营养和生长方面, 有报道称, 与对照组相比, 拟南芥突变体CAX1不仅抽薹时间推迟而且茎的分枝数、总长度、侧根数目及长度均有不同程度减少[21]。另有研究发现, N端缺失的CAX1(sCAX1)被导入烟草和番茄后, 植株体中Ca2+含量升高, 植株发育受到阻碍, 离子敏感度增加, 在对烟草施加外源Ca2+时, 烟草恢复正常生长[22]; 但是, 转基因番茄中幼嫩果实出现脐腐病, 同时果实保鲜期延长[23]。以上说明CAX1可能将植物胞质内的Ca2+转运至液泡使得胞质Ca2+浓度下降, 导致植物营养失衡, 番茄的脐腐病也印证了该观点[22, 23]。Ca2+在植物响应逆境信号过程中起着信使的作用。Park等[23, 24]将拟南芥中的CAX1导入胡萝卜和番茄中表达, 发现植株对Ca2+积累能力增强。将大豆的GmCAX1基因和莱茵衣藻的CrCAX1基因转入拟南芥后, 由于GmCAX1和CrCAX1本身具有Na+/H+的活性, 且位于液泡膜上, 故可以将拟南芥胞质内多余的Na+转运到液泡[25, 26], 进而增强转基因植株对盐胁迫的抗性。在应答冷胁迫方面, 将拟南芥的CAX1基因转入烟草时, 发现烟草内[Ca2+]cyt(胞质Ca2+浓度)的减少导致信号传导受阻, 增强了植株对冷胁迫的敏感性[20, 27]。但是, 目前尚未见关于甘蔗CAX1基因克隆和表达分析的报道。
目前, 我国甘蔗主产区主要为桂、滇、粤、琼的红壤旱地, 那里风、寒、旱等极端气候频发, 对我国甘蔗生产发展造成较大危害[28]。为了更好应对不良环境的影响, 利用分子生物技术培育具有优良抗性甘蔗品种是有效的解决方法之一, 挖掘鉴定优良的基因资源是其中一项重要任务。本研究立足于前人对其他物种CAX1基因的研究进展, 通过电子克隆、RT-PCR及实时荧光定量PCR等技术对甘蔗CAX1基因进行克隆与表达分析, 以期进一步深入理解CAX1基因在甘蔗中的表达功能和作用机制并为甘蔗育种提供抗逆性基因资源。
福建农林大学农业部福建甘蔗生物学与遗传育种重点实验室提供甘蔗材料, 品种为崖城05-179。试剂主要有PrimeScript RT-PCR Kit反转录试剂盒(TaKaRa, 中国大连)、TRIzol Reagent (Invitrogen, Carlsbad, CA, USA)、Gel Extracti on Kit (Tiangen Biotech Co., 中国北京)、SYBRGreen PCR Master Mix Kit (Roche, USA)。
参考黄珑等[29]的操作步骤。在保证样本均一性情况下, 从田间采样, 将蔗株砍成单芽茎段, 于高温高压灭菌营养土中催芽(16 h/8 h, 光/暗, 28℃), 种植。待蔗苗长出4~6叶时, 取长势一致的蔗苗进行组培, 将组培甘蔗幼苗移出并在温室内开放水培一周。设置对照组和试验组, 生物学重复为3次。以0 h未处理的蔗苗作为对照(表1)。以上所有甘蔗材料取样后被立即投入液氮并保存于-80℃冰箱至RNA提取。
| 表1 实时荧光定量材料处理 Table 1 Material processing for Real-time PCR |
以高粱CAX1基因核酸序列(GenBank登录号为XM_002441593)为探针, 利用Blast工具在甘蔗EST数据库中检索, 筛选出与探针序列同源性较高的甘蔗EST序列(表2), 使用在线工具CAP3 (http://pbil.univ-lyon1.fr/ cap3.php)对序列聚类、拼接、延伸, 得到新的重叠群, 持续比对检索直至无新的EST可供拼接为止, 从而获得cDNA序列。使用ORF Finder在线软件(http://www.ncbi.nlm. nih.gov/gorf/orfig.cgi)查找序列的开放阅读框, 并对其分析和翻译。
| 表2 电子克隆中用到的甘蔗EST序列 Table 2 Sugarcane ESTs used in silicon cloning |
通过TRIzol法提取NaCl处理的甘蔗YC05-179蔗苗的总RNA, 然后使用Prime-Script RT Reagent Kit反转录试剂盒合成cDNA作为PCR模板。应用Primer 5.0软件对ScCAX1拼接序列进行特异性引物设计, 即CAX1-1F和CAX-1R (表3), PCR扩增体系总体积25 μ L, 含10× Ex Taq buffer 2.5 μ L、10 mmol L-1 dNTPs 2 μ L、20 μ mol L-1上下游引物各1.0 μ L、Ex Taq酶0.125 μ L、cDNA模板1.0 μ L、ddH2O 17.375 μ L。PCR程序为95℃预变性4 min; 95℃变性30 s, 55℃退火30 s, 72℃延伸2 min, 35个循环; 72℃延伸10 min。先将扩增产物纯化回收, 随后将回收产物连接到pMD-19T载体并转化到大肠杆菌DH5α 感受态细胞中, 于含有氨苄青霉素的LB平板上进行阳性克隆筛选并挑取单菌落鉴定, 而后送往上海生工生物工程技术服务有限公司测序, 通过DNAMAN软件比对测序结果与电子克隆序列。
参考黄珑等[29], 应用在线工具ExPASyProtparam tool预测ScCAX1基因编码的蛋白一级结构、亲疏水性; 对其二级结构、亚细胞定位及功能预测和信号肽的预测则分别采用SOPMA[30]、SignalP 4.0 Server软件和Psort; 用SWISSMODEL在线预测工具预测分析蛋白三级结构; 通过NCBI中的CDD (Conserved Domain Database)数据库预测蛋白保守结构域; 用Blastp在线工具查找甘蔗ScCAX1同源氨基酸序列, 并使用DNAMAN7.0多重比对同源氨基酸序列, 使用MEGA5.1软件NJ (Neighbor-Joining)法(BootStrap 1000)构建系统进化树。
采用TRIzol法提取样品RNA, 包含SA、MeJA、ABA、PEG和NaCl胁迫处理材料及崖城05-179的组织特异性材料即根、茎、叶、皮、茎尖和芽组织材料。参照Prime-Script RT Reagent Kit操作说明书, 将RNA反转录合成cDNA得到模板。基于ScCAX1基因序列进行定量引物设计, 即qCAX1-2F和qCAX1-2R (表3), 内参基因为CUL和CAC, 内参基因的定量引物见表3[31]。PCR体系(20 μ L)含SYBRGreen Primix Ex Taq (2× ) 10 μ L、10 μ mol L-1上下游引物各0.8 μ L、cDNA 2.0 μ L、ddH2O 6.4 μ L。实时荧光定量PCR扩增程序为50℃ 2 min; 95℃ 10 min; 95℃ 15 s、60℃ 1 min, 45个循环; 增加熔解曲线; 反应时设置3次技术重复。组织特异性表达分析中, 未使用参照样品, 仅将ScCAX1基因在茎中的表达量定义为1, 其他组织中该基因的表达量与之相比。在ABI PRISM7500 Real-time PCR System软件上对定量数据初步分析后, 导致Microsoft Excel工作表, 采用2-Δ Δ Ct算法[32]分析实时荧光定量PCR试验结果, 计算3次重复数据的标准误后绘图。
| 表3 ScCAX1基因克隆与表达所用引物 Table 3 Primers used in ScCAX1 gene cloning and expression analysis |
应用电子克隆技术获得甘蔗Ca2+/H+反向运转体基因CAX1的cDNA全长序列, 并根据该序列设计1对特异性引物, 经过RT-PCR扩增获得约784 bp的单一条带(图1), 经过胶回收、连接转化、菌液PCR鉴定和测序。序列比对表明, RT-PCR扩增产物序列与电子克隆得到的序列同源性高达99.87%, 验证了电子克隆的正确性。将该基因命名为ScCAX1, 其GenBank登录号为KT799799。该基因的核酸序列及其推导的氨基酸序列如图2。
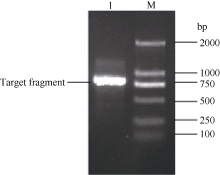 | 图1 甘蔗ScCAX1基因的RT-PCR扩增 M: marker 2000 bp; 1: RT-PCR产物。Fig. 1 RT-PCR amplification ofScCAX1gene in sugarcane M: DNA marker 2000 bp; 1: RT-PCR products. |
2.2.1 甘蔗ScCAX1基因编码氨基酸的一级和二级结构预测 甘蔗ScCAX1基因编码的蛋白一级结构预测显示, 该蛋白分子式为C1085H1689N259O301S9, 分子量为23.4 kD, 编码了214个氨基酸。其中等电点(pI)为4.71, 不稳定系数为23.70, 数值小于40表明该蛋白稳定, 推测为稳定的酸性蛋白质。二级结构预测显示, 甘蔗ScCAX1蛋白α -螺旋所占的比例最高, 为47.20%, 延伸链所占比例最低, 为24.77%, 无规则卷曲结构占22.90% (表4)。
2.2.2 甘蔗ScCAX1蛋白信号肽、疏水性/亲水性的预测和分析 甘蔗ScCAX1蛋白氨基酸残基的加权平均值较小, 为0.314 (< 0.5), 推测该蛋白不存在信号肽。即甘蔗ScCAX1蛋白为非分泌蛋白, 在细胞质中合成后不能被转运。
从图3可以看出, 第185位具有最高分值, 为3.533, 疏水性最强; 第195位具有最低分值, 为-2.733, 亲水性最强, 绝大部分氨基酸都表现疏水性, 推测甘蔗ScCAX1蛋白是一种疏水蛋白。
2.2.3 甘蔗ScCAX1蛋白三级结构预测 用SWISS- MODEL工具, 以SMTL id: 4k1c.1 Chain id: A为模板对ScCAX1、水稻、粟和玉米的蛋白三级结构进行预测, 序列同源性分别为39%、39%、39%和40%。如图4所示, 甘蔗ScCAX1蛋白的三级空间结构与水稻、粟和玉米蛋白的三级结构均以α -螺旋为主。
| 表4 甘蔗ScCAX1蛋白二级结构预测分析 Table 4 Secondary structure prediction of sugarcane ScCAX1 protein |
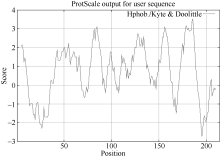 | 图3 甘蔗ScCAX1蛋白氨基酸疏水性/亲水性预测Fig. 3 Predicted hydrophobicity/hydrophilicity of the amino acid sequence of sugarcane ScCAX1 protein |
2.2.4 甘蔗ScCAX1蛋白的功能和亚细胞定位预测
该蛋白主要作为受体, 可能性为2.81, 其次也可能是转运子(2.19)和信号传感器(2.03)。甘蔗ScCAX1蛋白可能定位于叶绿体类囊体膜(71.2%)上, 其次是细胞质膜(60.0%), 再次是线粒体内膜(53.8%)。
2.2.5 甘蔗ScCAX1蛋白的保守结构域分析 如图5所示, 甘蔗ScCAX1蛋白隶属的家族为Na_Ca_ex superfamily, 具有Na+/Ca2+交换蛋白结构域, 即Na_Ca_ex (sodium/calcium exchanger protein)结构域。
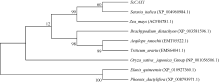
2.2.6 甘蔗ScCAX1蛋白的氨基酸序列同源性分析和系统进化树构建 甘蔗ScCAX1蛋白的氨基酸通过NCBI中的Blastp程序对其进行同源性分析, 可知该蛋白与玉米(Zea mays |ACF84781.1|)、粟(Setaria italica|XP004960984.1|)、小麦(Triticum urartu |EMS64041.1|)、山羊草(Aeqilops tauschii |EMT05522.1|)、二穗短柄草(Brachypodium distachyon |XP003581596.1|)、水稻(O. sativa japonica Group |NP001056506.1|)、油棕(Elaeis quineensis |XP01092 7362.1|)和海枣(Phoenix dactylifera |XP008793971.1|)蛋白的氨基酸序列相似性分别为93%、93%、88%、87%、86%、79%、77%和74%。氨基酸序列多重比对(图6) 表明, 甘蔗ScCAX1蛋白与玉米和粟的氨基酸相似性最高, 为93%, 而与小麦、山羊草、二穗短柄草等相似性较低。
进化树(图7)表明, 同属的棕榈科、油棕和海枣位于同一个分支; 而甘蔗ScCAX1、粟、玉米、小麦、山羊草和二穗短柄草同属于禾本科植物, 则为另一分支, 其中甘蔗ScCAX1和粟米亲缘关系最近。
 | 图4 甘蔗、玉米、水稻和粟CAX1蛋白三级结构预测Fig. 4 Predicted third structure of CAX1 protein in Saccharum spp. hybrids, Zea mays, Oryza sativa, and Setaria italica |
 | 图6 甘蔗ScCAX1蛋白与其他植物种蛋白的氨基酸序列比对Fig. 6 Homology analysis of sequences from sugarcane ScCAX1 and those of other species |
由图8可知, 甘蔗ScCAX1基因的表达具有组织特异性。该基因在茎中表达量最低, 而在叶中表达量最高, 为茎中的6.46倍, 此外芽中的表达量为茎中的3.5倍。
根据图9, 在MeJA胁迫下ScCAX1基因的表达呈“ 先抑后扬” 的表达模式, MeJA胁迫12 h后该基因的表达受到抑制, 表达量下降为最低值, 为对照的0.81倍, 而在胁迫24 h后表达量上调, 约为对照的1.24倍。NaCl胁迫下ScCAX1基因的表达则呈“ 扬— 抑— 扬” 的表达模式, 在6 h表达量上调, 为对照的2.14倍; 但在24 h表达量最低, 仅为对照的0.77, 而后在48 h表达量又有所上调。图9显示, 在ABA、SA和PEG胁迫下, ScCAX1基因的表达量均不同程度上调。在ABA胁迫下, 与6 h相比, ScCAX1基因的表达量在12 h有所下调, 但在24 h达到最高, 为对照的3.5倍。而SA胁迫下, 该基因表达量呈随胁迫时间增加而增加的趋势, 在胁迫24 h后表达量最高, 为对照的5.47倍。在PEG胁迫诱导下, 该基因的表达量在24 h最高, 为对照的1.97倍, 但在6 h、12 h无明显变化。
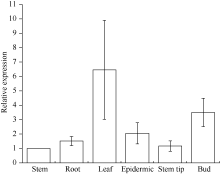 | 图8 甘蔗ScCAX1基因在不同组织中的表达误差线为每组处理的标准误差(n = 3)。Fig. 8 Relative expression of ScCAX1 gene in different tissues of sugarcaneError bars represent the standard error of each treating group (n = 3). |
钙元素在植物体中具有重要的作用, 在细胞中发挥着第二信使的作用, 它不仅与植物的生长发育和光合产物运输等有关, 还参与各种胁迫性防御反应[33, 34, 35, 36]。在植物中, Ca2+的转运很大程度上需依赖Ca2+/H+反向转运体, 但Ca2+/H+反向转运体基因在空间、功能等方面各不相同[33]。
本研究克隆获得ScCAX1基因, 基因序列是可靠的。该基因编码的蛋白为稳定酸性蛋白, 二级结构中α -螺旋所占比例最大, 该结果与郭园园等[37]关于烟草中CAX2基因的研究相一致。前人研究结果表明, 当氨基酸残基的加权平均值小于0.5时, 该蛋白不存在信号肽[38]。本研究中ScCAX1蛋白氨基酸残基的加权平均值为0.314 (< 0.5), 故推测该蛋白不存在信号肽。因为ScCAX1蛋白的GRAVY值为0.727, 当蛋白为疏水蛋白时, GRAVT数值大于零, 可以判断整条多肽链疏水性较强[39]。在保守结构域上, ScCAX1具有Na+/Ca2+交换蛋白结构域(Na_Ca_ex), 推测该蛋白属于整合膜蛋白, 可依据细胞质中Na+浓度, 调控Ca2+在细胞中的运动, 进而控制细胞内Ca2+浓度[40]。亚细胞定位预测结果显示, 该蛋白可能定位于叶绿体类囊膜、细胞质膜或者线粒体膜。根据前人研究发现, CAXs蛋白可能定位于液泡膜、质膜、叶绿体类囊膜和线粒体膜[41, 42], 如大豆GmCAX1[25]定位于质膜, 而盐地碱芽Put-CAX1则定位于液泡膜[43], 故对甘蔗中ScCAX1蛋白的亚细胞定位结果还需进一步实验验证。
实时荧光定量PCR分析结果显示, ScCAX1基因表达具有组织特异性, 在叶中的表达量最高, 茎中的表达量最低。而盐地碱蓬SsCAX1主要在茎和叶片中表达, 根部表达量非常低, 几乎检测不到[44]。因此, 不同植物中CAX1的组织特异表达模式是不同的, 这与前人的研究结果一致[45]。在非生物胁迫反应方面, 在SA、ABA、PEG胁迫下, 相对于对照, ScCAX1基因表达量均有不同程度上调, 而MeJA胁迫下, 该基因的表达模式为“ 先抑后扬” 。有报道显示, Ca2+参与激活SA介导的防卫反应基因的表达[46, 47], 推测随着SA胁迫时间的延长, Ca2+转运活跃从而导致ScCAX1基因表达量上升, 这解释了为什么本研究中ScCAX1基因表达量在SA胁迫下随时间的增加而增长。ABA在植物应答非生物胁迫中发挥重要的信号转导作用[47], PEG是理想的干旱胁迫模拟试剂[48]。干旱条件也能激发细胞内多条信号转导途径[49], 而Ca2+具有信使的作用, 在响应外界刺激等方面发挥着重要作用[2, 3, 4], 这也再次佐证了甘蔗ScCAX1基因与Ca2+的转运有着较为密切的联系。本研究中, 在ABA和PEG胁迫后的各时间点, ScCAX1基因表达量均高于对照, 推测可能是ABA、PEG逆境胁迫引起信号传导, 激发Ca2+信号, 导致与Ca2+转运密切相关的ScCAX1基因表达量上升。对于NaCl胁迫下的“ 先扬后抑再扬” 的表达模式, 可能的原因是胁迫6 h后传递了胁迫信号, 诱导ScCAX1基因表达量升高。同时, 这可能正是因为外源盐诱导导致植物体内出现离子平衡失调、膜脂过氧化和代谢紊乱等问题[50], 使得胁迫12 h的表达量骤降, 而胁迫24 h表达量开始升高恢复正常。综上所述, 该基因的表达受到外源干旱、盐胁迫等逆境条件的调控, 推测该基因在甘蔗抗逆境方面发挥一定的作用。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|